Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Пройдя без человеческого мозга приматов в стереотаксической космического
В этой статье
Резюме
Не-человеческое приматов является важным поступательное видов для нашего понимания нормальной обработки головного мозга. Анатомической организации мозга приматов может предоставить важную информацию о нормальных и патологических состояний у человека.
Аннотация
Использование не человеческих приматов обеспечивает отличную поступательного модель для нашего понимания развития и процессы старения в организме человека
протокол
Часть 1: Предварительная обработка тканей
- Ткань должна быть хорошо озарен параформальдегида, глутаральдегида или формалина. Это может быть достигнуто с помощью стандартных transcardial перфузии обычно используется для сбора других органов. В настоящем исследовании тема глубоко седативные с кетамин гидрохлорид (10 мг / кг, внутримышечно), эвтаназии с передозировкой натрия фенобарбитала (25 мг / кг, внутривенно) и перфузии transcardially 0,1 М PBS до полного exsanguinated.This следует на 4% параформальдегида решение в PBS в течение 5 мин (~ 1 литр).
Часть 2: стереотаксической блокировки
- Перед размещением голову в кадре стереотаксической координаты Horsley-Clarke/interaural нулевой плоскости должны быть приняты. Это теоретическая середина между ушами. Для измерения этой плоскости, ухо баров должны быть одинаково установлены в аппарате, затем поместите лезвие скальпеля в стереотаксического манипулятора и измерения средней точки между ухом баров. Это важно для определения, где блокировать ткани на основе исследований потребностей. Как только это будет завершена черепа необходимо быть готовым к фиксации в стереотаксического аппарата.
- Для того чтобы разместить голову в стереотаксическая рама нижняя челюсть должны быть удалены с костью rongeurs и скальпеля. Кроме того, кожа, мышцы и соединительную ткань должна быть удалена, чтобы разоблачить черепа. Как только соединительная ткань удаляется из черепа, подвергать мозг постепенное уничтожение черепа (табличной части затылочной кости, а также теменные, лобные кости объявление). В настоящей части эксперимента черепа имеет все готовы были удалены. Будьте осторожны, не полностью удалить височных костей, потому ушных каналов необходимо будет в целости и сохранности места голову в стереотаксической раме. Остальные вопрос оболочки должны быть удалены из открытых мозга. Череп теперь готовы быть помещены в стереотаксической раме.
- В том же порядке, в котором можно было бы выполнять стереотаксической хирургии, отрегулируйте глаза, неба и уха баров, что голова надежно фиксируется в стереотаксического аппарата. Место стереотаксического манипулятора в заданном передний / задний (/ P) координирует и переместите манипулятор для наружной стороны головного мозга. Медленно опустите лезвие в мозг, полностью поднять лезвие от мозга, а затем перейти медиально и нижнего лезвия снова. Повторите эти два шага, пока лезвие достигло наружной стороны противоположного полушария. Это завершает первый корональных блока. Для последующих корональных блоки двигать манипулятор 1 см в / P оси и повторять, пока весь мозг был заблокирован.
Часть 3: Удаление мозг от черепа
- Удалите головы от стереотаксической рамы и провести подвергается мозг в ладони. Постарайтесь обеспечить мозг, слегка размещения нянчиться мозга в ладони и оформить мизинец через лобные доли, это сводит к минимуму движение мозга в черепе. Для того, чтобы предотвратить высыхание пиальных поверхности мозга, место кусок PBS смоченной марлей через мозг. Держите голову крепко черепа и постепенно избавляться от оставшихся затылочной и височной кости вместе с позвоночником. Это подвергает базы и боковые стороны головного мозга. Наконец удалить все оставшиеся лобной кости и кости носа, которая позволит доступ к обонятельной луковицы. Важно, чтобы удалить лобной кости последний потому что, как вы удалите основания черепа мозг движется немного и лобных долей могут быть повреждены на зубчатые края Fontal кости. Срежьте и удалить оставшиеся оболочки материи. Аккуратно поднимите переднюю часть мозга, слайд-под скальпеля мозга и свободный мозг от черепа.
Часть 4: Измерения
- Есть ряд полезных измерений, которые могут быть сделаны до замораживания. Например, / P оси мозга с суппортом. Кроме того, удельная плотность может быть измерена путем взвешивания мозг, измерения объема по перемещению воды в мерный цилиндр последующим делением веса по объему перемещения (табл. 1).
Часть 5: Готово блокирование мозгом.
- Как правило, когда лезвие скальпеля вставляется в мозг она не достаточно долго, чтобы полностью проникнуть полный спинно-вентральной степени мозга. Как только мозг удаляют, а валовой измерений получены, возьмите ткани квантования лезвие и закончить блокирование мозгом через брюшную сторону мозга (рис. 2).
- До замораживания блоков, необходимо cryoprotect ткани в градуированных PBS-буферных растворах сахарозы (10, 20 и 30%) поддерживается на уровне 4 ˚ С до раковины мозга. Это обычно занимает ночной инкубации в 10%, 2-3 дней в 20%, а дополнительные 3-5 дней в 30% для блоков опускаются на дно сосуда. Ежедневная смена йE 30% раствором сахарозы рекомендуется.
Часть 6: Представитель Результаты
Есть ряд грубых морфологических измерений, которые могут быть сделаны как только мозг был удален из черепа. Они включают / P длины, веса и удельной плотности (табл. 1). Как правило, мы блок мозга в 6-7 блоков размером 1 см (рис. 1). Каждое изделие затем сфотографировали (рис. 2) и могут быть дополнительно расчлененные в зависимости от потребности в научных исследованиях или подготовленные для замораживания в градуированных решения сахарозы.
Тема | / P Длина (Мм) | Вес (В граммах) | Водоизмещение (Мл) | Удельная плотность (Г / мл) |
| O2303-2-1-1 | 64,3 | 28,1 | 24 | 1,171 |
| O5180-1 | 71,3 | 38,7 | 34 | 1,138 |
| O2708-3-1 | 62,8 | 28,7 | 26 | 1,104 |
| O9184-4-2 | 65,3 | 29,5 | 24 | 1,229 |
| N459-1-14-2 | 68,2 | 31,6 | 26 | 1,215 |
| СРЕДНЯЯ | 66,38 | 31,32 | 26,8 | 1,171 |
| STD DEV | 3,38 | 4,33 | 4,17 | 0,052 |
Таблица 1. Валовой Морфологические Измерения Right Hemisphere из 5 месяца Vervets
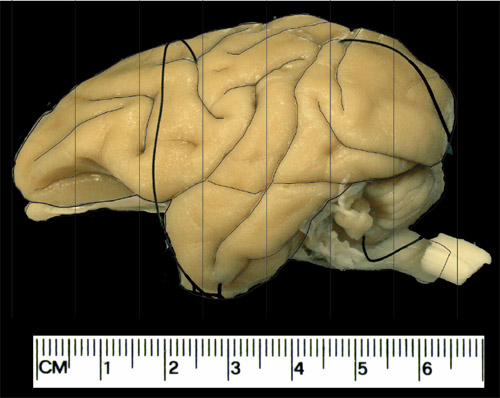
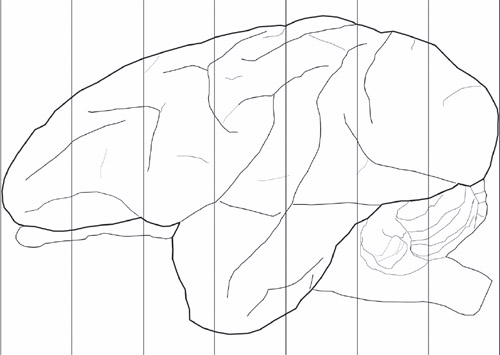
Рисунок 1. Схемы для корональных самолеты использовались для блокирования мозга. Это пример вовне мозга vervet взрослых. Пример блокирование процедуры. Вертикальные линии здесь располагается на 1 см, как правило, производит 7 корональные кварталах от каждого полушария.
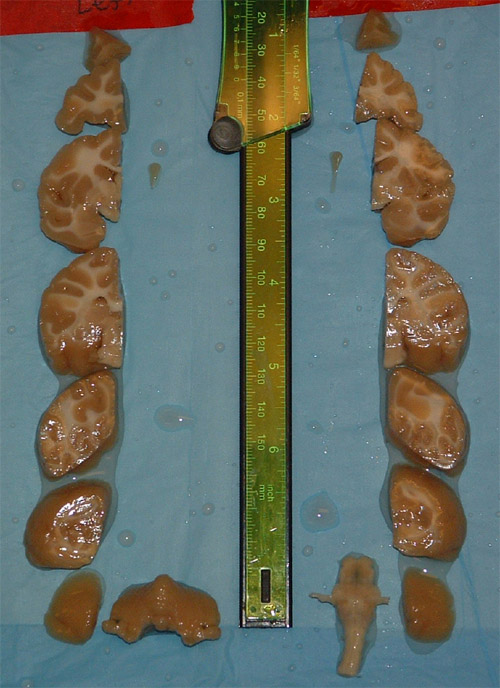
Рисунок 2. Блоки мозговой ткани в стереотаксической пространства. Каждый блок даст около 200 разделов, принятые на 50 мкм. С помощью этой схемы выборки более 1200 разрезы коры будут предприняты и дополнительные 400-500 из мозжечка, когда нарезанный в поперечной плоскости.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Сент-Китс vervet (Chlorocebus aethiops sabeus) является Старый приматов мира с аналогичной модели и цены коры и подкорковых развитие мозга, что и люди. Этот вид был использован для моделирования сложных человеческих поведенческих расстройств, таких как беспокойство поведению, гипертония 8, 9...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Авторы хотели бы поблагодарить Ikiel Ptito за его постоянную техническую поддержку. NSERC предоставлять депутат.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Scalpel | Fine Science Tools | 10003-12 | |
| Scalpel blades | Fine Science Tools | 10011-00 | |
| Scissors | Fine Science Tools | 14090-11 | Any surgical scissors are sufficient |
| Rongeurs | Fine Science Tools | 16121-14 | |
| Forceps | Fine Science Tools | 11027-12 | |
| Filter paper | Fisher Scientific | 09-924-150 | |
| Stereotaxic Frame | Kopf Instruments | ||
| Tissue slicing blade | Thomas Scientific |
Ссылки
- Gallagher, M., Rapp, P. R. The use of animal models to study the effects of aging on cognition. Annu Rev Psychol 48. , 339-370 (1997).
- Clancy, B., Darlington, R., Finlay, B. Translating developmental time across mammalian species. Neuroscience. 105, 7-17 (2001).
- Nowakowski, R. S., Rakic, P. The site of origin and route and rate of migration of neurons to the hippocampal region of the rhesus monkey. J Comp Neurol. 196, 129-154 (1981).
- Rakic, P., Bourgeois, J. P., Eckenhoff, M. F., Zecevic, N., Goldman-Rakic, P. S. Concurrent overproduction of synapses in diverse regions of the primate cerebral cortex. Science. 232, 232-235 (1986).
- Granger, B., Tekaia, F., Le Sourd, A. M., Rakic, P., Bourgeois, J. P. Tempo of neurogenesis and synaptogenesis in the primate cingulate mesocortex: comparison with the neocortex. J Comp Neurol. 360, 363-376 (1995).
- Zecevic, N., Rakic, P. Development of layer I neurons in the primate cerebral cortex. J Neurosci. 21, 5607-5619 (2001).
- Ervin, F. R., Palmour, R. M., Young, S. N., Guzman-Flores, C., Juarez, J. Voluntary consumption of beverage alcohol by vervet monkeys: population screening, descriptive behavior and biochemical measures. Pharmacol Biochem Behav. 36, 367-373 (1990).
- Palmour, R. M., Mulligan, J., Howbert, J. J., Ervin, F. Of monkeys and men: vervets and the genetics of human-like behaviors. Am J Hum Genet. 61, 481-488 (1997).
- Boire, D., Théoret, H., Ptito, M. Stereological evaluation of neurons and glia in the monkey dorsal lateral geniculate nucleus following an early cerebral hemispherectomy. Exp Brain Res. 142, 208-220 (2002).
- Bjugstad, K. B., Teng, Y. D., Redmond, D. E. J. r, Elsworth, J. D., Roth, R. H., Cornelius, S. K., Snyder, E. Y., Sladek, J. R. Jr Human neural stem cells migrate along the nigrostriatal pathway in a primate model of Parkinson's disease. Exp Neurol. 211, 362-369 (2008).
- Lemere, C. A., Beierschmitt, A., Iglesias, M., Spooner, E. T., Bloom, J. K., Leverone, J. F., Zheng, J. B., Seabrook, T. J., Louard, D., Li, D., Selkoe, D. J., Palmour, R. M., Ervin, F. R. Alzheimer's disease abeta vaccine reduces central nervous system abeta levels in a non-human primate, the Caribbean vervet. Am J Pathol. 165, 283-297 (2004).
- Mash, D. C., Staley, J. K., Doepel, F. M., Young, S. N., Ervin, F. R., Palmour, R. M. Altered dopamine transporter densities in alcohol-preferring vervet monkeys. Neuroreport. 7, 457-462 (1996).
- Burke, M. W., Palmour, R. M., Ervin, F. R., Ptito, M. Neuronal reduction in frontal cortex of primates after prenatal alcohol exposure. Neuroreport. 20, 13-17 (2009).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены