Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Изображений экзоцитоза в клетки сетчатки Биполярный с Микроскопия TIRF
Резюме
В этом видео показано, как на этикетке и визуализировать один синаптических пузырьков экзоцитоза и торговлей золотыми рыбками биполярных клеток сетчатки использованием полного внутреннего отражения флуоресценции (TIRF) микроскопии.
Аннотация
Полное внутреннее отражение флуоресценции (TIRF) микроскопия является метод, который позволяет изучать события, происходящие на клеточную мембрану, селективного изображений флуоресцентных молекул, которые находятся ближе всего к высоким показателем преломления вещества, такие как стекло
протокол
Часть 1: Разбор и изоляции Биполярный сотовый
- Подготовка решений, перечисленных в таблице 2; рН звонков "(внешний) решения должны быть скорректированы до 7,4 с NaOH и рН внутреннего решения должны быть скорректированы до 7,2 с CsOH. Защита внутреннего решения от света с алюминиевой фольгой и хранить его при температуре 4 ° С до использования;
- Темно-адаптировать золотая рыбка, по крайней мере за 30 минут до вскрытия;
- Хотя животное темно-адаптируется, готовить 5 мл гиалуронидазы (тип гиалуронидазы V, 1100 ед / мл в странах с низким Ca 2 + Рингера; Sigma, Сент-Луис, Миссури) и 10 мл L-цистеина (0,5 мг / мл в странах с низким Ca 2 + Рингера) решений и весят папаин (лиофилизированный порошок, 40 единиц / мл, Sigma, Сент-Луис, Миссури) в течение 5 мл пищеварения решения;
- Эвтаназии золотая рыбка быстрым обезглавливание с хирургическими ножницами и уничтожить головного и спинного мозга с № 11 лезвие скальпеля;
- Удалить глаза, уничтожив экстра-глазных мышц с помощью # 7 изогнутых щипцов Дюмон и резки зрительного нерва с диафрагмой ножницы;
- Место один глаз лампочки на кусочек фильтровальной бумаги и прокол склеры лимба с кончика # 11 лезвие скальпеля;
- Представьте лезвие ножниц vannas внутри проколотого целом и сократить весь переднего сегмента прочь;
- Место небольшой кусочек фильтровальной бумаги поверх оставшихся глазного бокала и оказывают некоторое давление, чтобы иметь бумагу помочь с стекловидного тела;
- Поднимите фильтровальной бумаги с сетчаткой прилагается к нему и сократить зрительного нерва с номинальной vannas ножницы;
- Место фильтр документ, содержащий сетчатки в 35 мм блюдо пластической культуры с гиалуронидазы решения и шелушиться сетчатку от фильтровальной бумаги с помощью # 7 Дюмон пинцетом;
- Вырезать сетчатки на 4-6 частей с половины промышленных углеродистой стали одним лезвием и оставьте в растворе гиалуронидазы в течение 20 минут;
- В ожидании гиалуронидазы вступили в силу, добавляют 5 мл L-цистеин решение папаин и пусть сидят, пока жидкость не станет прозрачным (примерно 5-10 минут);
- Вымойте части сетчатки 3x в странах с низким Ca 2 + Рингера, и пусть они сидят в папаин решение в течение 30-35 минут;
- Вымойте части сетчатки 3x в странах с низким Ca 2 + Рингера и хранить их до использования при температуре 4 ° С на 35 мм пластиковый блюдо культуры с низким содержанием Са 2 + Рингера;
- Чтобы отделить клетки, положить кусочек сетчатки в микроцентрифужных пробирку, содержащую 500 мл низкий Са 2 + Рингера и медленно растирают сетчатки с помощью пипетки его вверх и вниз с бокалом диссоциации пипетки, осторожно, чтобы не производить любые воздушные пузыри. Диссоциация пипетки изготавливаются путем нагревания до кончика стеклянной пипетки Пастера с горелкой Бунзена и слегка согнув ее с помощью анатомического пинцета;
- Пластина изолированных клеток путем добавления капли сетчатки подвески самодельные камеры записи ранее заполненную 2 мл низкой Са 2 + Рингера. Камера состоит из нижней половины 35-мм пластиковыми блюдо культуры с круговой целом в середине и круговой покровное 1,78 преломления стекла (PlanOptik, Германия) приклеена к нижней с кремнием эластомер (Sylgard 184; Dow Corning , Midland, MI).
Часть 2: Биполярный сотовый Загрузка и промыть
TIRF изображений синаптических пузырьков лучше всего проводить с помощью предметно-типа TIRFM микроскоп с очень высокой Н. А. объективных и чувствительной камерой. Для наших экспериментов мы решили использовать 1,65 NA цели (Apo x100 O HR, Н. А. 1,65, Olympus, Япония) с EMCCD (Каскад 512B, Ропер Научная, Тусон, штат Аризона). Использование очень высоких целей Н.А. требует использования высоких преломления стекла покровные и иммерсионной жидкости (ди-йодометан с серой). В наших условиях, возбуждающего света ограничивается экспоненциально затухающей поле с постоянной длиной около 50 нм.
- Добавить каплю высоколиквидных показателем преломления (M серии, показатель преломления = 1,7800, Cargille Labs, Сидар-Гров, штат Нью-Джерси) для объектива микроскопа;
- Место записи камеры тщательно поверх объектива микроскопа и тщательно крепление электрода землю и superfusion выхода трубы в камеру;
- Позвольте камере сидеть на микроскоп в течение 10-20 минут, чтобы дать клеткам раковиной и придерживаться дна;
- В то же время, готовить 5 мл 1mM тролокса ® ((±)- 6-гидрокси-2 ,5,7,8-tetramethylchromane-2-карбоновой кислоты; Sigma, Сент-Луис, Миссури) решение в высоком K + Рингера . Разрушать ультразвуком до полного растворения;
- Подготовка 15 мл ADVASEP-7 моющего раствора: 1 мм ADVASEP-7 (Sigma, Сент-Луис, Миссури) в странах с низким Ca 2 + Рингера. Обратите внимание, что ADVASEP-7 использование не является обязательным и может быть опущено при желании;
- Чистки superfusion лиРЭШ и добавить ADVASEP-7 моющего раствора, низкий Са 2 + звонок и контроль звонка на superfusion системы;
- Вытяните загрузки пипетки из тонкостенных боросиликатного стекла (Kwik-Fil ® TW150-3; WPI, Сарасоте, штат Флорида). Puffer пипетки сопротивления в 1,5-2,5 МОм диапазона;
- Подготовка FM1-43 ® (N-(3-triethylammoniumpropyl) -4 - (4 - (dibutylamino) стирил) пиридиния дибромида ", специальная упаковка"; Invitrogen, Карлсбад, Калифорния) решений. Во-первых, сделать 1 мМ акции путем добавления 160 мкл дистиллированной воды до одного флакона (100 мг) FM1-43 ®. Этот запас можно хранить при температуре 4 ° С не более одной недели. Затем добавить 5 мкл FM1-43 ® по 1 мл высокой K + Рингера + 1mM тролокса ®. Защита решение от света с алюминиевой фольгой и держать его при температуре 4 ° С до использования;
- Включите яркий свет микроскопа поле и поиска нетронутыми биполярные клетки. Слегка нажмите на микроскопом, чтобы убедиться, что нейроны прочно прикреплены к нижней части камеры;
- Позиция superfusion пера близко к ячейке интерес и постоянно заливать препарат с низким Ca 2 + Рингера;
- Выключите комнате свет и добавить красный длинный пас фильтр (т.е. RG630, Schott, Германия) в оптическом пути, чтобы минимизировать возбуждение FM красителя;
- Заполните загрузки пипеткой по 10 мкл раствора красителя FM, смонтировать пипетки в микроманипулятора и нижней пипетки на препарат без избыточного давления, пока она находится на том же фокальной плоскости, как клетка биполярного вы хотите загрузить. Убедитесь, что вы по крайней мере два держателя электрода: один используется для FM краситель не может быть использован для зажима патч, иначе это может вызвать загрязнение внутриклеточного раствора;
- Позиция фугу открытие на расстоянии приблизительно 10 мкм от аксона терминал, включите superfusion система выходные и слоеного раствор красителя в течение 10 секунд, поворачивая пипетки избыточное давление на;
- Включите избыточное давление выходные и, не двигаясь пипетки, подождите 30 секунд;
- Включите superfusion и купаться на камеру в ADVASEP-7 решение в течение 5 минут. В то же время, удалять пипеткой фугу из ванны;
- Через 5 минут, переключитесь на низкие Са 2 + звонка и заливать камере в течение 25-30 минут, чтобы дать удаления излишков краски.
Часть 3: Патч Зажимные и TIRFM изображений
- Хотя подготовка вымывания, тянуть патч пипетки из толстостенных боросиликатного стекла (B150-86-10; Саттер Instrument Company, Новато, Калифорния). Патч пипетки сопротивления в диапазоне 8-10 МОм;
- После промыть завершения место аксон терминала в центре поля зрения;
- Заполните патч пипетки с 7μL внутренних решение, нажмите пипетку, чтобы избавиться от пузырьков воздуха, пальто пипетки с расплавленным воском стоматологические (Sticky воска; Корпорация Kerr, Орандж, Калифорния) и установите его в микроманипулятора;
- Включите пипетки избыточное давление на и нижних пипетка медленно на подготовку. Проверить пипетки сопротивления в усилитель и правильное смещение пипетки и емкости с соответствующим управления усилителем;
- Коммутатор superfusion контролировать Рингера. Чтобы создать gigaseal между пипеткой и клетки, слегка коснуться кончика электрода от тела клетки и превратить пипетки от избыточного давления, мягко применения отрицательного давления на электрод;
- Хотя запечатаны, выберите "целой клетки" режим усилителя и набор кювета потенциал -60 мВ;
- Выберите регион интересов с обработки изображений, которая охватывает весь окончание аксона, включите яркий свет от поля и, кратко разоблачения (30 мс), терминал для 488 нм лазер, найти правильный фокальной плоскости для TIRF изображений;
- Перерыв в клетку с помощью "Зап" командование усилитель при применении небольшое отрицательное давление пипетки;
- Правильный код для емкость ячейки и последовательное сопротивление, а затем применить напряжение протокол интересов в ходе визуализации движения синаптических пузырьков. Именно на этом этапе важно, чтобы напряжение протокол синхронизированы с частотой кадров камеры. В нашем случае, у каждого кадра 30 мс долго, так что напряжение изменения происходят в виде комплекта из этой величины (например, каждые 300 мс или 10 кадров);
- Подождите не менее 40 секунд между испытаниями, чтобы обеспечить восстановление;
- Для проверки положения синаптических лент, фотографировать во время поворота 561 нм лазер.
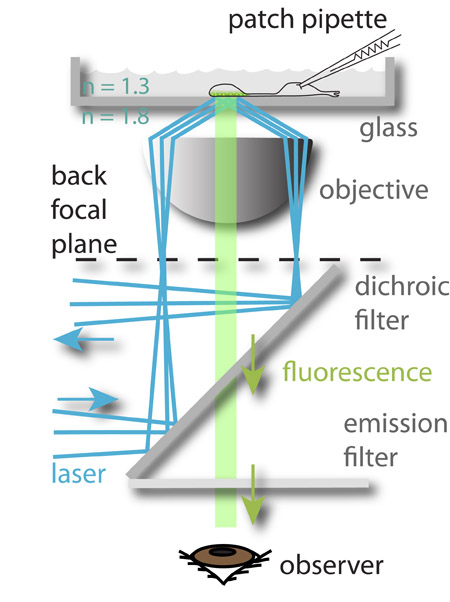
Рисунок 1: экспериментальная установка. 488 нм лазер (синий) ориентирована на периферию задней фокальной плоскости объектива и страдает полного внутреннего отражения, когда он достигает стекла водного интерфейс среды. Электромагнитное поле, создаваемое отраженный луч возбуждает флуорофора загружается в синаптических пузырьков ближе всего к бутом из стеклянной камеры, которая затем флуоресцируют (зеленый). Флуоресцентный свет затем подводится к глазу наблюдателя (изображено) или ПЗС-камерой. Мембранный потенциал отображаемого клеток контролируется одновременно патч-зажима их. Такой подход позволяет изучать отношения между входящими сигналами (мембранные напряжения) и нейронных выход (экзоцитоз).

Рисунок 2: Типичные результаты. Слева: яркое изображение области изолированной камере биполярного золотых рыбок. В правом верхнем углу: TIRF образ синаптических пузырьков в аксон терминала ячейки биполярные загружается с FM 1-43 ® и полученную с использованием 488 нм лазер (FM краситель). Внизу справа: изображения одного и того же терминала после обновления клеток и изображений аксонов терминала с 561 нм лазер. Synaptic лентами помечены родамина основе Рибай-связывающий пептид (Rpep_rhod).
Таблица 1: Специальные реагенты и оборудование.
Имя | Тип | Производитель | Каталог | Комментарий |
| - | Воздух таблице | Ньюпорт корпорации | - | - |
| IX70 | Инвертационный микроскоп | Олимп | - | Оснащен вольфрамовой лампы для светлого поля и бокового открытия портов для TIRF |
| TH4-100 | Источник Мощность лампы | Олимп | - | - |
| FF498_581-DI01 | Дихроичных фильтра | Semrock | - | - |
| NF01-405_488_568 | Эмиссия фильтра | Semrock | - | - |
| Апо x100 O HR | Цель | Олимп | - | Н. А. 1,65 |
| RG630 | Красный стеклянный фильтр | Schott | - | - |
| - | 488 нм лазерный | Когерентный | - | Используйте минимальное количество энергии |
| - | Затвор | Uniblitz | - | - |
| VMM-D1 | Затвор драйвера | Uniblitz | - | - |
| - | 561 нм лазерный | Меллес Griot | - | - |
| - | Затвор | Uniblitz | - | - |
| VMM-D3 | Затвор драйвера | Uniblitz | - | - |
| Комплект перфузионного давления | Superfusion системы | Автоматизация Научные | 09-04 | - |
| Перфузии Pen | Superfusion системы | Автоматизация Научные | - | - |
| Valvelink 8 | Контроллер Superfusion системы | Автоматизация Научные | - | - |
| Каскад 512B | Е. М. CCD камера | Ропер Научная | - | - |
| Метаморф 7,1 | Изображений программное обеспечение | Molecular Devices | - | - |
| EPC-9 | Усилитель Patch Clamp | Хека Elektronik | - | - |
| Импульс | Усилитель Software | Хека Elektronik | - | - |
| MP-285 | Микроманипулятор | Саттер Инструмент | - | - |
| - | Электрододержатель | Хека Elektronik | - | Для 1,5 мм OD стекла, 2 шт |
| Kwik-Fil ® TW150-3 | Боросиликатного стекла Капиллярный | WPI | - | Без накаливания |
| B150-86-10 | Боросиликатного стекла Капиллярный | Саттер Инструмент | - | С накаливания |
| Р-97 | Микроэлектродные Puller | Саттер Инструмент | - | Оснащен 3х3 нити окно и экологических камеры |
| - | Давление воздуха Вакуумный насос | Томас Научные | 7893B05 | Создает вакуум для удаления жидкости из камеры и избыточное давление для пипеток |
| MatLab R2008a | Программное обеспечение для анализа | MathWorks | - | - |
| 353001 | 35 мм пластиковой посуды культуры | Сокол | - | - |
| - | Высокий показатель преломления стекла | PlanOptik | - | Показатель преломления 488 нм = 1,78 |
| Серия M | Высокий показатель преломления жидких | Cargille Labs | - | Показатель преломления = 1,78 |
| Sylgard 184 | Кремний Эластомер Kit | Dow Corning | - | - |
| Глутатион | Трипептид | EMD Химические вещества | Бесплатный Radicaл мусорщик | |
| Гиалуронидаза | Фермент | Сигма | H6254 | Тип V |
| L-цистеин | Аминокислота | Fluka | 30090 | Активизирует папаин |
| Папаин | Фермент | Fluka | 76220 | С папайя Carica |
| Trolox ® | Растворимый витамина Е | Сигма | 56510 | Свободных радикалов |
| ADVASEP-7 | Сульфоуголь В-циклодекстрина | Сигма | A3723 | Снижает FM 1-43 ® фоновой флуоресценции |
| FM 1-43 ® | Флуоресцентная краска | Invitrogen | T35356 | "Специальная упаковка" |
| Важная Воск | Внесите покрытие агент | Корпорация Kerr | - | Уменьшает пипетки емкостью |
Таблица 2: Физиологические решения, использованные в этом исследовании.
Вещество | Низкий Са 2 + Рингера | Управление Рингера | Высокая K + Рингера | Внутреннее решение |
| NaCl | 120 мМ | 120 мМ | 97,5 мМ | - |
| KCl | 2,5 мМ | 2,5 мМ | 25 мМ | - |
| MgCl 2 | 1 мМ | 1 мМ | 1 мМ | 4 мМ |
| CaCl 2 | 0,5 мМ | 2,5 мМ | 2,5 мМ | - |
| HEPES | 10 мМ | 10 мМ | 10 мМ | 10 мМ |
| EGTA | 0,75 мм | - | - | 0,5 мМ |
| Глюкоза | 10 мМ | 10 мМ | - | - |
| Глутатион | 2 мМ | 2 мМ | - | 1 мМ |
| CH 3 CSO 3 S * | - | - | - | 100 мМ |
| TEACl | - | - | - | 10 мМ |
| ATP-Mg | - | - | - | 10 мМ |
| ГТФ-Li | - | - | - | 1 мМ |
| Rpep-rhod ** | - | - | - | 5 мМ |
| Объем | 200 мл | 100 мл | 5 мкл | 100 мкл |
* Цезий метансульфонат.
** Рибай-связывающий пептид: родамина + EQTVPVDLSVARDR-COOH (1997,75 МВт).
Обсуждение
Преимущества объективного типа микроскопии TIRF в том, что 1) он обеспечивает отличные оптические секционирования, ограничивая возбуждающего света к узкой области в фокальной плоскости объектива, тем самым минимизируя вне фокусировать свет, 2), поскольку световые капли экспоненциально с расстояни?...
Благодарности
Эта работа была поддержана NIH Грант EY 14990.
Ссылки
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Traffic. 2, 764-774 (2001).
- Zenisek, D., Steyer, J. A., Almers, W. Transport, capture and exocytosis of single synaptic vesicles at active zones. Nature. 406, 849-854 (2000).
- Zenisek, D. Vesicle association and exocytosis at ribbon and extraribbon sites in retinal bipolar cell presynaptic terminals. Proc. Natl. Acad. Sci. U. S. A. 105, 4922-4927 (2008).
- Zenisek, D., Horst, N. K., Merrifield, C., Sterling, P., Matthews, G. Visualizing synaptic ribbons in the living cell. J. Neurosci. 24, 9752-9759 (2004).
- Axelrod, D. Selective imaging of surface fluorescence with very high aperture microscope objectives. J. Biomed. Opt. 6, 6-13 (2001).
- Rouze, N. C., Schwartz, E. A. Continous and transient vesicle cycling at a ribbon synapse. J. Neurosci. 18, 8614-8624 (1998).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены