Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Флуоресцентная маркировка Drosophila Структур сердца
Резюме
Здесь мы опишем основные протокол для флуоресцентной маркировки различных элементов сердце труб из личинки и взрослых Дрозофилы. Эти образцы хорошо подходят для работы с изображениями с помощью люминесцентных или конфокальной микроскопии. Эта техника позволяет детальный структурный анализ особенностей сердца от могучий организм модели.
Аннотация
протокол
Перед тем как начать
- Подготовьте следующие решения:
- расслабляющий буфера (искусственный дрозофилы гемолимфы (АДГ) (см. "Визуализация бьющегося сердца у дрозофилы"), который содержит 10 мМ EGTA)
- фиксатор (4% формальдегида в 1x PBS)
- PBSTx (PBS, содержащего 0,1% Triton-X-100)
- Надлежащим разбавленный первичной и видоспецифических флуоресцентно меченых вторичных антител в PBSTx
- Рассеките дрозофилы подвергать сердечной трубки (взрослых мух и / или личинок) после
- полу-дрозофилы сердце нетронутой подготовке протокола в "Визуализация бьющегося сердца у дрозофилы", или
- Дрозофилы личинок NMJ Dissection протокол 1 со следующими изменениями: Используйте кислородом АДГ в личиночной рассечение и сворачивайте задний штифт немного от вентральной срединной линии. Личинки разрезать вдоль вентральной срединной линии. Не удаляйте любой ткани до фиксации.
Флуоресцентные Окрашивание
- Убедитесь, что все сердце ритмично бьется в кислородом АДГ. Быстро заменить АДГ с расслабляющими буфера. Исследуйте каждый сердечной трубки для обеспечения сокращения подавляются.
- Fix сердца заменив расслабляющий буфера с фиксатором. Инкубируйте при комнатной температуре в течение 20 минут с осторожном встряхивании. (Для личиночной встряхивании препарата нет необходимости в какой-либо шаг, и может считаться ущерб сердечной целостности ткани).
- Вымойте образцов три раза за десять минут с PBSTx при комнатной температуре при постоянном встряхивании.
- Для взрослых, тщательно отделки назад вентрального края брюшной кутикулы, что то, что остается более эллиптические и менее округлый. Кроме того, с одним разрезом между брюшной полости и грудной клетки, тщательно и аккуратно отдельных обоих сегментах тела и обеспечить минимальные повреждения передней части сердца. Для личиночной сердца, тщательно удалить жир с использованием тонких щипцов. Удаление жира должна быть выполнена с особой осторожностью, так как личиночные сердца особенно хрупка и имеет очень мало поддержки со стороны других мышц или соединительной ткани. Не снимайте трахеи отрасли, как это может повредить сердце.
- Передача отделаны грудном отделе брюшной кутикулы по краям, избегая контакта с центре города сердечной трубки, в 96 ячейках с колодцами, которые содержат 50-100 мкл первичных антител разводят в PBSTx. Место не более 12 особей на хорошо. Инкубируйте при комнатной температуре в течение 2 часов при непрерывном перемешивании. Инкубационный также может быть сделано в течение ночи при 4 ° C.
- Удалите первичный решение антител. Вымойте сердца в три раза за десять минут со 100 мкл PBSTx при комнатной температуре при постоянном встряхивании.
- После удаления окончательного промывочный буфер, добавьте 100 мкл вторичными антителами в PBSTx, дополненные Alexa594-фаллоидином (1:1000). Инкубируйте в течение одного часа с постоянной тряски при комнатной температуре. Храните образцы покрыты для предотвращения флуорофора отбеливания.
- После вторичного инкубации, мыть сердца в три раза за десять минут с 100 мкл PBSTx при комнатной температуре при постоянном встряхивании. Храните образцы покрыты протяжении этапов промывки.
- Для удаления Triton-X-100, промыть сердца последний раз в 100 мкл PBS в течение 10 минут. Образцы можно хранить в темном месте при температуре 4 ° С в течение нескольких дней до начала монтажа.
Монтаж для взрослых сердца
- Соблюдайте два 18 х 18 мм скользит корки до предметное стекло микроскопа с 10 мкл Vectashield монтажа среды. Покровные стекла должны быть расположены ~ 10-15 мм друг от друга. Нанесите небольшое падение третьего монтажа среду в промежутке между двумя покровные.
- Место 20 мкл Vectashield в центре третьего покровное.
- Осторожно удалите каждый из сердца от промывочного раствора PBS по крайней края кутикулы и аккуратно разместить их сердца стороной вниз на каплю монтажа среды на третье покровное. Место не более пяти сердца на каплю на покровное.
- Проверьте под микроскопом, чтобы убедиться, что все сердца вниз.
- Аккуратно переверните покровное содержащие сердца и быстро разместить его на слайд, содержащий пару покровные так, что капли с сердечным предохранители труб с каплей Vectashield между покровным пары. "Мост" должен быть сформирован на покровные стекла. Сердцах будет приостановлено между покровное и предметное стекло.
- Проверьте под микроскопом, чтобы сердца теперь вверх.
- Fix покровные по краям с лаком для ногтей.
- Сердцах теперь готовы для включения в образ с помощью люминесцентных или конфокальной микроскопии.
Монтаж для личинок сердца
- Место падения (~ 20 мкл) Vectashield на предметном стекле микроскопа.
- Тщательно передачи до двух личиночных образцов в Vectashield и ориентировать их спинной стороны вниз с помощью вольфрамовой иглы.
- Индивидуально перетащить образцы из монтажа средних и выравнивание каждого параллельно.
- Место покровное на противоположных сторонах образца. Использование щипцов, место 1 / 3 покровное на вершине, во-первых, заложив одну сторону на задней покровное и снижение его до передней покровное образуя мостик. Капиллярные силы вызовет поток Vectashield от задней к передней, который помогает надлежащему расположению личиночной сердце.
- Устранены все покровные на месте, по их краям, лаком для ногтей и аккуратно заполнить пространство между покровные с 20-30 мкл Vectashield.
- Печать с лаком для ногтей и хранить при температуре 4 ° С, или для длительного хранения при температуре -20 ° C.
Представитель Результаты
При выполнении правильно, все компоненты и связанные с ними тканей спинного сосуда должно оставаться неповрежденным и легко визуализировать. Фоновой флуоресценции должно быть минимальным. Для взрослых, вентральной продольные пятна мышечный слой очень хорошо, и производит существенный сигнал (рис. 1 и 2). Лежащий в основе круговой кардиомиоцитов однако, как правило, не производят, как интенсивный сигнал, что и вышележащих вентральный слой. Миоцитов в передней "конической палата" взрослого сердца содержат значительное количество сократительных материала и, следовательно, этот регион представляется как наиболее надежные по отношению к остальной части сердечной трубки. Личиночное сердце показывает расположение спирали миофибриллярных похож на взрослого сократительной кардиомиоцитов (рис. 3).
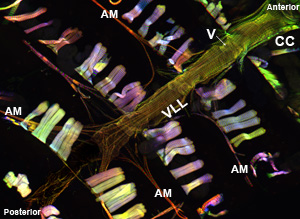
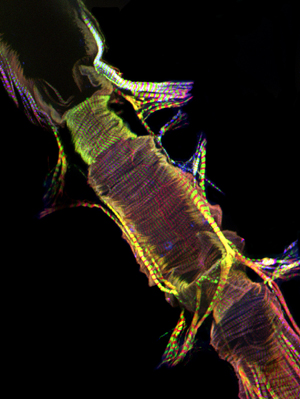
Рисунок 1: Top. Флуоресцентные микрофотография показывает весь сердечной трубки взрослых дрозофилы, что выражает миозина-GFP. Снимок был сделан с Zeiss Imager Z1 флуоресцентный микроскоп оснащен скользящей Apotome модуля. Миозина-GFP отображается зеленым цветом, актин окрашивается AlexaFluor ® 594 фаллоидином (красный) и α-актинина помечена с анти-α-актинина антител (синий). Обратите внимание на процедуру препаративной разрешений восстановления сердечной образцов с хорошо сохранившимися структурами. CC = конической камеры; AM = крыловидный мышцы, V = внутренний клапан; VLL = вентральный продольный слой мышц. Bottom. Области взрослого сердечной трубки из ЦК через 3-й сегмент брюшка сердца прямо под вентральной продольный слой показывающие расположение миофибрилл спирали из сократительных кардиомиоцитов. Пожалуйста, нажмите здесь для увеличения рисунка 1а, и здесь для большей версии рисунке 1b
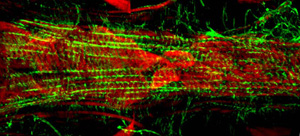
Рисунок 2: Представитель конфокальной штабеля передняя часть взрослого сердце окрашивали AlexaFluor ® 594 фаллоидином (красный) и анти-Pericardin (коллагена типа IV) (зеленый) антител. Pericardin связано с сердцем вдоль брюшной поверхности, вероятно, происходящих из продольно ориентированные миофибриллы брюшной мышечный слой. Пожалуйста, нажмите здесь для увеличения на рисунке 2.

Рисунок 3: флуоресцентный микрофотография сегмента А7 сердца собственно третьей стадии личинки дрозофилы. Снимок был сделан с Zeiss Imager Z1 флуоресцентный микроскоп оснащен скользящей Apotome модуля. Актина помечена AlexaFluor ® 594 фаллоидином (зеленый) и α-актинина окрашивается с анти-α-актинина антител (красный). Пожалуйста, нажмите здесь для увеличения на рисунке 3.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Здесь мы приводим протокол полезно для подготовки и окраски спинной дрозофилы судна и связанные с ними тканей для работы с изображениями с помощью люминесцентных или конфокальной микроскопии. Мы предоставляем краткий отчет о шагах уточнены и обычно используются в нашей лаборато...
Access restricted. Please log in or start a trial to view this content.
Благодарности
Авторы выражают благодарность С. И. Бернштейн (San Diego State University) за критическое прочтение и полезные предложения по подготовке этой рукописи. Эта работа была поддержана грантами NIH С. И. Бернштейн, СДСУ и Р. Бодмер, BIMR; и пост-докторские стипендии с партнерской западных государств Американской ассоциации сердца к Г. Фоглер и А. Cammarato.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments | |
| Ethylene glycol-bis (2-amino-ethylether) -N,N,N’,N’-tetra-acetic acid (EGTA) | Reagent | Sigma-Aldrich | E4378 | |
| Formaldehyde, 10%, methanol free, Ultra Pure | Reagent | Polysciences, Inc. | 50-00-0 | |
| Triton-X-100 | Reagent | Sigma-Aldrich | 9002-93-1 | |
| Alexa Fluor® 594 phalloidin | Reagent | Invitrogen | A12381 | |
| Vectashield® Mounting Medium for Fluorescence with DAPI | Reagent | Vector Laboratories | H-1200 | |
| Tungsten pins | Reagent | Fine Science Tools | 26002-10 | |
| Pin holder | Reagent | Fine Science Tools | 26018-17 |
Ссылки
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. , (2009).
- Molina, M. R., Cripps, R. M. Ostia, the inflow tracts of the Drosophila heart, develop from a genetically distinct subset of cardial cells. Mech Dev. 1, 51-59 (2001).
- Dulcis, D., Levine, R. B. Glutamatergic innervation of the heart initiates retrograde contractions in adult Drosophila melanogaster. J Neurosci. 2, 271-280 (2005).
- Zeitouni, B. Signalling pathways involved in adult heart formation revealed by gene expression profiling in Drosophila. PLoS Genet. 10, 1907-1921 (2007).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological change. J. Morphol. 2, 351-399 (1936).
- Miller, A. The internal anatomy and histology of the imago of Drosophila melanogaster. , Wiley. New York. (1950).
- Rizki, T. M. The circulatory system and associated cells and tissues. , Academic Press. New York. (1978).
- Cammarato, A. Myosin transducer mutations differentially affect motor function, myofibril structure, and the performance of skeletal and cardiac muscles. Mol Biol Cell. 2, 553-562 (2008).
- Taghli-Lamallem, O. Dystrophin deficiency in Drosophila reduces lifespan and causes a dilated cardiomyopathy phenotype. Aging Cell. 2, 237-249 (2008).
- Kelso, R. J. a database documenting a GFP protein-trap insertion screen in Drosophila melanogaster. Nucleic Acids Res. 32, D418-D420 (2004).
- Dietzl, G. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 7150, 151-156 (2007).
- Mery, A. The Drosophila muscle LIM protein, Mlp84B, is essential for cardiac function. J Exp Biol. 211, 15-23 (2008).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены