Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
ELIME (фермент иммуноферментный магнитных электрохимический) метод обнаружения микотоксинов
Резюме
Протокол для обнаружения трихотецены (микотоксины заботы о здоровье человека), используя недавно разработанный метод скрининга на основе конкурентных иммунохимического метода и окончательного выявления электрохимический продемонстрировано.
Аннотация
Иммунологического являются реальной альтернативой более дорогим и трудоемким количественных ВЭЖХ или GC 1, 2 методы скрининга обнаружения опасных микотоксинов в пищевых товаров. В этом протоколе мы покажем, как изготовить и допросить электрохимической конкурентной Фермент связан иммуномагнитный анализ, основанный на использовании магнитных шариков в виде твердых поддержку иммунохимических цепочке 3 и трафаретной печатью электродов в качестве чувствительных платформы.
Наш метод имеет целью определить общую сумму НТ-2 и Т-2 токсины, микотоксины, принадлежащих трихотецены семьи и большой опасностью для здоровья человека 4. Использование антител клон с перекрестной реактивности на 100% по отношению к НТ-2 и Т-2 позволяет одновременно обнаруживать как токсины с аналогичными чувствительности 5.
Первым шагом нашего анализа является покрытие шаг, где мы обездвижить HT2-KLH сопряженных токсина на поверхности магнитных бус. После блокировки шаг, необходимо, чтобы избежать неспецифического поглощения, добавление моноклональных антител позволяет конкуренция между иммобилизованным НТ-2 и свободной HT-2 или Т-2 присутствует в образце или растворенные в стандартное решение.
В конце конкурса шаг, количество моноклональных антител связан с иммобилизованным НТ-2 будет обратно пропорциональна количеству токсина в растворе образца.
Вторичных антител, меченных щелочной фосфатазы (AP) используется, чтобы выявить связь между специфических антител и иммобилизованных НТ-2. Последним шагом измерения выполняются путем отказа аликвоту магнитной бусины подвески, соответствующие конкретного образца / стандартное решение, на поверхности трафаретной печати рабочего электрода; магнитных шариков закреплены и концентрированной с помощью магнитов размещены именно под трафаретной печати электрода. После двух минут инкубации между магнитными бусами и субстратом для AP, ферментативные продукция выявлена методом дифференциальной импульсной вольтамперометрии (DPV) с помощью портативного прибора (PalmSens) также может инициировать автоматическое восемь измерений с интервалом в несколько секунд.
протокол
1) Блокировка покрытием магнитных шариков:
Выполните следующие блокировать покрытием Магнитные гранулы:
- Подготовить комплект из 2 мл пробирок Эппендорф;
- Однородный (встряхивания, но не вортексе) покрытием магнитных шариков (см. приложение для подготовки покрытием магнитных шариков), используя образец вращающийся смеситель;
- Сразу же после гомогенизации, пипетка 10 мкл покрытием магнитных гранул в каждой отдельной трубы Эппендорф;
- Добавить 1 мл обезжиренного молока блокирующий раствор в каждую пробирку Эппендорф множества;
- Давайте магнитных шариков инкубировать 30 минут при комнатной температуре на вращающемся образце смеситель;
- Удалите блокирующий раствор: для этого места трубки в магнитное концентратор частицы с магнитным часть положить на 2 мин (см. магнитных шариков прилипания на боковой стенке трубы); тщательно пипетки от супернатант, оставляя нетронутой бисером;
- Добавить 1 мл PBS буфера + NaN 3 + BSA, как решение для хранения данных для каждой трубки;
- Магазин покрытием и заблокировали магнитных гранул при температуре 4 ° С (обратите внимание, что покрытие магнитных шариков стабильны в течение не менее 2 месяцев при температуре 4 ° С);
2) Иммунологические цепи на магнитных шариков для построения калибровочной кривой и анализа проб
Выполните следующие иметь магнитных шариков готово для измерения:
- Возьмите одну трубку Эппендорф (2 мл) с покрытием и заблокировал решение для каждого образца экстракт вы собираетесь анализировать;
- Возьмите дополнительную трубку Eppendorf для каждой рабочей calibrant решения;
- Однородный магнитных гранул в течение 2 мин на вращающемся образце смесителя перед использованием;
- Удалить хранения жидкости с использованием магнитных частиц концентратора;
- Вымойте магнитных гранул в три раза с PBS / BSA моющего раствора. Удалить моющей жидкости;
- Конкурс шаг: Добавить для каждого пробирку мыть магнитных бус, 200 мкл образца экстракт готов; использовать один магнитный шарик трубки для каждого образца. Повторите эту процедуру для каждого стандартного раствора. Добавить 200 мкл моноклональных антител к решению каждой магнитной бусины трубки. Давайте магнитных шариков инкубировать в течение получаса на вращающемся образце смесителя при комнатной температуре;
- Удалить из труб Эппендорф раствор, используемый для конкуренции шаг;
- Маркировка шаг: Добавить 400μl меченых вторичных антител к каждой магнитной трубке шарик Эппендорф. Давайте магнитных шариков инкубировать в течение получаса на вращающемся образце смесителя при комнатной температуре;
- Удалить маркировки решение из труб Эппендорф;
- Вымойте магнитных гранул в три раза с PBS / Tween ® 20 промывочного раствора. Удалить жидкость;
- Ресуспендируют с 100 мкл буфера DEA каждую аликвоту магнитных бус. Теперь магнитных шариков готовы к шагу измерения электрохимических;
3) Ассамблеи PalmSens с мультиплексора (Mux) варианты
Внимание: продукт ферментативного гидролиза субстрата фолов поверхности электрода, по этой причине новый электрод, необходимые для каждого измерения.
- Подключить ноутбук к компьютеру PalmSens через последовательный кабель;
- Подключите 9-DIN вилка CH8 мультиплексор с PalmSens.
- Подключите последовательный кабель восьми каналов мультиплексора электрический контакт с CH8 мультиплексор;
- Место электрода полосы на восемь блоков магнита. Обратите внимание на место каждого магнита под каждого рабочего электрода (Следует отметить, что нуждается в одном магнитом для каждого электрода необходимо, в противном случае магнитные частицы не будут сосредоточены на рабочий электрод области);
- Подключите электроды полосы на восемь каналов мультиплексора электрического контакта;
Для измерения DPV использовать следующие параметры в соответствующих полях:
E начать: 0 (V), E конца: 0,6 (V), E шаг: 0,016 (V), E импульса: 0,0339 (V), E кондиционирования: 0 (V), E осаждения: 0 (V); Скорость сканирования : 0,1 (В / с); Т импульса: 0,06 (ы), T кондиционирования: 0 (с); Т осаждения: 0 (с); Т равновесия: 8 (ов).
4) ферментативной реакции и электрохимических измерений
- Однородный, осторожно встряхивая каждую пробирку Эппендорф, содержащих магнитные бусины готовы к шагу измерения электрохимических, чтобы получить хорошо рассеяны приостановлении магнитных шариков;
- Внесите друг от Эппендорф, сразу же после гомогенизации, аликвоту 20 мкл магнитной бусины дисперсии на соответствующие рабочие поверхности электрода. Для каждого из электродов одной полосы использовать 20 мкл магнитных шариков, взятых из разных труб Эппендорф (например, в течение восьми электрода используется восемь различных Эппендорф);
- Добавить 80 мкл раствора субстрата ферментативной на первый электрод. Начало 2 мин отсчет. Через 14 сек, добавить 80 мкл раствора субстрата ферментативной на втором электроде. После еще 14 сек, добавить 80 мкл раствора субстрата ферментативной на третий электрод. Выполните то же самое время Interval (14 секунд) до последнего электрода (что означает: снижение каждую аликвоту субстрата с интервалом в 14 сек). Интервал времени от 14 сек рассчитывается как время, необходимое для выполнения потенциостате измерения; отметить, 80 мкл раствора на каждый датчик должен охватывать работы, ведения и счетчик электрода. Более того, решения для каждого датчика не должны вступать в контакт с растворами соседних электродов.
- После 2 мин отсчет от первого добавлением ферментативного раствора субстрата, то производятся измерения электрохимических;
- Используйте PalmSens Lite программное обеспечение для получения текущих максимумов (мкА) для каждого решения.
5) Расчет
Создание калибровочной кривой использованием логистических 4 параметра уравнения и вычислить концентрацию общего HT-2/T-2 токсин сумму в нанограмм на миллилитр для каждой пробирки Эппендорф содержащие неизвестного образца.
Экспериментальным данным, высота пика (мкА) против концентрации calibrants (нг / мл), должны быть установлены использованием нелинейных четыре параметра логистической (4-PL) уравнения сюжет (1) (Sigma использованием Участок 8.0 или Kaleidagraph). Нелинейных 4-PL модель обычно применяется для описания связывание лигандов анализы (LBA) 6.
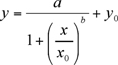 (1)
(1)
а, б, х0, у0 являются логистические параметры, как вид кривой Sigma программа поместиться участка.
Используйте эксплицируется формулу для расчета содержания HT-2/T-2 суммы общего токсина в разбавленный раствор экстракта образца  (2)
(2)
х массовой концентрации общего количества HT-2/T-2 токсинов в разбавленный раствор экстракта, рассчитанные по логистическому уравнению 4 параметра в нанограмм на milliltre (нг / мл)
у является текущее значение в мкА, полученные для неизвестного образца
Приложение
6) покрытием магнитных шариков
Выполните следующие иметь покрытием Магнитные гранулы:
Стиральная процедуры
- Однородный tosylactivated Dynabeads ® M-280 (исходный раствор, 2 х 109 бусин / мл) при встряхивании и вортексе (максимальная скорость) в течение 1 мин (во избежание вспенивания) (обратите внимание, концентрация магнитных гранул должна быть всегда одинакова для обеспечения воспроизводимости измерения);
- Сразу же пипеткой 1 мл выше усредненных бисером в 2 трубки мл Eppendorf;
- Поместите пробирку в магнитных концентратор частицы с магнитным часть положить на 2 мин (см. магнитных шариков прилипания на боковой стенке трубы);
- Тщательно пипетки от супернатант, оставляя нетронутой бисером;
- Снимите трубку Eppendorf от магнитного концентратора частиц и ресуспендируйте бисером в 1 мл 0,1 М боратном буфере рН 9,5. Осторожно смешивать в течение 2 мин во вращающемся образце смесителя в течение 2 мин;
- Внесите от супернатант;
- Внесите 1 мл буферного раствора бората в пробирку Эппендорф. Магнитные гранулы теперь готовы для нанесения покрытий шаг;
Покрытие процедуры
- Добавить 600 мл НТ-2 сопряженных с KLH (Keyhole Лаймпет гемоцианин) маточного раствора к 1 мл магнитных шариков) (окончательный HT-2-KLH концентрации 375 мг / мл); инкубировать магнитных шариков и НТ-2-KLH решение для 20ч при 37 ° C * с медленным вращением наклона на вращающемся образце смеситель;
- После инкубации место трубки в магнитное концентратора частиц и пипетки с супернатант;
Мыть покрытие бусин в два раза с 1 мл PBS / BSA буферного раствора. Между каждого мытья удалить PBS / BSA решение. Все промывки проводили настройку магнитных бус и PBS / BSA на вращающемся смесителе в течение 5 мин; - Вымойте магнитных шариков один раз с использованием 1 мл Трис / BSA буферного раствора. Удалить ТРИС / BSA решение. Провести этот шаг, установив магнитных бус и ТРИС / BSA буфера на вращающемся смесителе в течение 4 часов при температуре 37 ° C *;
- Вымойте магнитных шариков один раз, используя 1мл обновляется (хранить в холодильнике при температуре 4 ° С) PBS / BSA буферного раствора. Удалить PBS / BSA решение. Провести этот шаг настройки магнитных бус и PBS / BSA буфера на вращающихся смеситель для 5 мин при комнатной температуре;
- После мытья шаг удалить все моющую жидкость и добавьте 1 мл PBS буфера + NaN 3 + BSA в качестве жидкого хранения;
- Магазин покрытием магнитных гранул при температуре 4 ° С (обратите внимание, что покрытие магнитных шариков стабильны в течение не менее 2 месяцев при температуре 4 ° С);
* Для этой цели миксер помещается в печь оснащена отверстие, которое позволяет вставлять кабель питания. Кроме микшера могут быть размещены в термостатируемой комнате при температуре 37 ° C.
7) подготовка проб и извлечения
25 г мелко образца грунта (детское питание или сухие завтраки), мыighed в банку блендер и экстрагируют 100 мл ацетонитрила / водный раствор (86/14) в течение 3 мин в высокоскоростной смеситель. После центрифугирования при 4000 оборотов в минуту (3000 г) в течение 5 мин, 8 мл надосадочной были приняты, и очищенная с колонкой Mycosep, 4 мл экстракта очищены сушат в токе азота. Высушенные образцы могут храниться при температуре от -30 ° C до нескольких месяцев.
8) Пример восстановления
Хлопья для завтрака
Развести сухой экстракт зерновых завтраков (зерновых пищевых продуктов на основе, предназначенные для потребления среди взрослых) с 40 мл PBS, рН 7,4. В этом случае образца с концентрацией токсина равно должны предельно допустимый уровень (200 нг / г) даст при измерении шаг сигнал падения в середине рабочего диапазона.
Детское питание
Развести сухой экстракт детского питания (зерновые пищевых продуктов на основе предназначенных для детского потребления) с 4 мл PBS. В этом случае образца с концентрацией токсинов равно должны предельно допустимый уровень (20-25 нг / г) даст при измерении шаг сигнал падения в середине рабочего диапазона.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Использование антител, как биомолекулярных зонд признании видел широкое применение для зондирования; иммунохимических методик обнаружения, таких как ИФА и MEIAs, являются, в настоящее время, среди наиболее часто используемых и прикладных платформ во многих лабораториях 7.
Access restricted. Please log in or start a trial to view this content.
Благодарности
Авторы хотели бы поблагодарить Нэнси Даунер и все члены из лаборатории аналитической химии, Римский университет "Tor Vergata" за сотрудничество и тылового обеспечения. Эта работа была поддержана ЕС проекта "BioCop".
Access restricted. Please log in or start a trial to view this content.
Материалы
Реагенты
| Название реагента | Компания | Номер в каталоге | Комментарии (необязательно) |
| Хлористый калий | Сигма | P9333 | |
| Калия дигидрофосфат | Сигма | P9791 | |
| Динатрия гидрофосфат | Сигма | S3264 | |
| Хлористый натрий | Сигма | S3014 | |
| MgCl 2 безводный | Сигма | M8266 | |
| DEA (99,5%) | Сигма | 31589 | |
| HCl 37% | Сигма | 320331 | |
| H 3 BO 3 | Сигма | B6768 | |
| Трис [гидроксиметил]-аминометан | Сигма | 252859 | |
| BSA (бычий сывороточный альбумин) | Сигма | A4503 | |
| NaOH | Сигма | S5881 | |
| ТВИН 20 | Сигма | P9416 | |
| NaN 3 | Aldrich | 71290 | |
| 1-нафтил фосфата динатриевая соль | Fluka | N7255 | |
| Обезжиренное молоко блокирующий раствор - не сухое обезжиренное молоко | Bio-Rad | 170-6404 | |
| НТ-2 сопряженных с KLH (Keyhole Лаймпет гемоцианин), маточного раствора (1 мг / мл в PBS): | Biopure | 004050 | HT-2-KLH сопряженных была получена CDI-метод, где свободный ОН-групп на позиции 3 и 4 на НТ-2 токсин, были активированы N, N-карбонилдиимидазола (CDI) и активированный НТ-2 токсин давайте вступать в реакцию с aminogroups белка (KLH) для создания стабильной связи carbammate. |
| Вторичные меченых антител: анти-IgG мыши (H + L) от лошади, сопряженных с щелочной фосфатазы, концентрации 1 мг / мл. | Vector Laboratories | AP-2000 | |
| НТ-2 токсин | Biopure | ||
| Магнитные гранулы: Dynabeads ® | Dynal | М-280 Tosylactivated | Концентрация 2 х 10 9 бусин / мл. |
Решения
| Название реагента | Подготовка | Комментарии (необязательно) |
| Фосфатным буферным раствором (PBS), рН 7,4 | Растворить 0,20 г хлористого калия, 0,20 г калия дигидрофосфат, 1,16 г гидрофосфата динатрия и 8,00 г хлорида натрия в 900 мл воды | |
| Диэтаноламин буфера, DEA, 0,97 М + 1 мМ MgCl 2 + 0,15 М KCl, рН 9,8 | Растворите 0.0476g из безводного MgCl 2 и 7.3.59 г KCl в ~ 300 мл воды. После растворения добавить 51 мл DEA (99,5%). Отрегулируйте рН до 9,8 с HCl (6 М). Развести на 500 мл воды. | |
| Борат буфера, 0,1 М, рН 9,5 | Растворить 3,09 г H 3 BO 3 в ~ 300 мл дистиллированной воды, регулировать рН до 9,5 с NaOH и / или HCl (6 м или более низкие концентрации). Развести на 500 мл дистиллированной водой. | |
| ТРИС буфер, 0,2 М, рН 8,5 | Растворить 3,85 г трис [гидроксиметил]-аминометан в 100 мл воды. Отрегулируйте до рН 8,5 с помощью NaOH и / или HCl (6 м или более низкие концентрации). Развести на 200 мл воды. | |
| ТРИС буфер + BSA раствора (0,1%), рН 8,4 | Растворите 0,050 г BSA в 50 мл Трис буфера рН 8,4. | Это решение должно быть свежеприготовленной на день использования. |
| PBS буфера + ТВИН ® 0,05% | Растворите 0,250 г ТВИН 20 в 500 мл заранее подготовленные PBS буфера, рН 7,4 | |
| PBS буфера + BSA Решение 0,1% | Растворите 0,050 г BSA в 50 мл PBS буфера, рН 7,3. | Это решение должно быть свежеприготовленной на день использования. |
| PBS буфера + BSA 0,1% + NaN 3 0.02% | Растворите 0,050 г BSA и 0,010 NaN 3 в 50 мл PBS буфера, рН 7,3. | Хранение зольution |
| Ферментативный подложки | Растворите 0,010 г 1-нафтил соли фосфата натрия в 100 мл ДЭА буфер рН 9,8. Оберните колбу плотно в алюминиевую фольгу. | Это решение должно быть свежеприготовленной на день использования. |
| Обезжиренное молоко блокирующий раствор | Добавить 0,20 г промокательной класса Blocker обезжиренное сухое молоко (Bio-Rad, Геркулес, Калифорния, США) до 200 мл PBS буфера рН 7,3. | Это решение должно быть свежеприготовленной на день использования. |
| НТ-2 маточного раствора | Растворите 10 мг трихотеценовые НТ-2 токсин флакон в 10 мл ацетонитрила, чтобы дать раствор с концентрацией 1 мг / мл. | Сплит до этого решения в одноразовые порции по 30 мл и хранят их на менее -30 ° С. |
| НТ-2 Рабочий стандартный раствор | Внесите 20 мл НТ-2 токсин маточного раствора в 2 мл калиброванного мерную колбу и разбавляют ацетонитрилом для получения НТ-2 рабочего раствора, содержащего 10 мкг / мл трихотеценовые токсина. | Это решение должно быть свежеприготовленной на день использования. |
| НТ-2 Рабочие растворы calibrant | Развести HT-2-х рабочих стандартный раствор (10 мкг / мл), чтобы подготовить рабочие calibrant решение 100 нг / мл. Развести HT-2-х рабочих calibrant решение 100 нг / мл подготовить рабочие calibrant решения следующих концентрациях 0 (пустой), 0,5, 1, 2, 4, 10 нг / мл. | Эти решения должны быть готовы свежие на день использования. |
| НТ-2 сопряженных с KLH | Сплит до НТ-2 сопряженных с KLH (Keyhole Лаймпет гемоцианин) исходного раствора (1 мг / мл в PBS) в одноразовых аликвоты 350 мкл. | Магазин аликвоты при -30 ° C. |
| Конкретные моноклональные антитела | Развести 1:350 (по объему) акции концентрации (1,383 мг / мл) моноклональное антитело в ФБР, чтобы использовать в конкурсе шаг | Это решение должно быть готово свежее в момент использования. 10 мл исходного раствора антител в PBS для конечного объема 3,5 мл, достаточно проанализировать 17 стандартов и / или образцы. |
| Вторичные меченых антител | Анти-мышь IgG (H + L) сопряженные с щелочной фосфатазы разводят 1:100 (по объему) в ФБР, чтобы использовать в конкурсе шаг. | 100 мкл исходного раствора антител в PBS для конечного объема 10 мл, достаточно проанализировать 25 стандартов и / или образцы. Это решение должно быть готово свежее в момент использования. |
Аппарат
| Название реагента | Компания | Комментарии (необязательно) |
| Магнитные частицы Концентратор: MPC ®-S | Dynal | |
| PalmSens инструмент | PalmSens | Поставляется с PalmSens Lite, последовательный кабель, соединяющий ноутбук и Mux программных опций |
| CH8 PalmSens мультиплексор | PalmSens | |
| Восемь каналов мультиплексора электрического контакта | ручной | |
| Газа с восемью трафаретной печатью электродов (SPE) | ручной | |
| Специально разработанные для поддержки полосы электродов | ручной | Включает в себя 8 неодимовыми магнитами, каждый из которых помещен ниже каждой рабочей поверхности электрода из SPE |
| Калиброванные пипетки микролитр | Gilson | |
| Магнитная мешалка и перемешать баров. | ||
| Стеклянные стаканы (100, 50, 20 мл). | ||
| Мерные колбы (2 мл). | ||
| 0,2 и 2 мл Eppendorf труб. | Эппендорф | |
| Сокол ™ труб 5 мл и 15 мл. | Сокол | |
| Лаборатория Микшер Vortex | Не используйте вихревой смеситель для ресуспендирования магнитных шариков покрытых HT2-KLH или связанные с иммунологической цепочке, чтобы избежать денатурации белковых частей | |
| Печь лаборатории или термостатируемой комнате | Выбрать печь в состоянии держать температуре 37 ± 3 ° С. |
Ссылки
- Koch, P. State of the art of trichothecenes analysis. Toxicol. Letters. 153, 109-112 (2004).
- Krska, R., Baumgartner, S., Josephs, R. State of the art in the analysis of type-A and-B trichothecene mycotoxins in cereals. Fresenius J. Anal. Chem. 371, 285-299 (2001).
- Morozova, T. Y., Morozov, V. N. Force differentiation in recognition of cross-reactive antigens by magnetic beads. Anal. Biochem. , 263-271 (2008).
- FAO Food and Nutrition Paper 74. JOINT FAO/WHO EXPERT COMMITTEE ON FOOD ADDITIVES Fifty-sixth meeting. 2001 Feb 6-15, Geneva, , Food & Agricultural Organization of the United Nations. 115 (2001).
- Piermarini, S., Volpe, G., Ricci, F., Micheli, L., Moscone, D., Palleschi, G., Fuhrer, M., Krska, R., Baumgartner, S. Rapid Screening Electrochemical Methods for Aflatoxin B1 and Type-A Trichothecenes: a preliminary study. Anal. Lett. 40, 1333-1346 (2007).
- Findlay, J. W. A., Dillard, R. F. Appropriate calibration curve fitting in ligand binding assays. AAPS J. 9 (2), E260-E267 (2007).
- Ricci, F., Volpe, G., Micheli, l, Palleschi, G. A review on novel developments and applications of immunosensors in food analysis. Anal. Chim. Acta. 605 (2), 111-129 (2007).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены