Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Осмотическое избежании в Caenorhabditis Элеганс: Synaptic функции двух генов, ортологов прав NRXN1 И NLGN1, В качестве кандидатов на аутизм
Резюме
Neurexins и neuroligins являются мембраны нейронов адгезии белков, которые выполняют существенную роль в дифференциации и синаптической передачи. Neuroligin недостаточно мутантов С. Элеганс Являются дефектными в обнаружении осмотической силы, но, когда они также содержат мутацию в ген, кодирующий neurexin, они выздоравливают дикий фенотип типа.
Аннотация
Neurexins и neuroligins являются молекулы адгезии клеток, присутствующих в возбуждающих и тормозных синапсов, а они необходимы для правильного нейронной сети функции 1. Эти белки находятся на пресинаптических и постсинаптических мембран 2. Исследования на мышах показали, что neurexins и neurologins играют существенную роль в синаптической передаче 1. Недавние сообщения показали, что изменило нейронные связи в процессе развития нервной системы человека могло бы стать основой этиологии многочисленные случаи расстройств аутистического спектра 3.
Caenorhabditis Элеганс могут быть использованы как экспериментальный инструмент для облегчения изучения функционирования синаптических компонентов, благодаря своей простоте для лабораторных экспериментов, и учитывая, что его нервная система и синаптической проводка была полностью описана. В C. Элеганс NRX-1 и NLG-1 гены ортологичных для человека NRXN1 и NLGN1 генов, которые кодируют альфа-neurexin-1 и neuroligin-1 белка, соответственно. В организме человека и нематод, организация neurexins и neuroligins похож по отношению к функциональной области.
Глава содержит нематод амфидов, орган чувств нематоды, которая выступает посредником ответы на различные стимулы, в том числе осмотические силы. Амфидов состоит из 12 сенсорных нейронов биполярного с мерцательным дендритов и один аксон пресинаптических терминал 4. Два из этих нейронов, названный ASHR и ASHL особенно важны в осмотического сенсорные функции, выявление растворимых в воде репелленты с высокой осмотической силы 5. Дендритов этих двух нейронов удлинить до кончика рта и аксоны распространяется на нервное кольцо, где они составляют синаптических связей с другими нейронами определения поведенческой реакции 6.
Для оценки последствий neurexin и neuroligin в высокое осмотическое избежании силы, мы покажем другой ответ С. Элеганс мутантов дефектные в NRX-1 и NLG-1 генов, используя метод, основанный на 4М кольцо фруктозы 7. Поведенческих фенотипов были подтверждены с использованием специфических клонов RNAi 8. В С. Элеганс, дсРНК необходимые для запуска RNAi можно вводить путем подачи 9. Доставка дсРНК через пища вызывает помехи RNAi гена интерес тем самым позволяя идентификация генетических компонентов и сетевых путей.
протокол
1: Осмотическое анализа избегания.
- Около 16-24 часов до анализа, выбрать L4 личиночной стадии животных каждого генотипа к свежим пластины NGM содержащие OP50 Е. кишечной andincubate это при 20 ° C. На следующий день начать экспериментировать с молодого возраста.
- Рекомендуется проводить анализ "вслепую". Пластины с каждого штамма, чтобы быть проанализированы должны быть relabelled на второй экспериментатор, выступая методом с использованием relabelled пластин, которые будут разоблачены, когда эксперимент закончился.
- День анализа, подготовки 4М маточного раствора фруктозы с 1% раствором конго красный и полностью растворяются при комнатной температуре. Мы рекомендуем проверять решения до каждого теста с красителем может осадок со временем.
- С кольцевой (1 см в диаметре) на пластине NGM изложена в центре твердой среде, с 15 мкл красный раствор фруктозы 4М. Пусть фруктозы решение впитываться в агар, это обычно занимает от 2 до 5 минут.
- Место отдельных молодых взрослых животных каждого штамма в пределах кольца и следовать в течение следующих 10 минут, чтобы определить ответ на осмотический барьер. Животные избегая кольцо более чем в шесть раз подряд, классифицируются как нормальное, а те, выходя на ринг в менее шести попыток считается дефектным в осмотической чувствительности.
Примечание: контрольного штамма необходимо использовать в каждом анализе. N2 молодых взрослых животных используются в качестве положительного контроля, поскольку они решительно избегать кольцо барьер. Животные, которые были ранее голодали, проходили через Dauer личинок или приходят из плит, которые слишком сухой, не должны использоваться. В начале, контрольные животные должны быть оценены в двух экземплярах, чтобы подтвердить, что анализ пластин и решения являются правильными.
2: Генерация нокдаун червей путем подачи RNAi.
- RNAi плит: NGM пластин RNAi кормления содержит на литр: 17 агар г, 2,5 г пептона, 3,0 г хлористого натрия, 1 мл 5 мг холестерина мл -1; заполнить колбе до 1 л Н 2 О и автоклав. После агар охлаждают до 65 ° С, добавить 25 мл 1 М КПО 4, рН 6,0, 1 мл 1 М CaCl 2, 1 мл 1 М MgSO 4, 0,5 мл карбенициллин (50 мг мл -1) и 1 мл 1М IPTG. Если вы начинаете с подготовленными твердых NGM, растопить твердой среде в микроволновую печь, а затем место жидкость NGM на скамейке, чтобы охладиться, а затем добавить КПО 4, рН 6,0, CaCl 2, MgSO 4, карбенициллин и IPTG как указано ранее.
Добавьте 10 мл NGM в каждую 60 мм чашки Петри. Разрешить охлаждения и инвертировать пластин поддержание их при комнатной температуре в течение ночи перед использованием. Плиты можно хранить в полиэтиленовом пакете при температуре 4 ° С в течение 4-5 дней. - Бактериальные подготовки и индукции: изолят колоний E.coli HT115 (DE3) напряжения, трансформированные L4440 вектор, содержащий фрагмент, соответствующий ген-мишень, на Лурия-Бертани (LB) агаром (17 г агара, 10 г триптон, 5 г дрожжевой экстракт, и 10 г хлористого натрия на литр), содержащий ампициллин (50 мкг / мл) и тетрациклином (15 мкг / мл).
Выберите колонии бактерий и переливая ее LB с 50 мкг / мл ампициллина, и выращивали в течение 6 8 часов при встряхивании при 37 ° С; семян капля этой культуры на подготовленную пластин NGM и сухие пластины тщательно, прежде чем инкубации в течение ночи ( 12 24 ч) при комнатной температуре, чтобы размножения болезнетворных бактерий и начать индукции. Инкубации в темноте, так как тетрациклин светочувствительных и это может повлиять на изменчивость анализов RNAi между пластинами.
Необходимо использовать положительный и отрицательный контроль для экспериментов RNAi кормления. Положительного контроля является E.coli HT115 ячейки трансформированных L4440 вектор, содержащий UNC-22 последовательности генов. Нокдаун UNC-22 ген производит "подергивания фенотип". Отрицательного контроля является E.coli HT115 клетка превращается в пустую L4440 вектор. - Worm обработки и подсчета очков: первый день, место L4 стадии червей пластины NGM засеяно OP50 на NGM пластины без бактерий и инкубировать при 20 ° С в течение 12 часов (натощак).
На следующий день, трансфер молодого постился гермафродитов взрослых на тарелку seedded с бактериями выражения конкретной целевой ген РНК-интерференции. Оставьте 40-48 часов при температуре 20 ° С для получения потомства F1.
Затем поместите несколько F1 червей взрослых на другую пластину посеян с теми же бактериями. После 24-48 часов, выбрать и изолировать от F2 потомства, молодые люди (полностью сформирована выступающими вульвы с несколько яиц) и оценки фенотипов.
Примечание: индукция RNAi в нейроны имеют некоторые ограничения из-за огнеупорные свойства C Элеганс нервной системы РНК-интерференции.. Для преодоления проблем этого неэффективность нейрона рекомендуется использовать СБР-3 штамма, сверхчувствительных фоном к действию RNAi в нейронах 10. В наших экспериментах не разностныхх годов были найдены между Бристоль N2 и СБР-3 штаммов для генов и фенотипа проанализированы.
3: Штаммы используется.
C. Элеганс штаммы, используемые в данной работе представлены в таблице 1. Мутантные штаммы были вне пересекли против N2 дикие - типа не менее четырех раз, чтобы удалить нежелательные случайных мутаций, которые могли бы быть, образующихся при мутагенеза протокола.
. OP50 E палочки штамма suppliied на Caenorhabditis генетический центр, Университет Миннесоты, США E.coli HT115 (DE3) с плазмидой pL4440 проведения NRX-1 (JA: C29A12.5). И NLG-1 (JA: C40C9.5 фрагменты) гена были предоставлены д-р Питер Askjaer, Centro Andaluz дель-де-Biología Desarrollo (Абд), CSIC Университета Пабло Olavide, Севилья, Испания.
4: представитель результаты.
Иллюстративные результаты представлены на рисунках 1 и 2. Десять животных каждого штамма и не менее трех экспериментов реплики были выполнены.
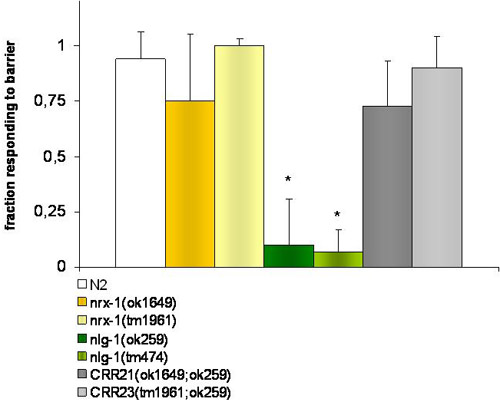
Рисунок 1. Эксперименты осмотического поведения избегания.
Управление штаммов и NRX-1 (ok1649 и tm1961) V недостаточно mutantworms реагировать путем обращения вспять назад, когда они сталкиваются осмотического барьера (4М фруктоза). NLG-1 (ok259 и tm474) X мутанты не способны обнаружить этот барьер. Двойные мутанты дефицит NLG-1 и NRX-1, штаммы CRR21 (ok1649; ok259) и VX CRR23 (tm1961; ok259) VX восстановления дикой фенотип типа. * Указывает на существенные различия (р ≤ 0,001) Т-студент испытания, в ответ каждого штамма к Bristol N2 дикого типа Т-студент тест
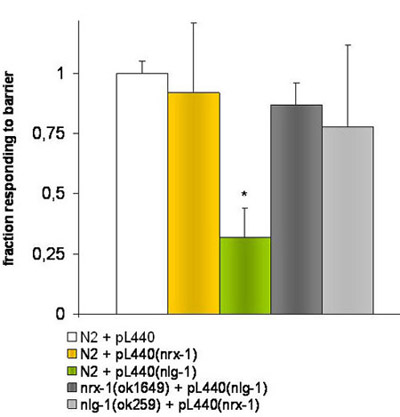
Рисунок 2. Эксперименты с нокдауна червей путем подачи RNAi.
E.coli HT115 (DE3) преобразуется с пустыми pL4440 вектор или содержащих фрагмент, соответствующий генов-мишеней NRX-1 или NLG-1 были использованы для кормили разными штаммами червей. * Указывает на существенные различия (р ≤ 0,001) Т-студент тест, в реакции N2 напряжение подается с бактериями проведения pL4440 вектор с фрагментом ориентации NLG-1 гена по сравнению с N2 напряжение подается с пустыми pL4440 вектор .
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Neurexins и neuroligins выполняют существенную роль в синаптической передачи 11 и дифференциации синаптических связей 12. Обе молекулы были определены в качестве генов-кандидатов для аутизма 13,14.
В этом видео мы покажем простой метод, который позволяет изучать вл?...
Access restricted. Please log in or start a trial to view this content.
Благодарности
Мы хотели бы поблагодарить д-р Антонио Миранда-Vizuete за его ценную помощь. Мы также хотели бы выразить нашу благодарность Сальма Boulayoune и Изабель Кабальеро за ценную техническую помощь. Эта работа была профинансирована за счет гранта от Андалусии (BIO-272). Это исследование было проведено в соответствии с действующим законам генетические эксперименты в Европе.
Access restricted. Please log in or start a trial to view this content.
Материалы
Таблица 1. C. Элеганс штаммов.
| Name | Company | Catalog Number | Comments |
| Напряжение | Ген | Аллель | Источник |
| Бристоль N2 | - | - | aCGC |
| VC228 | NLG-1 | ok259 | CGC |
| FX00474 | NLG-1 | tm474 | bNBP-ЯПОНИИ |
| VC1416 | NRX-1 | ok1649 | CGC |
| FX1961 | NRX-1 | tm1961 | NBP-ЯПОНИИ |
| NL2099 | СБР-3 | pk1436 | CGC |
| CRR21 | NRX-1; NLG-1 | ok1649; ok259 | Эта работа |
| CRR22 | NRX-1; NLG-1 | tm1961; ok259 | Эта работа |
a. Caenorhabditis генетический центр, Университет Миннесоты, США.
b. Национальный проект биоресурсов для подопытных животных "нематод C. Элеганс". Токио женский медицинский университет, Япония.
Ссылки
- Sudhof, T. C. Nature. 455 (7215), 903-903 (2008).
- Fabrichny, I. P., Leone, P., Sulzenbacher, G. Neuron. 56 (6), 979-979 (2007).
- Garber, K. Science. 317 (5835), 190-190 (2007).
- Wang, K., Zhang, H., Ma, D. Nature. 459 (7246), 528-528 (2009).
- Ward, S., Thomson, N., White, J. G. The Journal of comparative neurology. 160 (3), 313-313 (1975).
- Bargmann, C. I., Thomas, J. H., Horvitz, H. R. Cold Spring Harbor symposia on quantitative biology. 55, 529-529 (1990).
- White, J. G., Southgate, E., Thomsom, J. N., Brenner, S. Philos. Trans. R. Soc. Lond. B Biol. Sci. 314, 1-1 (1986).
- Culotti, J. G., Russell, R. L. Genetics. 90 (2), 243-243 (1978).
- Fire, A., Xu, S., Montgomery, M. K. Nature. 391 (6669), 806-806 (1998).
- Timmons, L., Fire, A. Nature. 395 (6705), 854-854 (1998).
- Simmer, F., Tijsterman, M., Parrish, S., Koushika, S. P., Nonet, M. L., Fire, A., Ahringer, J., Plasterk, R. H. Curr Biol. 12, 1317-1317 (2002).
- Missler, M., Zhang, W., Rohlmann, A. Nature. 423 (6943), 939-939 (2003).
- Varoqueaux, F., Aramuni, G., Rawson, R. L. Neuron. 51 (6), 741-741 (2006).
- Graf, E. R., Zhang, X., Jin, S. X., Scheiffele, P., Fan, J., Choih, J. Cell. 119 (7), 1013-1013 (2004).
- Scheiffele, P., Fan, J., Choih, J. Cell. 101 (6), 657-657 (2000).
- Jamain, S., Quach, H., Betancur, C. Nature genetics. 34 (1), 27-27 (2003).
- Szatmari, P., Paterson, A. D., Zwaigenbaum , L. Nature genetics. 39 (3), 319-319 (2007).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены