Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Реверсивные, неинвазивный метод для измерения сопротивления дыхательных путей и бронхоальвеолярного лаважа выборки жидкости у мышей
Резюме
Повторные измерения грызунов физиологии дыхательной и отбора проб дыхательных путей воспалительных клеток желательны, но в целом не представляется возможным. Здесь мы опишем повторяемый метод устной интубирование мышей, которая позволяет повторные измерения гиперреактивность дыхательных путей и отбора проб дыхательных путей воспалительных клеток.
Аннотация
Дыхательные пути гиперреактивность (AHR) измерений и бронхоальвеолярного лаважа (БАЛ) жидкости выборки имеют важное значение для экспериментальных моделей астмы, но повторные процедуры для получения таких измерений в тех же животных, как правило, не представляется возможным. Здесь мы демонстрируем, протоколы для получения от мышей повторные измерения AHR и бронхоальвеолярного лаважа образцы жидкости. Мыши были оспорены интраназально семь раз в течение 14 дней с мощным аллергеном или фиктивных лечение. До начальной задачей, и в течение 24 часов после каждой интраназального вызов, то же животных под наркозом, в устной форме интубации и искусственной вентиляции легких. AHR, оценивается путем сопоставления кривых доза-реакция дыхательного сопротивления системы (РРП), индуцированного увеличения внутривенные дозы ацетилхолина (АХ) хлорида между обман и аллергизованный животных, были определены. После этого и через тот же интубации левого легкого была промывали таким образом, чтобы дифференциальное перечисление клетки дыхательных путей может быть выполнена. Эти исследования показывают, что повторные измерения AHR и БАЛ сбор жидкости можно дальше от тех же животных, и что максимальная гиперреактивности дыхательных путей и дыхательных путей, эозинофилия будут достигнуты в течение 7-10 дней после начала аллерген вызов. Этот новый метод позволяет значительно сократить число мышей, необходимых для продольной экспериментов и применим к разнообразным видам грызунов, болезней дыхательных путей, моделей и физиологии инструментов.
протокол
Аллерген вызов:
- C57BL / 6 мышей, 4-8 недель, анестезируют в герметичной камере плексигласа продувают 3,2% изофлуран в кислородной смеси паров в течение 10 минут, чтобы достичь глубокого общего наркоза.
- Интраназально проблемы аллерген (45μL OVA (22,5 мкг) и 7μL А. огугае (7 мкг), в PBS) находятся в ведении, каждый вторник, четверг и воскресенье, в общей сложности семь последовательных приложений.
Анестезия:
- До начала каждого аллергена вызов, и следующий вызов седьмой, мыши находятся в ведении внутрибрюшинного введения 48 мг / кг etomidate (2 мг / мл), до помещения в светло-исключая сосуд.
- Тема остается в сосуде, пока отсутствие наблюдаемых неврологических ответ обнаружена при приложении давления на задние лапы (5-10 мин).
Интубация:
- Лучистого тепла лампы, поддерживается на достаточном расстоянии, чтобы обеспечить поддержание ~ 37 ° C температура ядра тела, должны быть сосредоточены на теме на протяжении всей процедуры, чтобы предотвратить переохлаждение. Ректального термометра следует использовать по крайней мере первоначально, чтобы подтвердить euthermia независимо от источника тепла используется.
Критические шаги Все жидкости и инструменты полученных экспериментальных животных должны быть стерильными, процедуры должны проводиться под строгим асептических условиях. Длительное переохлаждение в то время как под наркозом приведет к аномальным данных и / или гибель животных. Компетенция со всеми инвазивные процедуры должны быть разработаны с использованием трупного животных, прежде чем пытаться работать на живых животных. Офтальмология смазка должна быть использована для предотвращения роговицы ссадины животных под общим наркозом. - Наркозом мышей удаляются из сосуда и помещен в лежачем положении (вентральной стороной вверх), на плетизмографа таблице, с поправкой на угол 45 °.
- Резиновая лента окружающие таблицу вставляется за верхний ряд резцов так безопасный предмет на место. С помощью пинцета в правой руке, хватка, расширить и поднять язык от устья до обеспечения его на месте с металлом депрессорные в левой руке, что позволяет беспрепятственно дыхательные пути для интубации.
- 0,8 мм в диаметре волоконно-оптического потока, подключенного к источнику света, вводится через angiocatheter и расширенной на 10 мм за наконечник. Как депрессорные является стабилизировался с левой стороны, освещенные конце волоконно-оптических поток направляется через полости рта и глотки за правую руку до голосовых связок визуализируются. Поток затем перешла под прямой визуализации посредством перемещения голосовых связок и в трахею, приуроченная к произойти, когда шнуры максимально открытым.
- Angiocatheter затем передается по волоконно-оптических потоков в трахею до кончика катетера находится в средней части трахеи. Для 17-22 грамм мышей, что соответствует 10 мм катетер сегменте остальные видимые между разъемом и черепно крайних нижней челюсти с предметом. Фактическая сумма, на которую передается катетера должно определяться непосредственного осмотра трахеи 2-3 катетеризации мышей соответствующего размера и генетический фон.
- Волоконно-оптических нить удаляется и успешной интубации подтверждают наблюдения регулярных глубоких вдохов (ритмическая экскурсии грудной клетки и брюшной полости), который немедленно прекратить следующие окклюзии разъем с большой палец. Удушья ответ, независимо от большого пальца окклюзии, нерегулярное дыхание, или другие признаки затрудненного дыхания свидетельствуют о angiocatheter malpositioning и обычно указывают пищевода интубации.
Критический сбой ШАГ быстро обратном пищевода интубации может быть смертельным. Если интубация пищевода подозревается, катетер должен быть быстро доставать и заново когда-то животное возобновил нормальную структуру дыхания. Etomidate является анестетик выбора, как, всех имеющихся анестетиков грызунов, этот препарат вызывает мере сердечно-сосудистой токсичности (гипотензия, аритмия, остановка сердца). - Нижняя плетизмографа стола, пока параллельно с верстака и превратить предмет 180 ° до сталкивается воздуха вентилятором порт. Включите животное на бок перед подключением к искусственной вентиляции легких.
- Успешной интубации было еще раз подтверждено, когда, после обеспечения герметичные соединения и активации вентилятора (функционирует при 150 вдохов / мин, 9 мл / г дыхательный объем, 100% кислорода), торакоабдоминальной экскурсия Видно, в ногу с вентилятором.
Внутривенно строки:
- 10 мм, 27ga игла удаляется из шприца-разъем путем плавления его свободным, и изгиб иглы 90 ° в середине использованием стерильных щипцов и кровоостанавливающего так, чтобы скос лица в угол. Не-скошенным концом подключен к PE10 трубы, ведущие к порту внутривенного введения.
- Чтобы предотвратить потенциальнофатальным эмболизация воздуха, трубки и игла удаляются с 37 ° С, 0,9% NaCl с помощью 1 мл шприца. Инъекция порт состоит из 27ga иглы, протолкнул отверстием в крышке 15 мл центрифужную пробирку. Шапка заполняется физиологическим раствором так, чтобы конец иглы постоянно под водой, тем самым уменьшая вероятность того, что воздух будет вовлеченного в иглу и вводят внутривенно.
- С помощью мышки, оставшихся под тепло лампы, иглы выравнивается по хвостового крайность хвост параллельно и по боковой вены. Игла работать немного под кожей, в то время направлены краниально по длине вены с и толкнул подкожно изгиб. Успешное размещение IV подтверждают наблюдения обратного потока крови в IV трубки с небольшим затягиванием поршень шприца. Кроме того, не должно быть беспрепятственно проходить через внутривенный при инжекции 50-100 мкл солевого в хвостовую вену. Иногда вены хвоста не может быть стабильно канюлю. В этих случаях, мышь можно вращать на 180 градусов в другую сторону, а другой хвост IV обычно доступны без труда.
- После удаления тепла от лампы установки, предмет заключен в плетизмографа впоследствии закреплены в герметичных с применением 4 зажимами.
Важным шагом Разрешение тепла лампы, чтобы остаться на нагреет воздух в плетизмографа камеры и, возможно, изменит последующие измерения R RS стерильности иглы IV и решения должны быть сохранены. Стерилизация игл осуществляется путем погружения и промывки с 70% этанола с последующей промывкой и промывание стерильным физиологическим раствором до IV вставки. Кроме того, хвост должен быть очищен с 70% этанол или изопропиловый спирт до установки IV.
Измерения сопротивления дыхательных путей:
- Пик сопротивления определяется непрерывного количественного фактора DPT / V (где ДПТ является изменение давления и трахеи V является потоком воздуха) в точках равного объема легких (70% дыхательного объема). ЦСТ определяется с помощью датчика давления подключенный к трахеи angiocatheter. Для определения V, вариации плетизмографа давления калибруются к изменениям в объеме свыше физиологических диапазонов изучены. Дифференциального плетизмографа объем с течением времени, вычисленные по предусилитель модуль, В. После установления стабильного базового R RS (<5% изменение в течение 3 минут), пяти последовательных доз (объем = 2 мкл / г веса тела) повышения концентрации ацетилхолина хлорид (0,058, 0,18, 0,59, 1,58 и 5,8 мг / кг массы тела, в 0,9% физиологического раствора при рН 7,4, поддерживается на льду и ручной нагревается до каждой инъекцией) вводят в течение одной секунды через IV, с каждой последующей дозы по возвращении R RS с исходным уровнем, до утроение базовой сопротивления (примерно 12 см H 2 O х мл -1 х сек, т. е. 200%-ное увеличение сопротивление дыхательных путей выше типичных базовых около 4 см H 2 O х мл -1 х сек) достигается. Провокационные концентрации Ах, в мг / г веса тела, что вызывает 200%-ное увеличение R RS по сравнению с исходными значениями (называется PC 200), вычисляется с помощью математической интерполяции АЧ-R RS кривых доза-реакция.
- Как только PC 200 значения были достигнуты, отпустите крепеж, и демонтировать плетизмографа. Максимум 5 возрастающих доз Ах дается. Диапазон Ах концентрация приведенного выше подходит для достижения PC 200 значений для самых наивных линий мышей.
Важным шагом При базовой примерно 4 см H 2 O х мл -1 х сек устанавливается на сопротивление монитора в течение 30 секунд, 60 мкл физиологического раствора может быть введен IV подтвердить, что соответствующие плоскости анестезии была достигнута. При полной анестезии, не будет никаких существенных изменений в сопротивление; увеличение сопротивления или движения конечностей или хвоста представляет признак физического страдания и указывает на необходимость дополнительного наркоза. - Удалить IV из хвостовой вены, а затем отсоединить животное от вентилятора, поддержания дыхательных путей, сохраняя трахеи канюли на месте. Иногда животные не в состоянии возобновить спонтанного дыхания немедленно. В этих случаях дыхание может способствовать мягко массируя грудную клетку.
Важным шагом Спонтанное дыхание должно быть установлено до передачи для восстановления камеры, в противном случае летальных исходов. - После возобновления самостоятельного дыхания, мышей передаются с трахеи канюли на месте, чтобы камера продувается 100% O 2 и поддержание при температуре 37 ° С с использованием тепла лампы. В течение 15-20 мин, мышей дыхание сильно и начинает перемещать свои конечности, и в этот момент трахеи катетер может быть удален и животных сafely переданы их регулярных клеток.
Важным шагом дыхательных путей легко препятствия в бессознательном мыши из-за вызванного ацетилхолином гипер-слюноотделение и является основной причиной удушья смерти, связанной под наркозом мышей после дыхательных путей физиологических измерений. По этой причине, трахеи канюли должны оставаться на месте, даже у мышей, не проходит бронхоальвеолярного лаважа, пока они не arousable и не должны быть удалены, пока гипер-salivaton прекратилась.
Бронхоальвеолярного лаважа:
- Сборник бронхоальвеолярного лаважа жидкости в безопасности, когда мышам достаточно восстановить их рвотный рефлекс (~ 20 мин после размещения в восстановлении камеры). Рвотный рефлекс оценивается нежно скользящий angiocatheter внутрь и наружу; очевидным кашля или пытаются показать, что рвотный рефлекс вернулся.
Важным шагом Разрешение слишком длительное время восстановления будет в значительной степени снижает эффективность БАЛ возвращения из отдельных мышей, таким образом, рвотный рефлекс необходимо контролировать каждые несколько минут, после предложил 20 мин период отдыха. Если мышь не в состоянии терпеть промывание процедуры из-за частичного пробуждения, 3,2% изофлуран анестезии пара может быть использована. - Металлической проволоки руководство интубации (0,5 мм OD), с непрерывным изгибом ~ 30 °, направленных на левой доли легкого, вставляется в angiocatheter. Проводника и angiocatheter выдвигаются вместе в левой доли легкого, так, что катетер (хаб исключены) выходит за пределы передних зубов лишь 1 мм.
Критический сбой ШАГ для изоляции левого легкого значительно уменьшит доходность, в то время как повышение вероятности гибели животных. Необходимо соблюдать осторожность, чтобы кончик проводника не проходит через открытый конец angiocatheter. Продвижение angiocathether с металлическим наконечником выступающий может привести трахеи рваные раны и смерть из-за разрыва трахеи. - Хранение angiocatheter на месте, проводник удаляется и 300 мкл PBS (рН 7,4, стерильный) окажется в левом легком по 1 мл шприца. Сразу же после этого, при оформлении поршень шприца для создания отрицательного давления, angiocatheter медленно (3 с) в то время как сильно удалены массажа легких. БАЛ возвращение 100-200 мкл не ожидается.
- Сразу возвращаться промывали мышей 37 ° C, 100% O 2 камеры, непрерывно массаж грудной клетки. Место мыши на левой стороне, пока полностью выздоровел (~ 20 мин). Животные помещаются обратно в их клетках.
СРОКИ:
На мышь, вся процедура должна занимать не более 1 часа, чтобы выполнить: Шаг 3-4, 5-10 мин; шаги 5-21, 10 мин, Шаг 22, 20-30 мин; шаги 23-24,... 10 мин. С ростом квалификации и ошеломляющим предметов в протоколе, до 3-х мышей / час может быть обработано.
Представитель Результаты:
Дыхательные пути гиперреактивность у мышей, как это определено меры PC 200 значений, является следствием активации и вербовки в легкие Т-клеток и секреции цитокинов IL-135-7. Таким образом, дыхательных путей, гиперреактивность не неизбежным следствием дыхательных путей проблема с аллергеном, а, скорее, зависит от того, нетронутым Т-клеток иммунной отсека и время, необходимое для Т-клеточные реакции развиваться в условиях повторных аллергена экспозиции. Как показано на рис. 2а, дыхательных путей гиперреактивности, определяемый как PC 200 значений, которые значительно ниже по сравнению с исходными значениями, разработанная после 5 аллергена проблемы без дальнейшего значительного увеличения после шестой вызов. По причинам, которые полностью не поняты, реактивность дыхательных путей уменьшилась (PC 200 значений увеличилась) после первой задачей аллерген (рис. 2а). Аналогичные тенденции очевидны, сравнивая Ах кривые доза-эффект для тех же мышей (рис. 2б). Тем не менее, совершенно очевидно, здесь, что полная гиперреактивность дыхательных путей развивается внезапно после Пятая задача аллерген, например, что мыши стали более чем в 30 раз более чувствительной к Ach между четвертым и шестым проблем. Вместе взятые, эти результаты показывают, что наиболее надежные измерения AHR получены после шести аллергена проблемы (12 дней); измерения на более ранних timepoints, скорее всего, выход сильно варьируется данных. Мыши неоднократно сталкиваются с проблемой транспортного средства интраназально (физиологический раствор) не развивается гиперреактивность дыхательных путей, а также на всех доз Ах дано, R RS измерений существенно не меняются по сравнению с исходными значениями (рис. 3, а данные не приведены).
До появления надежной AHR, доминирующим типом клеток дыхательных путей индуцированной аллергенами была нейтрофилов (рис. 4). Как и в тенденции к AHR, однако, эозинофилия постепенно закрепляется при повторном вызов аллергена и эозинофилов стало численно доминирующим типом клеток в БАЛ афтер шестой вызов, совпадающие с заметным снижением числа neutrophis (рис. 4). Макрофаги первоначально увеличились в числе с Первые проблемы аллергена и колебалась в изобилии в дальнейшем. Лимфоцитов изобилие не претерпели значительных изменений, независимо от количества аллергена проблемы и, как ни парадоксально, учитывая их первостепенное значение модели, как правило, наименее многочисленные ячейки в жидкости БАЛ.
Измерение сопротивления дыхательных путей у мышей, получавших ни проблемой, ни аллергена БАЛ выборки не менялась в течение 17 дней эксперимента. Повторный отбор проб жидкости БАЛ при отсутствии дыхательных путей измерения физиологии или аллерген проблемой также были проведены и показали, только расширение нейтрофилов и макрофагов вербовки в дыхательных путях, которые не длятся более 5 дней (данные не приведены). Эти результаты показывают, что видные нейтрофилия наблюдается в аллергена оспаривается мышей в значительной степени результатом процедуры, а не антиген.
В контрольных, PBS стоящей перед мышами, измерения сопротивления дыхательных путей также не существенно различаться с течением времени. Расширенные макрофагов и нейтрофилов, но не эозинофилов, набор для БАЛ был также видели в этих мышей, похожие на те изменения, наблюдаемые у мышей, получавших только повторил БАЛ отбор проб жидкости (рис. 4 б, г). Вместе взятые, эти данные подчеркивают важность аллергена, а не различные манипуляции дыхательных путей, к индукции как аллергический (эозинофильный) воспаление дыхательных путей и AHR.
Подобные результаты можно ожидать использованием интраназального аллергенов аналогичный протеиназы, что мы использовали здесь. Однако многие исследователи используют яичный альбумин, чтобы вызвать аллергические заболевания легких. После соответствующего периода внутрикожные или внутрибрюшинного грунтовки (1-2 недели) с овальбумина осаждается в соли алюминия, надежные фенотипа астмы, в том числе дыхательных путей гиперреактивности, можно ожидать в течение 24 часов после однократного интраназального проблема с растворимыми яичного альбумина.
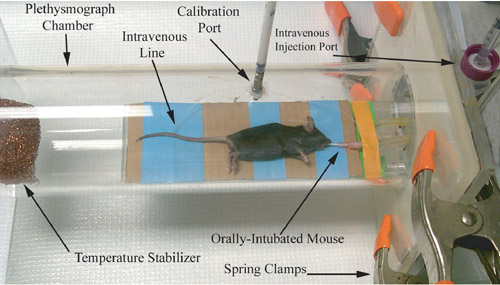
Рисунок 1. Фотографические представление грызунов плетизмографа, непосредственно перед записью дыхательных путей измерения физиологии.

Рисунок 2. Измерения сопротивления дыхательных путей. А) для статистических целей, антилогарифм PC 200 значения сообщается. Обратите внимание на значительное увеличение ПК антилогарифм 200 после первого вызова и последующим снижением после дальнейших проблем. B) Дыхательная система сопротивления (РРП): Обратите внимание, крутизна АЧ-РРП кривых доза-реакция после шестой и седьмой задачи. Планки погрешностей представляют SEM.
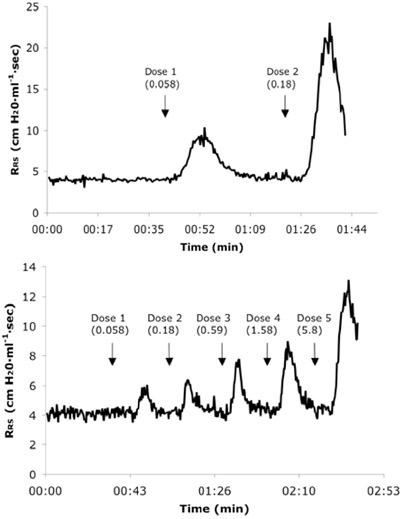
Рисунок 3. Представитель в режиме реального времени дыхательной системы сопротивления (R RS) обводка из наивных (А) и 6X аллергена оспаривается мыши (Б) получение последовательных доз IV Аха. Доза значения приведены в мг / кг единиц.

Рисунок 4. Дифференциальный иммунной подсчитывает ячейки в бронхоальвеолярного лаважа образцы происходит от левого легких мышей, получавших 7 последовательных интраназального проблем. Процент (%) изобилие иммунных клеток у мышей, получавших аллерген () или PBS (В). Общее количество иммунных клеток от мышей, получавших аллергена (С) или PBS (D). Значения представлены как среднее + / - сем.
Обсуждение
Исследование астмы и различных других обструктивных заболеваниях дыхательных путей, является активным и расширение области биомедицинских исследований. Важным компонентом, связанных с астмой экспериментальные исследования возможности оценивать изменения в дыхательных путях разм?...
Благодарности
Мы благодарим д-ра В. Минтзер на предложение выполнить волоконно-оптических orotracheal интубации. Поддержана грантами U19AI070973, R01AI057696, K02HL75243 и R01HL082487 из Национального института здоровья.
Материалы
Дыхательные пути физиологии измерения программного обеспечения (Rescomp) была специально подготовлена (Millennium Премьер группы; 415-519-4371).
Данные были проанализированы с помощью компьютера рабочей станции под управлением Windows XP оснащена процессором Pentium III (Intel, Inc Санта-Клара, Калифорния) и 17-контактный аналоговый сигнал в цифровой преобразователь (National Instruments, # PC-LPM16).
Маленькое животное дыхательных путей физиологии станции была специально собранном (Millennium Премьер Group) с использованием коммерчески доступных датчиков давления (часть # TRD5700 и TRD4510), предусилитель модули (часть # MAX2270), шасси (часть # MAX1320, все из Buxco, Inc Уилмингтон, Северная Каролина ) и индивидуальные небольшие плетизмографа животного.
0,5 мм наружным диаметром волоконно-оптического потока, подключенного к источнику света (Cole Palmer Просветителя, 41722 серии)
Вентилятор (Harvard Аппарат Мышь Вентилятор, # 687)
10 мм, 27ga иглы (BD Biosciences, кот. Нет. 309602)
Тепло лампы
1 мл шприца (BD Biosciences, кот. Нет. 305109)
4 зажимами (Pony 3200 пружинный зажим)
0,5 мм, внешний провод для интубации руководство
Hemacytometer
SuperFrost / плюс слайды микроскопом (Fisher кота. Нет. 12-550-15)
Shandon фильтра карты (Thermo кота. Нет. 5991022)
Слайд Дифференциальная ячейки пятно (Fisher кошки. Нет. 122911)
Светового микроскопа (Leica)
Цитоспина 3 (Shandon)
20 га, 1,25 дюйма ProtectIV внутривенных катетеров (Смит Medical)
0,5 мм полимерных оптических волокон (Эдмунд оптики # NT02-532).
Ссылки
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Adler, A., Cieslewicz, G., Irvin, C. G. Unrestrained plethysmography is an unreliable measure of airway responsiveness in BALB/c and C57BL/6 mice. J. Appl. Physiol. 97, 286-292 (2004).
- Bates, J. The use and misuse of penh in animal models of lung disease. Am. J. Respir. Cell Mol. Biol. 31, 373-374 (2004).
- Lundblad, L. K., Irvin, C. G., Adler, A., Bates, J. H. A reevaluation of the validity of unrestrained plethysmography in mice. J. Appl. Physiol. 93, 1198-1207 (2002).
- Grunig, G. Requirement for IL-13 independently of IL-4 in experimental asthma. Science. 282, 2261-2263 (1998).
- Corry, D. B. Requirements for allergen-induced airway hyperreactivity in T and B cell-deficient mice. Mol. Med. 4, 344-355 (1998).
- Corry, D. B. Interleukin 4, but not interleukin 5 or eosinophils, is required in a murine model of acute airway hyperreactivity. J. Exp. Med. 183, 109-117 (1996).
- Amdur, M. O., Mead, J. Mechanics of respiration in unanesthetized guinea pigs. Am J Physiol. 192, 364-368 (1958).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены