Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Разбор и культуры спаечный Нейроны из эмбриональных спинного мозга
* Эти авторы внесли равный вклад
Резюме
Это видео демонстрирует метод препарировать и культуры спаечный нейроны от E13 крысы спинной спинного мозга. Расхождение между спаечный нейроны полезно изучать клеточные и молекулярные механизмы роста аксонов и руководство.
Аннотация
Спаечный нейроны были широко использованы для исследования механизмов, лежащих аксон руководством во время эмбрионального развития спинного мозга. Клеточных тел этих нейронов расположены в спинном спинного мозга и их аксоны следуют стереотипные траектории во время эмбрионального развития. Спаечный аксонов первоначально проект вентрально по отношению к floorplate. После пересечения средней линии, эти аксоны свою очередь, спереди и проекта по отношению к мозгу. Каждый из этих шагов регулируется действием нескольких сигналов руководства. Культуры высоко обогащенного спаечный нейронов идеально подходят для многих экспериментов решении механизмы поиска пути аксонов, включая превращение анализов, иммунохимии и биохимии. Здесь мы опишем метод препарировать и культуры спаечный нейроны от E13 крысы спинной спинного мозга. Во-первых, спинного мозга выделяют и спинной полосы из расчлененных. Спинные ткани затем распадается на клеточной суспензии по трипсинизации и механические разрушения. Нейроны высевали на поли-L-лизин-покровные стекла с покрытием или ткани-культуры блюд. После 30 часов
протокол
1. Препарирование эмбриональных крыс спинной спинного мозга
Общие рекомендации
Держите L-15 среды на льду и часто меняют среду в рассечение блюдо держать эмбрионов прохладно. Это позволяет продлить целостности тканей. Все действия выполняются с двумя парами Дюмон # 5 щипцов, если не указано. Во избежание загрязнения, спрей все инструменты и рабочие поверхности с 70% этанола и держать бутылку рассечение среду закрыты. Для переноса эмбрионов между блюдами, используйте пипетку сократить пластика или перфорированной ложкой. Очень важно, чтобы не повредить спинной мозг (уменьшение поперечного сечения, вытяжка), чтобы успешно завершить рассечение.
Подготовка
- Холодная L-15 средний
- 50 мл L-15 + 10% тепла инактивированной лошадиной сыворотки (HiHS). Держите на льду.
Спинной рассечение шнур
- Эвтаназии E13 беременности поставленное крысы (E0 = первый день после спаривания день) с CO 2 камеры в соответствии с ведомственным руководящим принципам.
- Спрей 70% этанола на животе. Pinch и подтянуть кожу нижней части живота, области с пинцетом и вырезать с хирургическими ножницами. Повторите, чтобы прорваться через мышц и перитонеальные слоев, чтобы достичь брюшной полости. Создать V-образный разрез, сокращая ткани по бокам живота, вплоть до грудной клетки. Поднимите и отступить ткани подвергать брюшной полости.
- Матке прикрепляется в трех местах: в низкий центр живота, и на обоих верхних боковых углах. Поднимите матки, захватывая на ткани между эмбриональными мешки. Вырезать соединительной ткани, чтобы удалить матку и поместить в чашку Петри заполнены L-15 на льду.
- Следующие шаги делаются под микроскопом рассечение. Для разделения эмбриона от экстраэмбриональных тканей и зародышевых оболочек, захватить ткань между матки мешков с одной парой щипцов. С другой пары, щепотка более прозрачной стороне мешка, чтобы прорваться через поверхностные мембраны (темная сторона плаценты). Выдавить эмбриона, слегка нажав стороны плаценты мешка. Удалите все эмбрионы и место в чашке Петри заполнены L-15 на льду.
- Место одного эмбриона в 10 см чашку Петри заполнены ледяной L-15. Использование microscissors, отрезать головы и задней части под углом показано на рисунке 1а.
Резка на эти углы помогут положение эмбриона при размещении "вентральной лицом вниз". - Позиция эмбриона "вентральной лицом вниз" (передний направлена в сторону, по направлению к задней экспериментатор) (рис. 1б).
- Крепко держите эмбриона с одной стороны, с помощью щипцов, чтобы "придавить" эмбрионов (рис. 1в). Не перемещайте щипцы, как он будет рвать ткань. С другой паре щипцов, шелушиться кожа, покрывающая спине эмбриона, начиная с области между "холдинга" щипцы (рис. 1, г-е). Это выставит спинного мозга, которые в данный момент, заключен в оболочку мембран (оболочек).
Захватите кожу от сторон, а не сверху, спинной мозг, чтобы избежать уменьшение поперечного сечения спинного мозга. - Частично отделить тканей правой стороны спинного мозга (рис. 1е). Начиная с уровня холдинга щипцы, совать ткани с закрытыми щипцами, как можно ближе к спинному мозгу. Затем, медленно откройте щипцы рвать ткань. Это должно отделять спинной ганглий корня (ДРГ) от спинного мозга, а также должны нарушать вентральных органов. Оставьте немного ткани прилагается в переднем и заднем концах. Оставляя ткани прилагается добавляет веса эмбриона, тем самым предотвращая его тянут вверх во время следующего шага. Кроме того, что ткань используется для хранения на эмбрион в последующих действиях.
- Начиная от переднего конца, используйте крючковидной вольфрамовой иглой, чтобы сократить мозговые оболочки и открытого спинного мозга вместе roofplate (рис. 1 г).
- Поворот на 180 градусов эмбриона (задняя направлена в сторону, по направлению к передней экспериментатор) (рис. 1 час).
Это позволяет экспериментатору использовать той же рукой отделить ткани от другой стороне эмбриона. - Держите эмбриона, захватывая на ранее отдельные стороны, и нарушить ткань оставшуюся сторону, используя тот же метод (см. 1.8.). Когда закончите, полностью отделить ткань с обеих сторон спинного мозга.
Альтернатива: полностью отделить ткани, оставшиеся на левой стороне, но оставить некоторые ткани прилагается в переднем и заднем конце с правой стороны. Иногда это может помочь сохранить спинного мозга в положении в шаге 1.12. - Место спинного мозга на свою сторону и удалить большую часть оставшихся мезенхимальных тканей и ДРГ (рис. 1и).
- На данном этапе, мозговых оболочек и спинного мозга два "листов" ткани соединенный друг на друга. Pin вниз больше, передне-самые часть спинного мозга, и снимите с коротким сегментом мозговых оболочек от спинного корD (рис. 1j, слева). Теперь, удерживая две отдельные сегменты, захватывая по щипцами, и снимите с мозговых оболочек с гладкими, постоянного движения (рис. 1к).
Неравномерное "пилинг" приведет к поломке спинного мозга и / или мозговых оболочек слоя. Это, как правило, не возможно восстановить часть спинного мозга еще привязаны к мозговых оболочек. - Использование пластиковой пипетки, передача изолированных спинного мозга к чашке Петри содержащие L-15 + 10% HiHS и выйти на лед. Как правило, спинной мозг всех эмбрионов собираются до вскрытия спинной части.
Спинной спинного рассечение шнур
- Разместите один спинного мозга в чашке Петри содержащие L-15 +10% HiHS, лежа в "открытой книги" конфигурации. Срежьте шире, передняя часть (которая включает в себя часть заднего мозга) (рис. 1 КБ).
- Спинные ткани находится в боковой большей части спинного мозга (рис. 1 л, слева). Хотя закрепления шнура с прямой иглой вольфрама, используйте Г-образный вольфрамовой иглы вырезать полосу, которая 1/5th ширина половины спинного мозга. (Рис. 1 л, справа). Место спинной полосы в 15 мл пластиковые трубки, содержащей L-15 + 10% HiHS на льду.
Спинной нейронных трубных секций в ~ 12 E13 эмбрионов даст ~ 3.5-4 миллионов клеток для гальванических после диссоциации. Более клетки могут быть получены путем выполнения грубого вскрытия спинной спинного мозга (резка более широкий спинной полоски), но спаечные чистоты нейрон будет сокращено.
2. Спаечный нейрона культуры
Общие рекомендации
Все шаги должны выполняться в стерильных условиях в капот культуре ткани, если не указано иное. Использование свежей среды и свежей талой добавок и реагентов. Диссоциации и растиранием шаги выполняются в Са 2 + / Mg 2 +-свободный HBSS, чтобы минимизировать Са 2 + / Mg 2 +-зависимой адгезии.
Подготовка
- покрытием покровные (использование немецкого стекла Desag) или пластин культуры ткани (см. покрытие процедуру ниже).
- теплый Neurobasal СМИ Покрытие (см. ниже), в культуре ткани блюд и CO 2 уравновешенную культуре ткани инкубаторе в течение по крайней мере 1,5 ч до обшивки.
- 2,5% трипсина в 37 ° С водяной бане
- 2 бутылки HBSS Са 2 + / Mg 2 +-свободные, по одному на 4 ° С, по одному на 37 ° C.
- два пожарных-полированное стекло пипетки Пастера один с диаметром половину обычного размера, и один с диаметром чуть меньше половины. Используйте стерилизованные Пастера пипеток. Для пожарных польский пипетки, используйте горелку (верхней части голубого пламени), чтобы расплавить кончик немного уменьшить диаметр. Потому что этот шаг выполняется за пределами капот культуры ткани, спрей пипетки с 70% этанола до размещения под капотом культуры ткани. Для более эффективного восстановления нейронов, пальто Пастера пипетки и средах, содержащих сыворотки перед началом диссоциации или непосредственно перед растиранием шаг (заполнить пипетки со средствами массовой информации и хранить в течение 30 секунд). Это позволит предотвратить клетки от прилипания к внутри пипетки Пастера во время растирания.
- стерильной воды для мытья MilliQ PLL покрытием блюда или покровные
- 12,5% MgSO 4 раствор в HBSS
Поли-L-лизин покрытием
При использовании стекла покровные, кислотно-мыть в течение 24 часов и стерилизовать перед покрытием (см. Kaech и Banker, 2006). Использование немецкого покровные стекла Desag.
Для пальто поли-L-лизина на стекле покровные или пластиковой посуды культуры тканей:
- под капотом культуры ткани, покрытие поверхности с небольшим куполом 100 мкг / мл PLL решение для 1.75-2 часов.
- мыть дважды MilliQ воды, по крайней мере 5 минут на мытье (может быть выполнена на этапе клеточной диссоциации ниже).
- хранить в воде до момента использования. Не позволяйте PLL поверхности, покрытой сухой.
Для уменьшения потерь PLL для покрытия покровные, место покровных в стерильных бактериальных чашках Петри. Пальто и мыть покровные, поставив купол жидкости на покровные стекла. Бактериальных чашках Петри являются гидрофобными, поэтому жидкость должна оставаться на стекла покровные. Передача покровные к блюдам культуре ткани непосредственно перед покрытием клеток.
Для нейронов высевали на пластиковые блюда культуры ткани, адгезии, как правило, выше, таким образом, удлинение аксонов может быть уменьшена.
Диссоциация и покрытия
- Убедитесь, что спинной полосы расположились в нижней части трубы. Удалите большинство из L-15 +10% HiHS с пипетки Пастера. Быстро мыть спинной нервный полосы трубки раз, добавляя 3 мл холодного (4 ° С) HBSS.
- Пусть спинной нервный полосы трубки решить в течение 2 минут, затем снимите с HBSS пипетки Пастера.
- Добавить теплой (37 ° C) HBSS до объема 4,7 мл. ТКурица добавить 0,3 мл 2,5% трипсина, чтобы дать конечной концентрации 0,15% трипсина.
- Инкубировать при 37 ° С в водяной бане в течение 7 мин. Смешайте один раз мягко полпути через инкубации.
- Добавить 30 мкл ДНКазы (25 000 ЕД / мл) для конечной концентрации 150 ед / мл. Добавить 60 мкл MgSO 4 и смешать кратко, для конечной концентрации 0,15%.
Для ткани из грубого вскрытия, инкубировать еще 1 минуту при 37 ° С на водяной бане.
На данном этапе, спинной нервный трубных секций должны быть фрагментированы. Если спинной нервный трубных секций не начали фрагмент, это обычно означает, что на 2,5% трипсина запас старых, и новых акций должна быть талой или промыть холодной HBSS не эффективно удалить HiHS от образца. - Центрифуга фрагментов тканей на 200 г в течение 4 мин.
- Удалить супернатант с пипетки Пастера, оставив ~ 50-100 мкл жидкости в нижней части трубы.
- Флик трубку осторожно, чтобы ослабить гранул, затем промыть клетки, добавив 5 мл теплой HBSS. Давайте решать при комнатной температуре в течение 2 мин.
- Центрифуга со скоростью 200 г в течение 5 мин.
- Удалить супернатант с пипетки Пастера, оставив ~ 50-100 мкл жидкости в нижней части трубы.
- Флик трубку осторожно, чтобы ослабить гранулах и частично ресуспендирования клеток. Затем добавляют 2 мл теплой HBSS.
- Используйте небольшие (половина диаметра) пожарные полированное стекло пипетки Пастера отделить клетки медленно пипетирования вверх-вниз 4-6 раз. Избегайте пузырей, и пипетку жидкости к стенке трубы. Не слишком растирают.
- Используйте наименьшее пожарной полированное стекло пипетки Пастера дальнейшее диссоциируют клеток медленно пипетирования вверх-вниз 3-4 раза. Избегайте пузырей, и пипетку жидкости к стенке трубы. Не слишком растирают.
Для ткани из грубого вскрытия, добавить еще 1 мл теплой HBSS к трубе в конце диссоциации.
При диссоциации клеток, не надо отделить все ячейки сгустков и агрегатов. Стоп пипетирования вверх-вниз или изменения в пипетку Пастера с меньшим диаметром, если вы не видите дальнейшее уменьшение размеров клеточных агрегатов с последующим пипетки. - Давайте все оставшиеся фрагменты ткани поселиться в трубке в течение 1 мин. Не стоит перенести клетки в новую пробирку.
- Возьмите 20 мкл клеточной суспензии и добавить 5 мкл трипанового синий. Граф клеток на гемоцитометра.
Нейроны должна быть ≥ 95% жизнеспособным методом исключения трипанового синий. - Пластина нейронов в Neurobasal СМИ Покрытие (см. рецепты ниже).
- Предлагаемые покрытия плотности для получения изолированных нейронов (низкой плотности культур, чтобы избежать слипания нейронов или перекрывающих друг друга):
- 120 000 - 180 000 клеток / лунку для 6-луночный планшет
- 60 000 - 75 000 клеток / лунку для 12-луночного планшета
- 16-18 часов спустя, изменение средств массовой информации для СМИ Neurobasal роста (см. рецепты ниже)
Не используйте вакуумный насос для аспирации СМИ от культуры блюдо при изменении информации; осторожно использовать пипетки. Это позволяет избежать смещение нейронов.
Представитель Результаты:
Через четыре часа после покрытия, нейроны должны придерживаться поли-L-лизин (PLL)-покрытием. В рамках этапа освещения напротив, придерживался органы ячейки, как правило, относительно плоской и овальной формы (рис. 2а). Клетки, которые не хорошо укрепленные появляются в виде сферы, которые перемещаются немного, когда блюдо очень осторожно постучал в сторону. Многие факторы могут потенциально препятствовать адгезии клеток (см. обсуждение).
После 30 часов в пробирке, большинство нейронов расширили аксонов с видимым конуса роста (рис. 2, в, г). Если плохой рост аксонов наблюдается, убедитесь, что Neurobasal СМИ Рост был достигнут свежей средой и дополнениями. Нейроны оставались здоровыми, по крайней мере, 6 дней в этих условиях. Эта процедура оказалась надежно выход подготовки высоко обогащенного спаечный нейронов, с ~ 90% нейронов выражения ДКК (Ям и соавт. 2009). Ширина полосы спинной спинного мозга, что используется для приготовления суспензии клеток повлияет на чистоту культуры, с большей чистотой, когда тонкие полосы используются. Пример приложения показано на рисунке 3 (иммунофлюоресценции). См. статью Ям и соавт. (2009) для большего количества примеров.
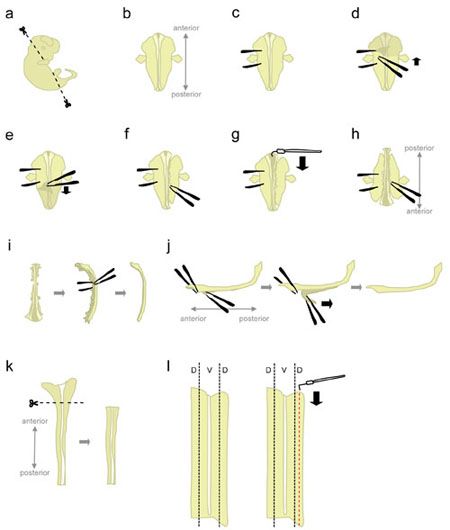
Рисунок 1. Схемы спинного шаги рассечение мозга. D = Спинной, V = Брюшной. Нажмите здесь, чтобы видеть большую фигуру.
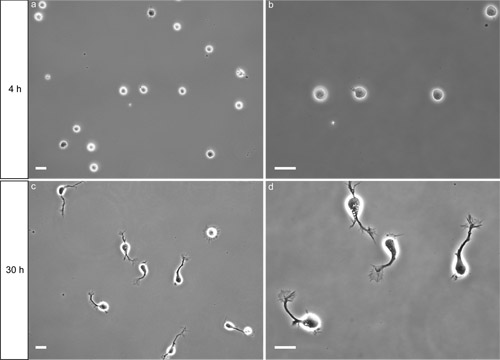
Рисунок 2. Представителю результате изолированных спаечныйнейронов высевают на PLL-покровного стекла с покрытием. , б) через 4 часа после покрытия, нейроны присоединившимся к поверхности. Bar = 20 мкм. в, г) через 30 часов после покрытия, большинство нейронов расширили аксонов с видимым конуса роста. Bar = 20 мкм.
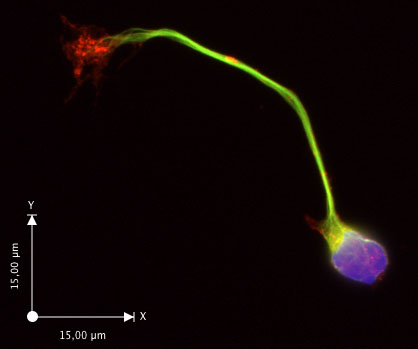
Рисунок 3. Спаечный нейрона immunostained для гамма-тубулина (зеленый), с F-актина, помеченных фаллоидином (F-актин, красный) и ядра DAPI (синий).
Рецепты и комментарии
Neurobasal СМИ Покрытие
- Neurobasal
- 10% тепла инактивированной FBS (HiFBS)
- 2 мМ L-глутамина (от 200 мМ маточного раствора)
Дополнительно: Пенициллин / стрептомицин антибиотики (использовать половину нормальной концентрации)
Neurobasal Медиа роста
- Neurobasal
- B27 (1 / 50 разбавления со склада)
- 2 мМ L-глутамина (от 200 мМ маточного раствора)
- Дополнительно: Пенициллин / стрептомицин антибиотики (использовать половину нормальной концентрации)
Как только средства массовой информации производится, его можно хранить при температуре 4 ° С в течение двух недель. Чтобы уравновесить температуру и рН среды до покрытия клетки, место СМИ в культуре ткани чашках Петри и место в культуре ткани инкубаторе по меньшей мере 1,5 часа.
Neurobasal
После бутылки Neurobasal среду была открыта, она может храниться в течение одного месяца при температуре 4 ° С в темноте. Утилизировать Neurobasal, который был открыт в течение более одного месяца, в противном случае выживаемость клеток будет ниже.
Тепло-инактивированной эмбриональной телячьей сыворотки (HiFBS) или лошадиной сыворотки (HiHS)
Для тепловой инактивации FBS или ГС, тепла при 56 ° С на водяной бане в течение 30 минут. Swirl бутылку примерно каждые 10 минут или около того. (Для точности использовать бутылку такого же размера, заполненный водой. Поместите термометр в бутылку с водой, чтобы увидеть, когда 56 ° C будет достигнута. Начните времени в этой точке.) Тепло-инактивированная ФБС, возможно, должны быть центрифугируют, чтобы очистить осадок, и может быть аликвоты и повторно замораживают при температуре -20 ° С.
L-глютамин
Всегда свежие оттепели аликвоту L-глютамин для каждого эксперимента.
B27
Аликвоты B27 можно хранить при температуре 20 ° С для длительного хранения, или при температуре 4 ° С на срок до одного месяца.
Обсуждение
Мы описали метод препарировать и культуры спаечный нейронов из эмбриональных крыс спинного мозга. Эта процедура была широко используется в нашей лаборатории, чтобы надежно подготовить нейронов изучать клеточные и молекулярные механизмы аксон руководства. Для клеточной биологии и им...
Благодарности
Эта работа была поддержана грантами от канадского института исследований в области здравоохранения (CIHR), Питер Лоуид Медицинский исследовательский фонд, Программа Макгилла в Neuroengineering, Fonds по исследованиям ан Santé Квебека (FRSQ) и Канаде фонд инноваций (CFI ). Себастьен Д. Ланглуа был поддержан Обучение премии магистра Fonds де-ла-любителя ан santé Квебека (FRSQ) и Фредерик Бантинг и Чарльз премию Лучший Канаде Высшее стипендии магистра канадских институтов здравоохранения (CIHR). Мы благодарны Джессика MT Фам за помощью цифр.
Материалы
Препарирование эмбриональных крыс спинной спинного мозга (см. также таблицу)
- E13 беременности поставленное крысы
- Этанол 70%
- Хирургические ножницы, Изысканные инструменты науки
- Пинцет, Дюмон # 5, Изысканные инструменты науки
- Чашки Петри
- L-15 средний
- Препарирование микроскоп, Leica
- Пластиковые пипетки передачи
- Microscissors, Изысканные инструменты науки
- Вольфрам иглы и контактный держателей (один крючковидной иглы, один L-формы иглы, один прямой иглой), Изысканные инструменты науки
- Тепло-инактивированной лошадиной сыворотки (HiHS)
- 15 мл пластиковых труб
Спаечный нейрона культуры (см. также таблицу)
- Культуры ткани инкубаторов (37 ° C, 5% СО 2, контролируемой влажностью)
- Немецкий стекла Desag покровные и / или пластиковой посуды культуры ткани
- Поли-L-лизин, Sigma
- Стерильные MilliQ H 2 O
- Neurobasal, Invitrogen
- Тепло-инактивированной эмбриональной телячьей сыворотки (HiFBS)
- L-глютамин
- B27, Invitrogen
- Пенициллин / стрептомицин антибиотиков
- 37 ° С водяной бане
- Стерильные Пастера Пипетки
- Газовая горелка Бунзена
- HBSS, Ca 2 + / Mg 2 +-свободной, Invitrogen
- ДНКазы, Уортингтон
- MgSO 4
- Центрифуга
- Hemacytometer
- Голубой Трипан решения
Ссылки
- Charron, F., Stein, E., Jeong, J., McMahon, A. P., Tessier-Lavigne, M. The morphogen sonic hedgehog is an axonal chemoattractant that collaborates with netrin-1 in midline axon guidance. Cell. , 113-1111 (2003).
- Fabre, P., Shimogori, T., Charron, F. Segregation of ipsilateral retinal ganglion cell axons at the optic chiasm requires the Shh Receptor Boc. Journal of Neuroscience. 30, 266-275 (2010).
- Helms, A. W., Johnson, J. E. Progenitors of dorsal commissural interneurons are defined by MATH1 expression. Development. 125, 919-928 (1998).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocols. 1, 2406-2415 (2006).
- Okada, A., Charron, F., Morin, S., Shin, D. S., Wong, K., Fabre, P. J., Tessier-Lavigne, M., McConnell, S. K. Boc is a receptor for sonic hedgehog in the guidance of commissural axons. Nature. 444, 369-373 (2006).
- Yam, P. T., Langlois, S. D., Morin, S., Charron, F. Sonic hedgehog guides axons through a noncanonical, Src-family-kinase-dependent signaling pathway. Neuron. 62, 349-362 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены