Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оценка Двумерные Кристаллизация Испытания малых мембранных белков для структурных исследований биологии электронным кристаллографии
* Эти авторы внесли равный вклад
Резюме
Оценка двумерных (2D) испытания кристаллизации для формирования упорядоченных массивов мембранный белок является очень важные и трудные задачи в электронной кристаллографии. Здесь мы описываем наш подход в скрининге и идентификации 2D-кристаллы преимущественно небольшие мембранные белки в диапазоне 15 - 90kDa.
Аннотация
Электронная кристаллография развивалась как метод, который может быть использован либо альтернативно или в сочетании с трехмерной кристаллизации и рентгеновской кристаллографии для изучения структурно-функциональных вопросов мембранных белков, а также растворимые белки. Скрининг для двумерных (2D) кристаллов методом просвечивающей электронной микроскопии (ЭМ) является важным шагом в поиске, оптимизации и отбора проб для высокого разрешения сбора данных крио-ЭМ. Здесь мы опишем основные шаги по выявлению как крупные, так и приказал, а также небольшой 2D массивы, которые потенциально могут поставлять критически важную информацию для оптимизации условий кристаллизации.
Работая с различными увеличениями на EM, данные по целому ряду критических параметров получается. Нижняя увеличении поставок ценные данные о морфологии и размера мембраны. При более высоких увеличениях, возможно кристалла порядка и 2D размеры определяются. В этом контексте он описал, как ПЗС-камеры и интернет-преобразования Фурье используются при более высоких увеличениях оценить proteoliposomes к порядку и размеру.
Хотя 2D-кристаллы мембранных белков чаще всего выросли на восстановление диализом, скрининг технику в равной степени применима для кристаллов производится с помощью монослоя, родной 2D-кристаллы, и упорядоченных массивов растворимых белков. Кроме того, методы, описанные здесь, применимы к скрининга для 2D-кристаллы из еще более мелких, а также крупные белки мембраны, где меньше белков требуется такое же количество помощи в идентификации, как наши примеры и решетки больше белков может быть более легко идентифицировать на более ранних стадиях отбора.
протокол
1. Сетка Подготовка 2D Испытания Кристаллизация
- Углерод покрытием 400-сетка меди Е. М. сетки готовят отрицательное пятно. Уранилацетата часто используется и обеспечивает длительный пятно с точки зрения хранения раствора в течение нескольких месяцев перед использованием, а также пригодность для длительного хранения сеток. В отличие от других негативных пятен, таких как уранил формиат, обеспечивая при этом отличную окрашивания, должны быть свежеприготовленной 1. Для быстрого приготовления большого количества сеток, которые будут использоваться для скрининга 2D испытаний кристаллизации, модифицированной версией отрицательные окрашивания используется. Объемом 2 мкл образца пипеткой на углерод покрытые сеткой EM и инкубировали в течение 60 с Это сопровождается промокательной от края с разорванным кусок ватмана # 4 фильтровальной бумаги (рис. 1, видео), а затем 2 мкл 1% уранилацетата в силу немедленно, которые опять уничтожены от края сетки после 30 s. Прикосновение к сетке на обод с оторванной края фильтровальной бумаги обеспечивает оптимальное удаление жидкости без снятия proteoliposomes. Кроме того, сушка на краю сетки обеспечивает улучшение сохранения углеродной пленки. Необходимо соблюдать осторожность в подготовке и обработке сетки, как поломка тонкий углеродной пленки предотвращает прилипание образца и может привести к неточным представлением образца. Хотя традиционно большие объемы проб из 5 мкл были и которые обычно используются для подготовки сетки, драгоценные образцы могут быть сохранены за счет уменьшения объема до 2 мкл или менее 2.
- Для получения максимально возможного мембран, некоторые из наших образцов требуют высокой концентрации глицерина или сахарозы (10-20%), присутствуют в диализе буфера. Это может оказать негативное влияние на сетке подготовки, как глицерин или сахароза вязкие и предотвращает уранилацетата от правильно проникающей буфер, и тем самым полностью окрашивании мембран. Следовательно возможно решетка будет скрыта. Либо буфер может быть обменена путем центрифугирования образцов и замены глицерина / сахарозы без буфера (не показаны), или сетки можно мыть с буфером или глицерина / сахарозы без буфера в одного до нескольких циклов до отрицательного окрашивания аналогична техника, используемая для крио-ЭМ 3,4.
2. Оценка 2D Испытания Кристаллизация Е. М.
- В зависимости от типа держателя образца, либо одним или несколькими сетками загружены. Увеличение 2-10К, которые будут переданы здесь в качестве промежуточного увеличения, позволяет первое впечатление среднее распределение и степень дисперсии мембран, морфологии и размера, который принял к сведению в ноутбук лаборатории 5. Соответствующие области регистрируются в качестве представителя обзоры с помощью ПЗС-камеры, или, если камера на ПЗС отсутствует, на пленке.
- Низкий увеличение в диапазоне от примерно 400-800x используется в периоды, когда обзор всей выборки / сетка лучшего. Хотя не работает с каждой сетке, малом увеличении дает ценную информацию о помощи в оценке сетки подготовки с точки зрения нескольких аспектах: как отрицательные, так и потенциальных окрашивания частичного разрыва углеродной пленки, образцы концентрации на стартовой решетке, и, возможно неравномерное распределение proteoliposome. Индивидуальные квадраты сетки могут быть просмотрены с помощью бинокля или ПЗС-камера. С некоторыми ЭМ можно сохранить позиции, представляющие особый интерес, которые могут быть вызваны для последующего анализа на более высоком увеличении.
- Как только сетка сферу интересов был определен на низкой или промежуточной увеличение, увеличение изменяется приблизительно 50K-60K. В зависимости от мембраны, хрусталя и размеров элементарной ячейки, если известно, увеличениях столь же низко как 30К и как можно выше 80K используются. Диапазон увеличения на 30-80K будет называться большим увеличением с целью скрининга для 2D-кристаллы. Фокусировка происходит либо в центре установка малых доз установки, с последующим переключатель на изображение / фото установка, или в непосредственной близости от области интереса.
- В случае неоднозначности в ли интересующей области, действительно, мембраны, образец проверяется на углеродной пленки в размере proteoliposomes, слюды или других артефактов. Для этого края выявить типичные складывания и морфологии.
- Сейчас область интересов проверяется с ПЗС-камерой. ПЗС собирается на 30K-80K увеличения, в зависимости от размера мембраны, белки или размер элементарной ячейки, или известные кристаллические области. Решетки меньше и / или в основном гидрофобные мембранных белков не обязательно видимые на визуальную оценку изображения CCD себя. Либо все изображение используется для онлайн-преобразование Фурье (FT, или быстрой FT-FFT). Это FT будет содержать значительное количество шума, однако, если упорядоченный массив мал. Таким образом, снижается коробке размер позволит улучшения отношения сигнал-шум маленькийлер кристалла и облегчения идентификации. Для этой цели поле перемещается по образу и жить FT оценивается.
Интенсивности / яркости пучка регулируется поддержания низких доз условия для образца, а также настройки камеры CCD в виду. В зависимости от ПЗС-камеры используются, гамма жить FT настраивается для оптимальной идентификации упорядоченных массивов. Слишком высокое значение может скрыть пятна из-за шума взносов, а также слишком низкие значения гаммы будет препятствовать слабые пятна от идентифицированы. Эти слабые пятна может быть связано с меньшей кристаллических массивов с мест в FT чуть выше уровня шумов.
Хотя данные с более высоким разрешением были собраны из небольшого числа образцов 6, обычно разрешением негативно окрашенные кристаллы 2D ограничено или не должно быть как ожидается, будет лучше, чем грубо 15а разрешения. С расфокусировать около -400 нм, не более 1-3 заказов пятен, как ожидается, будет легко определить. Образцы, как правило, не оцениваются на резолюции, как крио-ЭМ сбора данных даст надлежащую указанием наивысшего достижимого разрешения. Резкость пятен и возможных мозаичности отмечены все же.
- Различные мембраны, а также мембраны морфологии, оцениваются для заказа при большом увеличении. Это особенно важно в начале или в промежуточных стадиях 2D испытаний кристаллизации, а меньше, чем больше proteoliposomes или мембраны патчи могут содержать наиболее перспективных направлений. Очень низкий процент 2D-кристаллы потребует получения изображения и FT, или оптической дифракции, из большого количества изображений с первоначальной идентификации упорядоченных массивов будут часто приводит к быстрому улучшению размера и качества 2,4,7.
3. Представитель Результаты
В идеале приказал proteoliposomes дисплей, легко узнаваемый, резкие пятна. Крупные и хорошо упорядоченных кристаллов легко идентифицированы онлайн-FT изображений CCD или оптический дифракции микрофотографии.
Пример показывает, 2D-кристаллы небольшой белок оболочки 18kDa, которые до нескольких микрон. Пятна на FT легко идентифицируются и острые. Движение живых FT окно показывает, что решетка непрерывно без мозаичности. Решетка больше белка с более обширным растворимые домен может быть идентифицированы на маленьком экране EM. CCD коллекции изображений и FT необходимо предусмотреть средства лучше оценить и получить информацию о, например, возможные мозаичности (показать FT). При расчете FT из proteoliposome, что не будет вынесено, шум может изначально быть ошибочно приняты за пятна. В то время как коробка для живых FT перемещается, однако, пятна исчезнут. С другой стороны, небольшие массивы, с сомнительным кристалличности, будет иметь свои места остается неподвижным, когда жить-FT перемещается даже чуть больше площади изображения. Кроме того, эти мелкие кристаллы могут быть признаны правило, с теми же размерами элементарной ячейки, и расстояния между пятнами в различных ФСТ может быть измерена различными способами, например, с кругом определенного размера. Липидный кристаллов отображения различных морфологии решетки и FT.
Это не редкость встретить осадков в начальных испытаний. Здесь белка осадков без восстановления необходимо отличать от небольших агрегатов липидного же. Образцы, которые кажутся осадков при малом увеличении часто оказываются липидных агрегатов, если смотреть на более высоком увеличении. После осмотра на 30-50К, края этих темных структур раскрыть, чтобы они состоят из мембраны, без осадков белка. Эти важные наблюдения, липидные агрегаты могут быть увеличены в размерах больших мембран в следующих экспериментах.
Плохие результаты при оценке образцов иногда связано с низкой концентрацией мембрана, которая препятствует правильному и быстрого скрининга. Это часто может быть преодолено с использованием выше концентрация белка для 2D кристаллизации путем диализа. Кроме того, мембраны могут быть оставлены на соглашайтесь на несколько дней на дне пробирки Эппендорф в процессе хранения. В некоторых случаях быстрое, почти мгновенное или урегулирования мембран происходит и пипеткой со дна трубки приведет к более высокой плотности мембраны на сетке. Другим гораздо быстрее опция центрифугирования (при 3000-8000 оборотов в минуту в течение 1-3 минут) образцов с последующей выборки из нижней части трубы.
Образцы при оптимальных условиях будет содержать большой процент 2D-кристаллы. Не стоит стремиться к однородным появление мембраны, как самый большой и стройной 2D-кристаллы выбираются визуально для сбора данных. Эти типы образцов должен быть легко узнаваемым, когда кристаллизация испытания повторяются, а также, когда образцы используются длякрио-ЭМ сбора данных, в результате чего максимальное количество изображений с высоким разрешением.
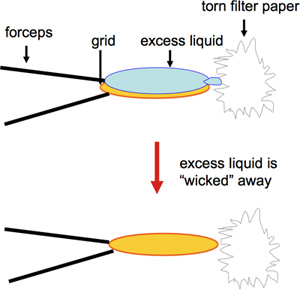
Рисунок 1. На этом рисунке показаны промокательной край сетки с разорванной кусок ватмана # 4 фильтровальную бумагу.
Обсуждение
Правильная оценка образцов требует тщательной оценки достаточное количество мембран. Например, образцы с всего 2% кристаллического массива из более чем 180 отображаемого proteoliposomes дало важную информацию для быстрой оптимизации 2D условий кристаллизации 7.
При осажде...
Благодарности
Мы благодарны нашим сотрудникам за предоставление ценных образцов белков, которые способствовали некоторые наши методы, касающиеся опыта и наблюдений. Гюнтер Schmalzing любезно предоставил возможность FR присоединиться к этому проекту. Барбара Армбрустер, Иаков Бринк и Дерик мельницы поблагодарил за их выдающуюся помощь и вход на оборудование. Финансирование было предоставлено грантов NIH HL090630.
Материалы
| Name | Company | Catalog Number | Comments |
| 400-mesh copper TEM grids coated with carbon film | |||
| forceps: regular and anti-capillary | Dumont #5 and Dumont N5AC or similar | ||
| Micropipette and pipette tips | |||
| Whatman #4 filter paper | |||
| 1% uranyl acetate | |||
| Dialysis sample to be screened for 2D crystals | |||
| Glycerol/sucrose-free dialysis buffer | Optional | ||
| JEOL-1400 transmission electron microscope (TEM) | similar 80 – 120kV TEM equipped with an Lab6 or tungsten filament and film and/or CCD cameras (Gatan Orius SC1000 and/or UltraScan1000 CCD cameras and Gatan Digitial Micrograph software package or Tietz cameras (TVIPS)) |
Ссылки
- Johansen, B. V. Bright field electron microscopy of biological specimens V. A low dose pre-irradiation procedure reducing beam damage. Micron. 7, 145-156 (1976).
- Schmidt-Krey, I. Electron crystallography of membrane proteins: Two-dimensional crystallization and screening by electron microscopy. Methods. 41, 417-426 (2007).
- Wang, D. N., Kühlbrandt, W. High-resolution electron crystallography of light-harvesting chlorophyll a/b-protein complex in three different media. J Mol Biol. 217, 691-699 (1991).
- Schmidt-Krey, I., Rubinstein, J. L. Electron cryomicroscopy of membrane proteins: specimen preparation for two-dimensional crystals and single particles. Micron. , (2010).
- Schmidt-Krey, I., Mutucumarana, V., Haase, W., Stafford, D. W., Kühlbrandt, W. Two-dimensional crystallization of human vitamin K-dependent γ-glutamyl carboxylase. J Struct Biol. 157, 437-442 (2007).
- Trachtenberg, S., DeRosier, D. J., Zemlin, F., Beckmann, E. Non-helical perturbations of the flagellar filament: Salmonella typhimurium SJW117 at 9.6 Å resolution. J Mol Biol. 276, 759-773 (1998).
- Zhao, G., Johnson, M. C., Schnell, J. R., Kanaoka, Y., Irikura, D., Lam, B. K., Austen, K. F., Schmidt-Krey, I. Two-dimensional crystallization conditions of human leukotriene C4 synthase requiring a particularly large combination of specific parameters. J Struct Biol. 169, 450-454 (2010).
- Cheng, A., Leung, A., Fellmann, D., Quispe, J., Suloway, C., Pulokas, J., Abeyrathne, P. D., Lam, J. S., Carragher, B., Potter, C. S. Towards automated screening of two-dimensional crystals. J Struct Biol. 160, 324-331 (2007).
- Vink, M., Derr, K. D., Love, J., Stokes, D. L., Ubarretxena-Belandia, I. A high-throughput strategy to screen 2D crystallization trials of membrane proteins. J Struct Biol. 160, 295-304 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены