Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Фотопревращения Очищенная флуоресцентных белков и двойного зонда Оптические Выделение в живых клетках
В этой статье
Резюме
Этот протокол описывает общий подход для выполнения фотопреобразования флуоресцентных белков по конфокальной лазерной сканирующей микроскопии. Мы описываем процедуры фотопревращения puried образцов белков, а также для двойного зонда оптических подсветка в живых клетках с mOrange2 и Dronpa.
Аннотация
Photoconvertible флуоресцентных белков (рс-ФПС) представляют собой класс флуоресцентных белков с "оптический маркер" возможности, а это означает, что цвет флуоресценции может быть изменен под воздействием света определенной длины волны. Оптическая подсветка позволяет неинвазивным маркировка субпопуляции флуоресцентные молекулы, и поэтому идеально подходит для отслеживания отдельных клеток или органелл.
Критические параметры для эффективного фотопреобразования являются интенсивность и время экспозиции фотопреобразования света. Если интенсивность слишком мала, фотопреобразования будет медленно или не происходит вообще. С другой стороны, слишком много интенсивности или слишком длительном воздействии может photobleach белка и тем самым снизить эффективность фотопреобразования.
Этот протокол описывает общий подход, как настроить конфокальной лазерной сканирующей микроскопии для ПК-FP приложений фотопреобразования. Во-первых, мы описываем процедуру подготовки очищенные образцы белка капли. Этот образец формат очень удобен для изучения фотофизических поведение флуоресцентных белков под микроскопом. Во-вторых, мы будем использовать образец белка капли, чтобы показать, как настроить микроскоп для фотопреобразования. И, наконец, мы покажем, как выполнить оптическую подсветку в живых клетках, в том числе двойного зонда оптических выделение с mOrange2 и Dronpa.
протокол
1. Подготовка люминесцентные образцы капли белка
Флуоресцентного белка капли образец состоит из 1-octanol/water эмульсии с флуоресцентным белком, проживающих в водной фазе. Эта эмульсия зажата между слайд микроскоп и 22 мм квадратных покровного стекла для микроскопии приложений.
- Перед тем, люминесцентные образцы капли белка предметные стекла и покровные стекла должны быть очищены и покрыты гидрофобным агента.
- Чистая посуда промывкой 5 минут с ацетоном и просушить на воздухе. (При желании после чистки посуды можно лечить в течение 30 секунд в плазме очиститель для получения оптимальных результатов покрытием).
- Подготовка 2% метилтриметоксисилана раствора в ацетоне и пальто посуды в течение 2 минут инкубации в этом растворе. После нанесения покрытия удалить посуда из раствора и оставляют сохнуть на воздухе. Затем смойте 70% этанола из пульверизатора и просушить снова. (При желании, на данный момент изделия из стекла можно запекать в течение 1 часа при температуре 80 ° С до ковалентно ссылку покрытие для посуды). Покрытием изделия из стекла могут храниться в течение не менее одного месяца.
- Флуоресцентные белки очищаются как Его 6-меченый белок из E. Coli 1. Измерить абсорбцию спектр очищенного белка и подготовить запас разбавления оптическая плотность ~ 0,1 в STE буфера (150 мМ NaCl, 10 мМ Трис-HCl, рН 8, 1 мМ ЭДТА), содержащего 0,1% бычьего сывороточного альбумина (БСА) . Кроме того подготовить 10 мл смеси 1:1 1-октанола и STE буфера в 15 мл коническую трубку и перемешать энергично. После смешивания отпуск до разделения фаз является полным. Верхней фазе 1-октанол. (Внимание: Так как 1-октанол имеет сильный запах, важно использовать закрытый контейнер отходов за все, что приходит в соприкосновение с 1-октанол.)
- Чтобы сделать эмульсию пипетки 45 мкл 1-октанола и 5 мкл флуоресцентного белка в микроцентрифужную трубки. Нажмите трубку несколько раз пальцем, чтобы приступить к формированию эмульсии, а затем разрушать ультразвуком трубку в течение 30 секунд в ванне ультразвуком. В то же время получить покрытием слайд микроскопа и покровного стекла готовы. После обработки ультразвуком эмульсии должна быть полностью облачность. Сразу же после обработки ультразвуком пипетки 4 мкл эмульсии из середины тюбика на покрытие микроскопический слайд и накрыть стекла с покрытием крышки.
- Если процедура выполнена правильно эмульсии должна распространяться равномерно между слайд микроскоп и предметное стекло. В течение нескольких минут образца должна быть стабильной, состоящий из ~ 10 мкм флуоресцентные капель различного диаметра. Крупнейший капли близки к центру образца и меньше, расположенных дальше к краям.
2. Настройка фотопреобразования эксперимент
Следующая процедура является общей стратегии по созданию флуоресцентных эксперимент фотопреобразования белка. Эта процедура может быть применена для очищенных белков, а также для живых клеток.
- Следующие параметры обеспечивают общую отправную точку для настройки фотопреобразования эксперимент:
40x 1.3NA цель погружения нефти
Размер изображения = 512 х 512 пикселей
Сканирование зума = 4
Pixel время пребывания = 6 мкс.
Z-разрешение (размер отверстия) = 3 мкм - Настройка две обнаружения каналов для начального и photoconverted флуоресценции, а также "фотопреобразования канал". В этом примере мы будем использовать очищенную mOrange2 белка, который является оранжево-красного флуоресцентного белка photoconvertible. Видов оранжевый определяется с помощью 561 нм и возбуждения флуоресценции собирается между 570 нм и 630 нм. Photoconverted красного видов, обнаруженных с применением 633 нм и возбуждения флуоресценции собирается между 640 нм и 700 нм. Для "фотопреобразования канал" выберите 488 нм возбуждения флуоресценции и собирать между 490 нм и 540 нм. (Примечание:. Изображений фотопреобразования канал не является строго обязательным)
- Использование канала для работы с изображениями начальной флуоресценции с непрерывным сканированием для регулировки мощности лазера и детектора усиления для оптимального качества изображения.
- Активировать фотопреобразования канал и выберите малой мощности лазера. Начало серии изображений промежуток времени и постепенно увеличивать фотопреобразования лазерных до значительных отбеливания начальной флуоресценции не наблюдается. Продолжить сканирование до начальной флуоресценции составляет примерно 75% беленой.
- Отключить фотопреобразования канала и активировать обнаружения канала для photoconverted флуоресценции. Начать съемки с высоким коэффициентом усиления детектора и малой мощности лазера и постепенно увеличивать мощность лазера до photoconverted флуоресценции обнаружено. Как только вы обнаружили photoconverted флуоресценции можно регулировать мощность лазера и детектора усиления для оптимального качества изображения.
- Наконец, мощность лазера использовандля фотопреобразования, а также длительность фотопреобразования должны быть оптимизированы. Увеличение мощности фотопреобразования лазер ускорит скорость фотопреобразования, однако слишком много мощности лазера будет photobleach белка.
- После оптимальной мощности лазера фотопреобразования и продолжительность были определены, эти параметры могут быть использованы для настройки стандартных фотообесцвечивания или FRAP модуля и "фотопреобразования канал" больше не требуется.
3. Двойной датчик оптический выделение с mOrange2 и Dronpa
Из-за красное смещение спектральных свойств, mOrange2 может быть использован в сочетании с зеленым флуоресцентным photoswitchable Dronpa белка для двойного зонда оптических подсветка разрешение селективного выделения из 4 отдельных клетки (органелл) населения.
- Клетки, выращенные в стеклянным дном блюда Маттек и трансфицированных за 24 часа до визуализации с использованием стандартных Lipofectamine2000 трансфекции 1.
- Настройка микроскопа для mOrange2 фотопреобразования, как описано в разделе 2.
- Настройка микроскопа для photoswitching Dronpa. Dronpa флуоресценции могут быть отображены для использования mOrange2 "фотопреобразования канал" (см. п. 2.2). (Примечание: Свернуть мощности лазера используется для визуализации Dronpa, потому что слишком много мощности лазера приведет к инактивации Dronpa.) Добавить канал для фотоактивации Dronpa. Мы используем 800 нм двухфотонного возбуждения фотоактивации, но альтернативно это может быть достигнуто использованием 405 нм возбуждения. Определить мощность лазера требуется для работы с изображениями, фотоактивации и фотоинактивации Dronpa флуоресценции.
- Внимание: фотопревращения mOrange2 и инактивации Dronpa оба происходят от 488 нм возбуждения. Из-за высокой мощности лазера, необходимых для mOrange2 фотопреобразования это также инактивировать Dronpa флуоресценции. С другой стороны, Dronpa инактивация происходит уже при гораздо более низких мощности лазера и может быть выполнена без существенного mOrange2 фотопреобразования.
- Как только параметры mOrange2 фотопреобразования и Dronpa photoswitching установлены, двойной зонд оптического подсветки достигается за счет следующих шагов. Во-первых, инактивируют Dronpa флуоресценции всему полю зрения с малой мощностью 488 нм возбуждения. Во-вторых, выбрать область интересов и photoconvert mOrange2 с высокой мощностью 488 нм возбуждения. Наконец, выберите регион представляет интерес для активации Dronpa флуоресценции.
4. Представитель Результаты
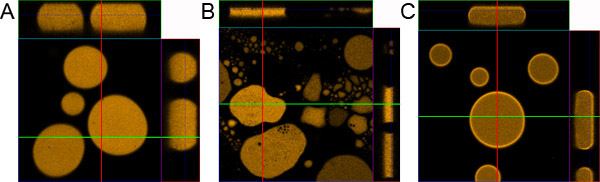
Рисунок 1. Капли пробоподготовки.) Правильно подготовленные капли образца. Б) образца, приготовленного без покрытия слайд микроскопа и покровного стекла. С) образца, приготовленного без добавления 0,1% BSA.
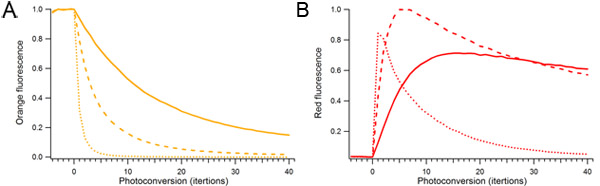
Рисунок 2. Влияние фотопреобразования мощности лазера и продолжительность на mOrange2 фотопреобразования. Одноместный капель, содержащих протеин mOrange2 непрерывно photoconverted использованием разного количества 488 Мощность лазерного нм. Относительная мощность лазера, используемого для фотопреобразования составила 10% (твердые), 25% (пунктир), и 100% (пунктир). ) Оранжевый флуоресцентный видов. Б) Photoconverted красный флуоресцентный видов.
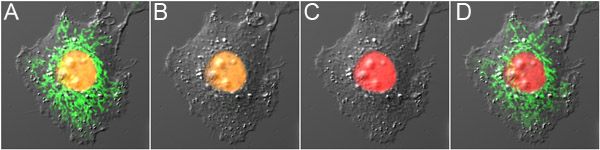
Рисунок 3. Двойной датчик оптический выделение с mOrange2 и Dronpa.) Сотовые выражения mOrange2-гистонов H2B и Dronpa-Мито до фотопреобразования, демонстрируя оранжевые флуоресценции в ядре и зеленого свечения в митохондриях. Б) Dronpa флуоресценции был выключен с малой мощностью 488 нм возбуждение, что приводит к минимальным фотопревращения mOrange2. С) mOrange2 был photoconverted до красного с высокой мощностью 488 нм возбуждения. D) Dronpa флуоресценции был включен еще раз, используя 800 нм 2-фотонного возбуждения. Панели перекрытия флуоресцентные изображения вместе с контрастное изображение вмешательства дифференциала.
Обсуждение
Очищенной люминесцентные образцы капли белка очень удобно типовой формат для фотофизических характеристик флуоресцентные белки, например, для исследования кинетики и фотообесцвечивания фотопреобразования кинетики. Крайне мало объема капли (~ 20 пиколитра) облегчает фотообесцвечива?...
Раскрытие информации
Благодарности
Мы благодарим В. Майк Дэвидсон (Университет штата Флорида) за предоставление плазмиды ДНК, кодирующий флуоресцентные белки. Работа выполнена при поддержке Национального института здоровья грант GM72048 (для ДПР).
Материалы
| Name | Company | Catalog Number | Comments |
| Microsope slides | VWR international | 48312-003 | |
| 22 mm cover glass | Corning | 2940-245 | |
| 1-octanol | Sigma-Aldrich | O4500 | |
| methyltrimethoxysilane | Sigma-Aldrich | M6420 | |
| MatTek dishes | MatTek Corp. | P35G-1.5-14-C | |
| Lipofectamine2000 | Invitrogen | 11668-019 |
Ссылки
- Kremers, G. J., Hazelwood, K. L., Murphy, C. S., Davidson, M. W., Piston, D. W. Photoconversion in orange and red fluorescent proteins. Nature Methods. 6, 355-358 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены