Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Микродиссекции данио рерио эмбриональных тканей глаз
В этой статье
Резюме
В этой статье описывается подход к microdissect данио сетчатки и без пигментного эпителия сетчатки связаны, от одного до трех дней эмбрионы функции организма крыс.
Аннотация
Данио рерио является популярная модель животного для исследования на развитие глаза из-за его быстрого
протокол
Часть 1: Подготовка перед микродиссекции
- Решения
- E3 среду 4 (5 мМ NaCl, 0,17 мМ KCl, 0,33 мМ CaCl 2 и 0,33 мМ MgSO 4).
- Раствор Рингера 1, 5 (116 мМ NaCl, 2,9 мМ KCl, 1,8 мМ CaCl 2, 5 мМ HEPES, pH7.2), фильтр стерилизовать.
- 5N NaOH.
- Химическое травление вольфрамовой иглы
- Безопасные небольшой химический стакан, содержащий 5N NaOH на чашку Петри на глине.
- Прикрепить скрепку на стороне стакана, так что он вступает в контакт с раствором NaOH.
- Подключите отрицательный электрод от источника питания постоянного тока на скрепку и положительного электрода к одному концу короткая часть (~ 2 см) из вольфрамовой проволоки.
- Оберните другой конец вольфрамовой проволоки с небольшим шариковый пластилин и падения этой целью в раствор NaOH.
- Повышение напряжения до примерно 3 В и падение проволоки вверх и вниз в раствор NaOH до хорошую скорость травления достигается. Иглу в хорошем качестве можно обычно запечатлелись в 10 минут.
- Вольфрамовой проволоки подвергаются решение будет постепенно стали тоньше. Когда мяч глины падает, с другой стороны провода, который все еще присоединен к положительному электроду будет резкое форму иглы.
- Промыть острой иглой с раствором Рингера или E3, чтобы удалить отложения солей.
- Прикрепить иглы аппликатора деревянные лентой или иглодержателя для легкой обработки.
- Культура пластин
- Сокол 60 х 15 мм пластинах полистирола культуры готовы использовать для сетчатки микродиссекции.
- Для вскрытия РПЭ-прилагается сетчатки, раздавить двух эмбрионов полностью в культуру пластину, содержащую раствор Рингера, чтобы избавиться от клейкости поверхности за 30 минут до вскрытия. Незадолго до вскрытия, вымыть пластины широко раствором свежего Рингера.
- Эмбрионы сбора и постановки
- Взрослых рыбок данио ведутся, как описано 4, 5.
- Отдельные родители рыбы в стационарных цистерн разведения попарно делителя ночь перед размножением.
- Удалить разделитель после комнате свет включен в следующее утро. Разрешить родителям крест на 10-минутным интервалом каждые полчаса. Отдельные рыбы после каждого перехода.
- Поддерживать эмбрионами собрали с каждого пересечения в E3 среду отдельно при 28 ° C.
- Этап эмбрионов на 10 до 12 часов после оплодотворения (HPF) и restage непосредственно перед рассечение на конкретные моменты времени, в соответствии с установленными критериями 1, 6.
Часть 2: Dissection - удаление мозга и глаз выдержка 1
- Процедуры, описанные в этом разделе, являются общими для вскрытия сетчатки (Часть 3А) и РПЭ-прилагается сетчатки (Часть 3B).
- Все прекрасно вскрытия осуществляются при помощи кончика Дюмон щипцов и помогать другой паре Дюмон щипцы для позиционирования ткани. Химическим травлением вольфрамовой иглы могут использоваться для тонкой манипуляции, если необходимо.
- Все прекрасно вскрытия проводятся на ~ 5-8-кратным увеличением при Olympus SZX16 микроскоп с 1X цель или эквивалент.
- Поддерживать эмбрионами в E3 среды в настольный инкубатор при 28 ° C рядом с микроскопом для легкого доступа эмбриона во время вскрытия.
- Столике микроскопа нагревают до 28 ° С пластиной термо чтобы свести к минимуму влияние колебаний температуры на экспрессию генов.
- Передача эмбриона на конкретной стадии развития, чтобы раствор Рингера в Сокол 60 X 15 мм пластины культуры получали, как описано в части 1 # 3.
- Отрезанная голова с частью передней ствол быстро из организма.
- Pin заднем конце этой ткани на культуру пластину с помощи щипцов.
- Открытая головка на спинной стороне, начиная с переднего лоб.
- Удалить мозга так, чтобы медиальной стороны глаз подвергается и вверх для дальнейших манипуляций.
Часть 3А: вскрытие сетчатки 1
- Подготовка эмбрионов, как описано в Части 2.
- Тщательно кисти подвергается ПЭС на медиальной стороне глазного яблока, который сталкивается в сторону повышения на кончике пинцета, пока небольшое отверстие в сетчатке видел.
- Продолжить чистки и пилинга действия до медиальной стороны сетчатки почти все выступающие. Избегайте царапин и штамповки подвергаются сетчатки.
- Для удаления боковых ПЭС на сетчатке, которая в настоящее время сталкивается вниз, подход, который и кисть под углом примерно 45 ° от поверхности пластины культуры.
- Удалить НПП, который прилагается довольно твердо ора Серрата, закрепив отдельные части НПП, чтобы сulture пластина для вскрытия, а затем поднимите сетчатки мягко.
- Ролл сетчатки на дне культуры блюдо для очистки остаточных ППД.
- Мы заметили, что этот конкретный полистирола Сокол культуры пластина имеет преимущественное соблюдение НПП в течение приблизительно 20 минут один эмбрион подавлено. Это свойство используется для удаления остатков РПЭ. Тем не менее, клетки сетчатки сделать прилипают к поверхности, в меньшей степени, которые могут быть проверены тесно при большом увеличении. Нужно найти баланс между полнотой НПП удаления и сетчатки целостности.
- Линзы часто придерживается культуры пластины и отделяется от сетчатки в процессе прокатки. Иногда, необходимо отделить объектив травления иглы вольфрама с закрученной действие на поверхности линзы.
- Эти процедуры могут успешно удалить НПП от сетчатки без ущерба для целостности тканей. На это указывает хорошее общее морфологии (рис 1B и B ') и гистологии (рис. 1В "), стрелка, в частности, сохранение внеклеточного матрикса между слоем фоторецепторов и РПЭ является исключительно хорошим (рис. 1В."; сравнить с гистологии со всего эмбриона (рис. 1А ")).
Часть 3B: НПП подключением сетчатки рассечение 3
- Подготовка эмбрионов, как описано в Части 2.
- Pin головы до культуры пластины ассистент пинцетом. Поднимите глаза мягко от задней боковой-н-ролл на передней стороне.
- Предполагаемого сосудистой оболочки и склеры ткани на внешней стороне слоя НПП крепятся довольно плотно к коже и может быть главным образом снимают прокаткой глаза внимательно передней стороне.
- Снимите объектив с вольфрамовой иглы после боковой стороне глаз подвергается и тогда, когда глаз еще привязаны к коже.
- Эти процедуры могут успешно сохранить целый пласт РПЭ с сетчаткой. Фиксированные choroids и склеры ткань может быть в значительной степени удалено (рис. 1С, С и С ").
Часть 4: образец ткани коллекции для работы РНК
- Расчлененный образцы могут быть собраны в TRIzol в РНКазы без микроцентрифужную трубки для определения характеристик вниз по течению РНК, как описано выше 1.
Представитель Результаты
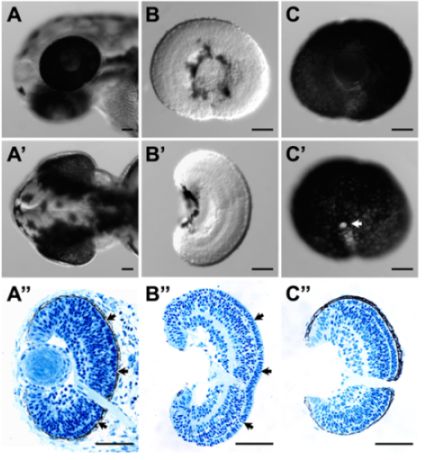
Рисунок 1. () Боковые и (') спинной зрения данио личиночной головы на 52 HPF до вскрытия. (") Соответствующей гистологической части личиночной головы () & ('). (В) и бокового (В') спинной зрения расчлененные сетчатки на 54 HPF. Поверхности сетчатки цел с обеих боковых и спинной взглядов. (В ") соответствующей гистологической части расчлененного сетчатки (B) и (В '). Структура сетчатки и сетчатки ламинирования был цел. В частности, внеклеточного матрикса между слоем фоторецепторов и НПП (", стрелки) хорошо сохранился в расчлененный сетчатки (В", стрелки). (C) Боковые и (С) медиальные зрения расчлененные РПЭ-прилагается сетчатки на 52 HPF. НПП слой цел и непрерывным, который также обозначается гистологической части расчлененного ткани (C "). Белую область в С" является зрительного нерва (стрелка). Для гистологии, образцы тканей были собраны и зафиксированы в 4% параформальдегида. Пластиковые вложения и секционирования этих образцов были выполнены, как описано 3. Шкала бар = 50 мкм.
Обсуждение
Микродиссекция тканей данио глаз может эффективно получить нетронутыми сетчатки и РПЭ-прилагается сетчатки. Это существенно помогает выражение исследований, касающихся конкретных тканей глаза (например, сетчатки или РПЭ). На самом деле, мы успешно использовал эти процедуры, чтобы пол...
Раскрытие информации
Благодарности
Эта работа поддерживается запуск фонд от Отделения биологических наук Университета Пердью.
Материалы
| Name | Company | Catalog Number | Comments |
| Cordless pestle motor | VWR international | 47747-370 | |
| DC power supply | Lascar | PSU130 | Any DC supply would work. The specific voltage of a different machine will need further optimization. |
| Disposable pestle & microtube, 1.5 mL (DNase, RNase and pyrogen-free) | VWR international | 47747-366 | These are used for tissue collection in TRIzol for expression analysis. |
| Dumont #5 forceps, Tips: 0.05 x 0.01mm, Inox | World Precision Instruments, Inc. | 500341 | Fine tip dimension is desirable but is not inflexible, as one may need to sharpen the tip from time to time. |
| Dumont #5SF forceps, Tips: 0.025 x 0.005mm, Inox | Fine Science Tools | 11252-00 | Fine tip dimension is desirable but is not inflexible, as one may need to sharpen the tip from time to time. |
| Falcon polystyrene culture plates, 60 X 15 mm | BD Biosciences | 351007 | These plates are used as dissection plates. |
| Olympus SZX16 Stereomicroscope | Olympus Corporation | SZX16 | Any stereomicroscope would work. We used Leica stereomicroscope in previous studies1-3 without any issues. We also use the 1X objective exclusively for the dissection even though we have a 2X objective installed. |
| Sharpening stone | Fine Science Tools | 29008-01 | Use this to sharpen the tip of the forceps if necessary |
| Thermo plate | Tokai Hit | MATS-U55SZX2B | This is used to maintain the temperature of the tissue throughout dissection and minimize the influence of temperature fluctuation on gene expression. We also put the whole microscope in an environmentally controlled room at 28°C during dissection in previous studies1-3 with good success. |
| Trizol, 100 mL | Invitrogen | 15596-026 | |
| tungsten wire, 0.015 inch diameter | World Precision Instruments, Inc. | TGW1510 | |
| Wooden Applicator | Puritan | 807 | This is used for holding the chemically-etched tungsten needle. |
Ссылки
- Leung, Y. F., Dowling, J. E. Gene expression profiling of zebrafish embryonic retina. Zebrafish. 2, 269-283 (2005).
- Leung, Y. F., Ma, P., Link, B. A., Dowling, J. E. Factorial microarray analysis of zebrafish retinal development. Proc Natl Acad Sci U S A. 105, 12909-12914 (2008).
- Leung, Y. F., Ma, P., Dowling, J. E. Gene expression profiling of zebrafish embryonic retinal pigment epithelium in vivo. Invest Ophthalmol Vis Sci. 48, 881-890 (2007).
- Nusslein-Volhard, C., Dahm, R. . Zebrafish : a practical approach. , (2002).
- Westerfield, M. The zebrafish book : a guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203, 253-310 (1995).
- Fadool, J. M., Dowling, J. E. Zebrafish: a model system for the study of eye genetics. Prog Retin Eye Res. 27, 89-110 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены