Method Article
Визуализация и количественной оценки внутриклеточного Взаимодействия Neisseria meningitidis И правам α-актинина по конфокальной микроскопии
В этой статье
Резюме
Neisseria meningitidis (Nm), грамотрицательных человека конкретных дыхательных патогенов, могут быть привязаны к человеческой α-актинина. Здесь мы приводим протокол для визуализации colocalisation бактерий с внутриклеточной α-актинина после бактериальной вступления в человеческом мозгу микрососудистой эндотелиальных клеток (HBMECs).
Аннотация
Белка Opc из Neisseria meningitidis (Nm, менингококков) является поверхностной выразил интегральный белок наружной мембраны, которые могут выступать в качестве адгезина и эффективной invasin для человека эпителиальных и эндотелиальных клеток. Мы определили эндотелиальной поверхности расположенных интегринов в качестве основных рецепторов для OPC, процесс, который требует Opc сначала связывается с интегрина лигандами, такими как витронектин и через их на клеточных рецепторов выражается 1. Этот процесс приводит к бактериальной инвазии эндотелиальных клеток 2. Совсем недавно мы наблюдали взаимодействие с Opc 100kDa белок, содержащийся в целом лизатов ячейки клеток человека 3. Мы изначально наблюдается такое взаимодействие, когда белки клетки-хозяина, разделенных электрофорезом и смыл на нитроцеллюлозные были наложены с OPC-выражения Нм. Взаимодействие прямых и не связано промежуточных молекул. По масс-спектрометрии, мы установили личность белка α-актинина. В связи с отсутствием поверхности, выраженное α-актинина был найден на любой из восьми линий клеток изучены, и, как взаимодействие с Opc эндотелиальных клеток в присутствии сыворотки привести к бактериальной вступления в клетки-мишени, мы рассмотрели возможности двух белков, взаимодействующих внутриклеточно. Для этого, культурный человеческий мозг микрососудистых эндотелиальных клеток (HBMECs) были инфицированы OPC-выражения Нм для продолжительных периодов времени и места интернализованных бактерий и α-актинина были исследованы с помощью конфокальной микроскопии. Мы заметили, зависящих от времени увеличение colocalisation из Нм с цитоскелета белка, который был значительным после восьмилетнего периода час бактериальных интернализации. Кроме того, использование количественных ПО для обработки изображений позволило получить относительную меру colocalisation из Нм с α-актинина и других белков цитоскелета. Здесь мы приводим протокол для визуализации и количественной оценки colocalisation бактерии с внутриклеточными белками после бактериальной вступления в эндотелиальных клетках человека, хотя процедура применима и к человеческой эпителиальных клеток.
протокол
1. Иммунофлуоресценции протокола
Посев, инфекции и иммуно-окрашивание
Следующие процедуры требуют подходящего уровня культуры безопасности тканей и микробиологического лабораторным оборудованием.
ДЕНЬ 1
А. Подготовка клетками-мишенями для инфекции
- Семенной HBMECs на 50% слияния (~ 1.5x10 4 клеток / см 2) на стекле покровные (16 мм в диаметре) помещается в 12-луночного планшета (3,8 см 2 области роста / а).
Рост среды: RPMI 1640 дополнена с 15% тепла инактивированной (56 ° С, 30 мин) FBS, 2 мМ глютамина, 1 мМ пирувата натрия, 100 ед / мл пенициллина / стрептомицина, 1% (об. / об) MEM без незаменимых аминокислот кислоты раствором и 1% MEM витаминов решение. - Культура в течение ночи (O / N) при 37 ° С, в 5% СО 2 инкубатора.
Б. Бактериальная культура
- Расти штамм интерес O / N (16-18 ч) по необходимости, например, средний мозг Сердце инфузии (BHI) агаром с добавлением 10% подогревом крови лошади при 37 ° С в 5% СО 2 атмосферы 4.
ДЕНЬ 2
А. Подготовка Бактериальные (N. meningitidis) Подвеска
- Использование 10 мкл цикла культуры, сделать приостановлении ночь бактериальной культуры в 2 мл PbSb (PBS с кальцием и магнием).
- Разрешить большие бактериальных агрегатов для урегулирования, оставив подвеску стоять в течение 5 мин при комнатной температуре (RT).
- Не нарушая гранул, передача верхней 1 мл суспензии (запас посевного) в стерильную пробирку.
- Для оценки бактериального числа в запас посевного, добавлять порциями (20-50 мкл) в пробирки с 1 мл объемам в размере 1% SDS в 0,1 М NaOH и аккуратно перемешать для растворения.
- Измерьте содержание нуклеиновых кислот решение, определяя оптическую плотность при 260nm (A260). В наших руках, A260 1 соответствует 5x10 8 колониеобразующих единиц / мл (КОЕ / мл). Это можно проверить путем подготовки серии разведений фондовом посевного материала в PbSb, покрытие на чашках с агаром и подсчет колоний после O / N инкубации.
- Развести аликвоту посевного материала в запас инфекции среды [(M199 с добавлением 2% decomplemented (56 ° C, 30 мин) нормальной человеческой сыворотки (NHS)], чтобы получить требуемую плотность для бактериальной инфекции клеток-мишеней.
- В нашей лаборатории инфекции отношение 200-300 бактерий в клетки-мишени обычно используется.
Б. культуре клеток инфекции
- Вымойте покровных культур клеток с целевой 3 раза со средней Хэнка для удаления следов антибиотиков.
- Инфицировать клетки с свежеприготовленной суспензии бактериальных (описано выше) в течение 3 ч до 8 ч при 37 ° С, в 5% СО 2.
- В конце периода инфекции, мыть клетки три раза PBS и зафиксировать в 500 мкл 2% параформальдегида (PFA) в течение 30-45 минут при комнатной температуре или O / N при 4 ° C.
- Параформальдегид фиксации на концентрации и времени показано выше, было установлено, что подходит для сохранения бактериальных и клеточной морфологии.
- После смывания параформальдегида, permeabilise параформальдегид фиксированной клетки путем инкубации в 0,1% Тритон Х-100 разбавляют в PBS в течение 10 мин.
- Вымойте образцы 3 раза PBS.
- Приступить к иммуно-окрашивание или, наоборот, оставить образцов в 500 мкл 1% BSA / PBST O / N при 4 ° C.
ДЕНЬ 3
Иммуно-окрашивания
Окрашивание внутриклеточных бактерий и α-актинина может осуществляться последовательно или одновременно на использование соответствующих первичных и вторичных антител в следующем: все процедуры можно проводить в 12-луночных планшетах.
- Блок покровные содержащие permeabilised клеток с 500 мкл 3% BSA / PBST (PBS, содержащем 0,05% Тритон Х-100) в течение 30-60 минут при комнатной температуре
- После промывки PBS, передавать друг покровное к новой сухой колодец в 12-луночного планшета.
- Добавить первичных антител против бактерий и α-актинина; восьмидесяти до 100 мкл антител на покровное достаточно, если осторожно добавляют, чтобы покрыть поверхность покровного стекла. Инкубировать 1 час при комнатной температуре.
- Мы использовали поликлональные антисыворотки кролика против Neisseria meningitidis (лаборатория-рейз) и мышиное моноклональное антитело (МАБ) против α-актинина (Abcam) одновременно. В некоторых экспериментах вместо анти-α актинина, моноклональные антитела против актина или виментин были использованы (Sigma).
- В конце инкубации, добавить 200 мкл PBS к колодцу, поднять покровное и место в новой скважины, содержащую 500 мкл PBS.
- Через 5 мин, удалить PBS с помощью пипетки, а затем добавить свежие PBS. Повторите два раза. Трансфер в покровныхновый сухой колодец.
- Добавить соответствующие вторичными антителами конъюгированных с различными флуорохромами разводят в 1% BSA / PBST, инкубировать при комнатной температуре в течение 1 ч в темноте.
- Для обнаружения бактериальных, мы использовали анти-Ig кролика конъюгированных с TRITC и для α-актинина и других цитоскелета обнаружения белка, мы использовали против мышиного Ig конъюгированные с FITC-либо (Sigma) или Alexa Fluor 488 - (Invitrogen).
- В конце инкубации, мыть как в шагах 4 и 5.
- Счетчик пятно с 0,6 мкг / мл DAPI в PBS (ДНК пятна) в течение 5 минут при комнатной температуре в темноте.
- Полоскание с PBS.
- Горы покровные (клетки вниз) на слайдах с каплей монтажа среды (е, ж Mowiol или Vectashield)
- Хранить в темноте при 4 ° C.
- Образцы готовы для наблюдения под микроскопом.
2. Конфокальной микроскопии лазерного сканирования (CLSM)
Для наблюдения и захвата изображений внутриклеточных бактерий и элементы цитоскелета, мы использовали immunolabelled образцы и захватили изображения с помощью Leica СП5-AOBS конфокальной лазерной сканирующей микроскопии придается Leica DM I6000 перевернутой epifluorescence микроскопом. Все изображения были получены с помощью 63x NA 1,4 маслом объективный процесс погружения и с программным обеспечением Leica.
CLSM процедуры:
- Чтобы начать процедуру CLSM, добавьте каплю иммерсионного масла, чтобы объективно и место образца слайда, покровное стороной вниз, на столик микроскопа.
- Установите микроскоп для визуального режима и найти сферу интересов использованием глаз кусками микроскопом.
- Использование программного обеспечения Leica, выберите режим хуг приобретения.
- Выберите 512 х 512 Формат (размер кадра). Для colocalisation исследований, более высокое разрешение, более точные изображения, имея в виду предел разрешающей способности микроскопа. Затем выберите режим двунаправленной X, что позволит увеличить скорость сканирования и уменьшить фото-отбеливание.
- Настройка последовательной настройки сканирования. Нажмите на "след" функцию и выбрать один из режимов сканирования. Мы используем "между строк" режиме.
- Выберите лазерных лучей в соответствии с флуорохромами сопряженных с вторичными антителами: 405 нм для DAPI (синий), 488 нм для Alexa Fluor 488 (зеленый) и 561 нм для TRITC (красный). Активировать ФЭУ (ФЭУ) 1, 2 и 3 соответственно. Настройте параметры ФЭУ определить правильный длины волны излучения.
- Настройка основных ("начать") и нижней ("конец") г-стеки или серии. Далее, установите необходимые "Z-шагом".
- Neisseria meningitidis является диплококк (рис. 1G) и кокки, так как каждый имеет диаметр около 0,5 мкм, г-размер шага 0,20 мкм был выбран, чтобы повысить вероятность сканирования каждого кокками крайней мере дважды. Кроме того, в размер шага для оптимального разрешением 0,1 - 0,2 мкм.
- Установить окончательные параметры сканирования, выбрав линию среднем от 3 до улучшения отношения сигнал-шум.
- Нажав на кнопку "старт" двойной или тройной окрашенные образы получаются путем последовательного сканирования на разных длинах волн для устранения перекрестных помех между различными хромофоров.
- Для указания colocalisation двух флуорохромов, выберите "наложение", чтобы слить выбранные каналы в одно изображение, например, когда оба Alexa 488 (зеленый) и TRITC (красный) флуорохромами colocalise, желтый цвет появится в накладным изображение .
- Компиляция Z-стеки или ряда с использованием "максимальная проекция" функцию для построения 2D-изображения, необходимые для визуализации возможных colocalisation. Более детальный анализ colocalisation может быть получена путем анализа каждой оптической части.
- После приобретения Z-стеки или серии, обработку данных для получения ортогональных на изображение для визуализации внутриклеточной локализации различных элементов (рис. 1E).
3. Количественная оценка Colocalisation
Статистический анализ конфокальной микроскопии сканирования изображений выполняются с Volocity программное обеспечение (Импровизация, PerkinElmer). Это программное обеспечение предоставляет инструмент, созданный специально для colocalisation анализ, как описано в Мандерс и соавт. (1993) 5. Colocalisation в контексте цифровых изображений флуоресценции можно охарактеризовать как обнаружение сигнала, в то же воксела (пиксель объему) места в каждом канале. Два канала из изображения двух различных флуорохромов взяты из той же области образца (руководство Volocity пользователя). Статистический анализ проводится с Volocity программное обеспечение (Импровизация, PerkinElmer), используя количественный анализ Colocalisation описано ниже.
Количественный анализ Colocalisation
- Создать библиотеку с CLSM изображения с помощью Volocity программного обеспечения.
- Выберите "расширенный фокус" с картинки в верхней панели. Этот инструмент будет составлять Z-стеки в 2D-изображения, которые будут проанализированы.
- Выберите "колокализации" инструмент. Два канала, которые будут проанализированы должны иметь одинаковую глубину цвета.
- Выберите область, что он будет количественно. Установить порог для удаления фона.
- Создать colocalisation выход, выбрав "генерировать колокализации". Colocalisation статистика создается для регионов интереса выбранной ранее.
- Выберите Мандерс "коэффициенты R (коэффициент перекрытия) и My (colocalisation коэффициент).
- Коэффициенты Мандерс "не чувствительны к интенсивности окрашивания, как они нормированы от суммарной интенсивности пикселей, таким образом они могут быть использованы при окрашивании одного антигена сильнее, чем другие.
- Перекрытие коэффициент R в соответствии с Мандерс 5,6 представляет истинных масштабов colocalisation, т.е. количество пикселей, которые colocalise по сравнению с общим количеством пикселей.
- С другой стороны, colocalisation коэффициент, My, описывает флуоресценции вклад более обильные часть (в данном случае α-актинина, зеленый), чтобы менее обильными часть (в данном случае бактерии, красный), то есть количество красных пикселей , которые пересекаются с зеленых пикселей по сравнению с общим числом красных пикселей.
- Коэффициенты Мандерс 'диапазоне между 1 и 0, где 1 очень высокая colocalisation, 0 означает нет; но они могут быть выражены в процентах для облегчения интерпретации.
- Экспорт статистику значений в документ Excel для представления данных.
4. Представитель Результаты
Внутриклеточная локализация OPC-Neisseria meningitidis выражения и α-актинина
Конфокальной микроскопии человеческого мозга микрососудистых эндотелиальных клетках, инфицированных Нм на 3 и 8 часов, как описано выше указанных colocalisation из α-и актинина Нм который, казалось, реже в 3 часа инфекции эксперименты (не показаны) по сравнению с культурами инфицированных в течение 8 часов ( Рисунок 1 AF). Очевидной colocalisation из α-актинина с OPC-выражения менингококков наблюдался каждый раз в> 5 повторить эксперименты. Статистический анализ с использованием нескольких colocalisation конфокальных изображений проводили, как описано выше. В целом, в HBMEC инфицированных OPC-выражения менингококков,> 25% перекрытием зеленый (α-актинина) и красный (Нм) пикселей было получено (Рисунок 2B, коэффициент перекрытия R). В отличие от α-актинина, эксперименты, в которых маркировка внутренним бактерий и либо актина или виментин была выполнена, время от времени colocalisation наблюдалось с актином, но что с виментин редко (Figure. 2B).
Данные были проанализированы с использованием коэффициента Мой, который учитывает относительное содержание каждой части. Мой является мерой частоты встречаемости более обильные сигнала (в данном случае зеленый, α-актинина) каждый раз, менее обильными сигнала (в данном случае красный, бактерии) происходит. Эта мера показывает поразительный уровень возникновения α-актинина в непосредственной близости от интернализованной менингококков (рис. 2А и С).
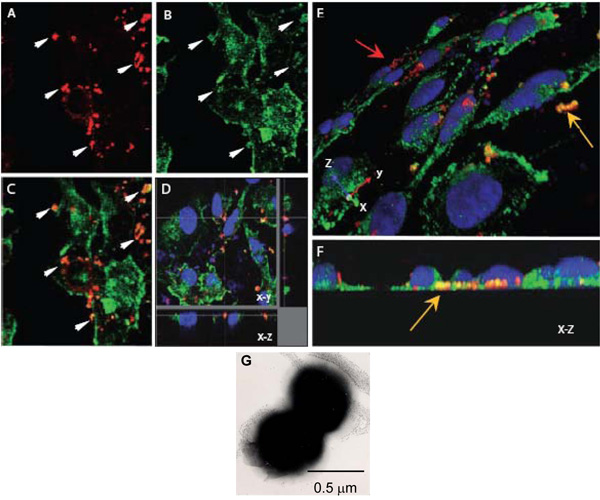
Рисунок 1. Конфокальной лазерной сканирующей микроскопии для оценки внутриклеточных взаимодействий Н. meningitidis с α-актинина. АГ. Сливной эндотелиальных монослоях, выращенные на покровных были инфицированы OPC-выражения (AF), Н. meningitidis. Через 8 ч, не соблюдают бактерий смываются, клетки фиксировали параформальдегида и permeabilised с 0,1% Тритон Х-100. Впоследствии, бактерии и α-актинина были окрашены, как описано выше (α-актинина, зеленые, бактерии, красный).
Переменного тока. Одно поле показывает ху изображения расположения Нм () или α-актинина (B). Наложение изображения в (С) указывает на несколько регионов, в котором желто-оранжевый цвет появляется предлагая colocalisation. Стрелки в (А) и (Б) показывают, регионы, где высокая степень α-актинина накопления, похоже, произошло около бактерий.
D. Оптическая вскрытия инфицированных монослоя HBMEC указывает colocalisation вокруг внутриклеточных бактерий, расположенных у основания ячейки.
Опять же, это colocalisation не из-за случайного близости от α-актинина, а общее пятно α-актинина в этом регионе является низким.
Е и F. Трехмерные изображения зараженных HBMEC монослоев обрабатываются как указано выше. Косой зрения апикальной поверхности (Е) показывает, приверженцем бактерий окрашенные красным (красная стрелка), тогда как ряд бактерий расположен по отношению к базальной поверхности эндотелиальных клеток (желтая стрелка) отчетливо оранжевый / желтый цвет. Базальные местоположение может быть более отчетливо видно на (F), которая является конечным на XZ сечение.
Г. негативно окрашенных изображений электронного микроскопа Н. meningitidis показывая егопреобладающей diplococcal с. Каждый кокками составляет около 0,5 мкм в диаметре.
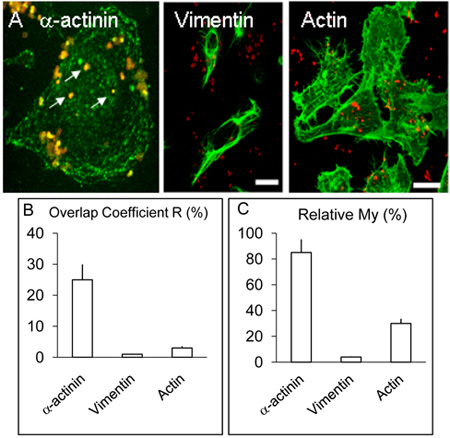
Рисунок 2. Локализация и распределение α-актинина, актина и виментин в клетках HBMEC.
А. Инфицированные монослои HBMEC лечили, как описано в легенде выше, но в дополнение к α-актинина, некоторые покровные были использованы для обнаружения актина или виментин по методике, аналогичной для α-актинина. Как и выше, α-актинина сосредоточены вокруг нескольких внутренним бактерий (белые стрелки). Виментин и актин не colocalise с бактериями в заметных уровней. Бар составляет 20 мкм.
Б. и С. значения коэффициентов R и моя были получены из более чем трех экспериментов с использованием Volocity программного обеспечения, как описано выше.
Обсуждение
Возможность связывания внутренним OPC-Neisseria meningitidis выражения для α-актинина было изучать с помощью HBMEC на рассмотрение colocalisation бактерий и белков цитоскелета в инфицированных клетках после 3-х и 8 ч инкубационного периода. По конфокальной микроскопии, colocalisation из Neisseria meningitidis с α-актинина может быть продемонстрировано. Примечательно, что хотя бактерии интернализованной на 3 часа, было мало colocalisation с α-актинина в это время точка. Бактериальные ассоциации с белком цитоскелета видимому, потребуется более длительный период внутриклеточного жительства, через 8 ч период инфекции, значительное количество бактерий было α-актинина-видимому, в тесной связи. Альфа-актинина это многофункциональный белок, и бактериальных взаимодействий с цитоскелета элемент может иметь значительное влияние на функции клетки-мишени, которая является предметом текущих исследований.
Количественная оценка colocalisation, как описано выше, требует тщательной подготовки образца. Особое внимание должно быть уделено образца фиксации, блокируя период и антител разведений. Для лучшего сигнала к шуму, каждый первичного и вторичного антитела следует титровать в предварительных экспериментах по определению оптимальных концентрациях. По нашему опыту, монтаж среду Mowiol производятся лучшие изображения.
Раскрытие информации
Благодарности
Исследования финансировались Wellcome Trust и Менингит Великобритании. HBMEC клеточная линия была предоставлена д-ра К. С. Ким. Конфокальной микроскопии и электронной микроскопии были проведены в фонд Вольфсон Bioimaging, Университет Бристоля. Мы также хотели бы поблагодарить г-н Алан Лирд, д-р Марк Джепсон (Бристольский университет), и г-н Алан Тилли (PerkinElmer) за их помощь и советы.
Материалы
1. Конфокальной микроскопии лазерного сканирования (CLSM):
Leica SP5 конфокальной микроскопии система: Эта система, с помощью сочетания AOTF (акустооптического перестраиваемого фильтра) и AOBS (акустооптического светоделитель), упрощает возбуждение с определенной длины волны.
2-программное обеспечение:
Leica конфокальной программного обеспечения LCS, Leica Microsystems, Германия.
Volocity 5, импровизация, PerkinElmer, США.
Ссылки
- Virji, M., Makepeace, K., Moxon, E. R. Distinct mechanisms of interactions of Opc-expressing meningococci at apical and basolateral surfaces of human endothelial cells; the role of integrins in apical interactions. Molecular Microbiology. 14, 173-184 (1994).
- Virji, M., Makepeace, K., Peak, I. R., Ferguson, D. J., Jennings, M. P., Moxon, E. R. Opc- and pilus- dependent interactions of meningococci with human endothelial cells: molecular mechanisms and modulation by surface polysaccharides. Molecular Microbiology. 18, 741-754 (1995).
- Sa E Cunha, C., Griffiths, N. J., Murillo, I., Virji, M. Neisseria meningitidis Opc invasin binds to the cytoskeletal protein alpha-actinin. Cellular Microbiology. 11, 384-405 (2009).
- Virji, M., Kayhty, H., Ferguson, D. J., Alexandrescu, C., Alexandrescu, J. E., Heckels, E. R. The role of pili in the interactions of pathogenic Neisseria with cultured human endothelial cells. Molecular Microbiology. 5, 1831-1841 (1991).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of colocalization of objects in dual color confocal images. Journal of Microscopy. 6, 357-382 (1993).
- Zinchuk, V., Zinchuk, O., Okada, T. Quantitative colocalization analysis of multicolor confocal immunofluorescence microscopy images: pushing pixels to explore biological phenomena. Acta Histochemica et Cytochemica. 40, 101-111 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены