Method Article
Взрослые и эмбриональные скелетных мышц Microexplant культуры и выделение скелетных мышц стволовых клеток
В этой статье
Резюме
Микро-расчлененный эксплантов техника прочный и надежный метод выделения пролиферативной скелетные мышечные клетки от молодых, взрослых и эмбриональных мышц в качестве источника стволовых клеток скелетной мускулатуры. Уникально, эти клетки были клонально производных для производства скелетных мышц линий стволовых клеток для трансплантации в естественных условиях.
Аннотация
Искусственный эмбриональных и взрослых клеток скелетных мышц имеют ряд различных видов использования. Микро-расчлененный эксплантов методике, описанной в этой главе, прочный и надежный метод выделения относительно большое число пролиферативной скелетные мышечные клетки от молодых, взрослых и эмбриональных мышц в качестве источника стволовых клеток скелетной мускулатуры. Авторы использовали микро-расчлененный эксплантов культур для анализа ростовых характеристик клеток скелетных мышц в дикого типа и дистрофические мышц. Каждый из компонентов роста ткани, а именно выживаемость клеток, пролиферацию и дифференцировку старения можно анализировать отдельно, используя методы, описанные здесь. Чистый эффект всех компонентов роста может быть установлена путем измерения ставки эксплантов нарост. Микро-эксплантов метод может быть использован для установления первичных культур от широкого спектра различных типов мышц и возрастов и, как описано здесь, был адаптирован авторами для того, чтобы выделение эмбриональных скелетных мышц прекурсоров.
Уникально, микро-эксплантов культур были использованы для получения клональных (одно происхождение клетки) скелетных мышц стволовых клеток (SMSC) линий, которые могут быть расширены и использованы для трансплантации в естественных условиях. В естественных условиях пересаженных SMSC ведут себя как функциональные, тканеспецифические, клетки-сателлиты которые способствуют регенерации скелетных мышечных волокон, но которые также сохраняются (в нишу спутниковой клетки), как маленький бассейн недифференцированных стволовых клеток, которые могут быть повторно изолирован в культуру использования микро-эксплантов метод.
протокол
Два подхода могут быть использованы для изоляции пролиферативных клеток скелетных мышц. В первом тканей мышц ферментативно переваривается, чтобы изолировать отдельные клетки до покрытия из 1. Второй способ заключается в эксплантов кусков мышечной ткани в культуру, чтобы позволить клеткам расти во время инкубации 2, 3. Второй метод описан в этом протоколе. Ткань сама культура имеет свои корни в эксплантов культуры. 2007 год был 100-летию со классические эксперименты Харрисона, в котором он получил нейрона наросты путем инкубации нерва эксплантов в висящих капель лимфатических 4. Методы эксплантов культуры были использованы и уточнены в различные контексты, в последующие 100 лет, как средство получения пролиферативного первичные культуры взрослых и эмбриональных клеток 4, 5. Принцип эксплантов метод, однако, остается той же, чтобы свести к минимуму травмы первичной изоляторе путем поддержания трехмерной структуре материнской ткани во время решающей ранних стадиях клеточного результат, обеспечивая при этом вырастают клетки с богатой питательной среды , в котором к пролиферации. В скелетных мышцах есть дополнительные преимущества при использовании эксплантов культуры, потому что акт резать мышечную ткань имитирует мышечные волокна травмы, обычные триггером для спутникового клеточной активации, миграции и 3 распространением, 6. Взрослый скелетных мышц сателлитных клеток (также называемый миобластов) являются пролиферативная населения стволовых клеток отвечают за ремонт волокна мышц и рост 7.
Скелетных мышц эксплантов таким образом имитировать в естественных условиях среды мышц регенерации и стимулирует стволовые миграции и деление клеток. В эмбрионе, большинство позвоночных скелетные мышцы (туловища и мышц конечностей) происходит от сомитов, хотя somitomeres и жаберных дуг привести к мускулатуры головы 8, 9. Myotome могут быть идентифицированы как две различные группы Myf-5 выразив стволовых клеток, расположенных в спинном, средние и боковые края дифференциации сомитов, соответственно. Соответственно, эти клетки порождать эпаксиальной мышцы спины, которые дифференцируют на месте, и вентральной и боковой hypaxial мускулатуры (конечностей, брюшной полости и дыхательных мышц), которые требуют миграции мышечных стволовых клеток из сомитов 10. Эмбриональные стволовые клетки мышц миграции находится под контролем Pax 3 11. Myf-5 выражение имеет важное значение для создания эмбриональных мускулатуры и это значение сохраняется и послеродовой мышцы, где более 98% активированных клеток спутниковой выразить Myf-5 12. Myf-5, следовательно, надежным и специфическим маркером пролиферации скелетных мышц стволовых клеток населения в обоих взрослых и эмбриональных тканей. Эмбриональные стволовые клетки мышц (также называемые мышечные клетки предшественники, скелетных мышц предшественников, миобластов и даже клетки эмбрионов спутника) может быть изолирован от сомитов ранней стадии мыши, куриных эмбрионах и лягушка 13. Для того, чтобы изолировать миогенной культур из эмбриональных скелетных мышц старых эмбрионов Авторы приспособили микродиссекции эксплантов техника для эмбриональных тканей. Аналогичный подход используется Коссу и др. 14. Генерировать клональной популяции клеток из эмбриональных сомитов 14.
1. В пробирке культуре клеток скелетных мышц стволовых клеток (SMSC)
SMSC являются клеточные линии, одного происхождения ячейки, которые были клонально производные от первичных скелетных мышц культурами эксплантов. Они могут быть культурными с использованием стандартной методологии культуры тканей, если достаточное внимание уделяется. Обратите внимание, что, если не указано иное, все описанные манипуляции проводят в асептических условиях с использованием капотом ламинарного потока (Класс 1 или Класс 2 стерильный кабинет), и все культуры Реагенты нагревают до 37 ° С на водяной бане до использования.
- Для приведения SMSC от жидком азоте (см. раздел 1.2 для замораживания вниз метод) криопробирки должна быть талой быстро и содержимое переносится в 5 мл предварительно нагретого (37 ° C) DF10 питательной среды для немедленного центрифугирования (1000 г в течение 3 мин), чтобы удалить ДМСО . Лучший способ оттепели клеток с помощью пипетки повторить небольшого количества подогретого культуральной среды во флакон до передачи в центрифуге трубки. Процесс таяния клетки должны проводиться очень быстро, поскольку криоконсервированных клеток содержат 10% ДМСО, который является токсичным для клеток при комнатной температуре (LD50 около 2 мин).
- После центрифугирования супернатант удаляют, а клетки промывают путем повторного приостановления осадок клеток в дальнейшем 5 мл DF10, то центрифуги, как раньше.
- Осадок клеток смешивается во второй раз с 5 мл DF10 и в результате клеточной суспензии передается небольшой 25 см 2 пластиковых ве культурыССПП.
- Культуры при температуре 37 ° С в увлажненной инкубатор, содержащий 5% СО 2 в воздухе. Если судов используются с фильтром шапки, шапки колба должна быть слегка ослабил в течение нескольких часов, чтобы позволить воздуху в культуру, чтобы уравновесить судно с инкубатором и подкисляют культуральной среде. рН среды контролируется путем включения фенол красный индикатор рН красителя в культуральной среде.
- Талая клетки должны быть всегда контролируется 24 часа после покрытия и повторно подается со свежими DF10 способом, чтобы обеспечить удаление мусора клеток и остаточных токсинов (см. примечания 1 и 2).
1.1. Субкультура
Для установленных SMSC линии, когда клетки достигают примерно 95% слияния, они должны быть удалены из их культуры судна, разбавляют и помещают в сосуд свежей чтобы дальнейший рост. Это субкультура процедура может быть достигнуто с помощью ряда различных ферментативных процедур, трипсин / ЭДТА является наиболее часто используемым (см. Примечание 3). Это обычная (и хорошо) практики расти клетки при плотностях, которые требуют от них быть пересевают на третий день роста. Для большинства линий SMS ячейки это может быть достигнуто путем разделения клетки 1 / 10 на каждой субкультуре. Это позволяет тщательный мониторинг клеток и позволяет тем, выполнение культуре ткани сразу же выделить необычное поведение роста (например, быстрый рост), которая может свидетельствовать фенотипические изменения в клеточной линии, такие как преобразование или уменьшение апоптоза вызвано адаптацией к условиям культивирования. Кроме того, последовательное и тщательное субкультивирования рутина значительно снижает частоту таких событий.
- Для субкультуры использованием трипсина (trypsinisation) судов, будут удалены из инкубатора, и их средний отказалась от аспирации.
- Затем клетки дважды промывают стерильной кальцием и магнием без фосфатно-солевом буфере (PBS), 10 мл на вымыть, удалить каждый раз стремление.
- Чтобы отделить клеточный монослой (25 мм 2 колбы) 1 мл 1 трипсин / ЭДТА добавляется и вышел на клетки при комнатной температуре в течение 2 3 мин, пока клетки начинают отделяться (см. примечание 4). Это можно увидеть на опытных пользователей, как маленькие отверстия, образующиеся в несколько непрозрачных монослоя, когда колбу на просвет (см. Примечание 5). Хотя клетки должны быть trypsinised течение времени, достаточного для обеспечения суспензии отдельных клеток, следует проявлять осторожность, чтобы не передержать SMSC, чтобы trypsinisation так как это приведет к высокому уровню клеточной смерти и бедными привязанности, когда клетки повторно покрытием.
- Для остановки реакции трипсин, сыворотки среде, содержащей (DF10) добавляется как минимум в 2 тома (т.е. в два раза объем раствора трипсина). Когда субкультивирования 25 мм 2 колбы удобно добавить 9 мл DF10 на данном этапе. 1 / 10 раскола клетки могут быть легко сделаны путем разведения 1 мл полученной суспензии клеток в новый 25 мм 2 культуру колбу вместе с еще 9 мл свежей среды DF10. Остальные клетки могут быть использованы для сотовых расширения (перевод на больших судна), криоконсервированных (см. раздел 1.2) или подсчитывали и помещали в экспериментальные блюда, скважин или пластины для распространения и выживания анализов, дифференциация, лечение фактором роста или для других целей (см. ниже).
1.2. Криоконсервация клеточных линий и первичных культур
- Для криоконсервации клетки отделены от их монослой для субкультуры (раздел 3.1.1) и осаждали центрифугированием (3 мин при 1000 г).
- Супернатант удаляют путем аспирации и клетки, тщательно и быстро ресуспендировали в 10 мл заморозить вниз смесь (10% ДМСО в DF10), прежде чем они снова осаждали с помощью центрифугирования.
- На этот раз осадок ресуспендировали в достаточной заморозить вниз перемешать, чтобы 0,5 мл клеточной суспензии в криопробирку (см. таблицу 1) и сразу же помещают в 80 ° С в течение ночи.
- Криопробирки передаются в жидком азоте на следующий день для длительного хранения (см. примечание 6). Как и при оттаивании клетки, этот процесс криоконсервации должны выполняться быстро. Хотя ДМСО является защитным для клеточных мембран при замораживании очень токсичны для клеток в незамерзающем температурах.
1.3. Определение числа клеток
- Для определения концентрации клеток в суспензии отдельных клеток (после субкультура) гемоцитометра Нойбауэр могут быть использованы. Для обеспечения точности подсчета покровное должны быть надежно закреплены на гемоцитометра базы (см. Примечание 7).
- Небольшую каплю суспензии клеток помещается близко к краю покровного стекла и будут рассмотрены под действием капиллярных сил.
- Затем клетки рассчитывали использованием инвертированного микроскопа с фазовым контрастом освещения. Для повышения точности конечной концентрации клетки, слоктя в счетной камере не должны пересекаться, если они оригинальные суспензии клеток должны быть разбавлены и клетки пересчет. Clumping следует избегать тщательного диссоциации клеток в процессе trypsinisation и 100-200 клеток в течение известны площадь поверхности должны учитываться для получения точной оценки количества клеток. Удобный метод с использованием гемоцитометра Neubauer является подсчет клеток в 2 и более 16 квадратных множеств. Плотность клеток на миллилитр, затем путем деления суммы на число наборов рассчитывал (т.е. 2) и умножения на 10 4. Например, 100 клеток насчитали более 2 х 16 квадратных наборов = 100 / 2 = 5 х 10 5 клеток / мл.
2. Создание первичных скелетных мышц культур Microexplant
Первичная микро-эксплантов культура может быть использован для выделения SMSC из любого доступного скелетных мышц, включая отдельные мышцы передних и задних конечностей, диафрагмы, спины и мышц брюшного пресса. Метод получения microexplant культур из несовершеннолетних и взрослых мышцы подробно описано Смитом и Шофилд 3 и впоследствии широко использовалась для получения SMS-клетки из молодых, взрослых и пожилых мышцы мыши. Метод также может быть использовано для получения культурных скелетные мышечные клетки из рыбы 24 и скелетных мышц человека (Рао и Смит, не опубликовано). Следствием SMSC от microexplant мышцы мыши показан на рисунке 1а, б. Метод был модифицирован для выделения эмбриональных мышц клеток-предшественников (см. раздел 3). Основной метод заключается в следующем:
- Асептического вскрытия целевой мышцы (ы) из свежих забито мыши достигается с помощью стерильных инструментов, чистые производственные площади и либеральное использование 70% этанола, спрей.
- Изолированные мышцы вымываются через две перемены DF20 средних и помещают в свежую среду DF20 в 60 мм 2 блюдо. Использование стерео микроскоп рассечение мышц тщательно микродиссекции в стерильных условиях, чтобы исключить жир, соединительная ткань и кости.
- Очищенные части мышцы, затем разрезать на 400 мкм 3 кубика, которые, используя щипцы ювелир с, размещаются индивидуально в центре 60 скважин из 96-луночного планшета, содержащую 50 мкл DF20 (см. Примечание 8). Уэллс проверяются под микроскопом и помещают в инкубатор. Внешний скважин наполнены физиологическим раствором для предотвращения высыхания скважин содержащих эксплантаты (3).
- Привязанности Microexplant и результат оценивается через 24-48 ч инкубации, а затем в 48-72 интервалы ч (в зависимости от темпов роста мышц культурность).
- Для расширения и изоляции клеток SMS, результатом культуры должны быть индивидуальный контроль для клеток с преимущественно SMSC морфологии, то есть клетки сферической одноядерные с высокой рефракции, которые растут в агрегирования кластеров (рис. 3.1b).
- После эксплантов результат устанавливается отдельным скважинам кормят (см. Примечание 9), путем добавления 50 мкл шагом среды, когда средний кислотность из-за увеличения плотности клеток. Когда хорошо заполнен и клеточных культур почти сливающийся, колодцы питаются замена 50% средний каждый раз, чтобы обеспечить поддержание "кондиционирования" факторов выделяется клетками (см. комментарии по условным среды при клонировании, раздел 2.1). Для подавления дифференциации, на 60-70% слиянии первичных наростов эксплантов включаются в кальций-обедненной среде заменив DF20 средой для кальций-обедненного DMEM/F12 (все добавки остаются теми же) для питания клетки 3.
- Эксплантов кондиционированной среды могут быть приготовлены из культур на данном этапе и сохранены для использования в процессе расширения и клонирования первичных SMSC (для метод клонирования, см. раздел 2.1, рис 1в е). Культуры пересевают использованием dispase метода (см. раздел 3.5).
- Клонально производные SMSC могут быть проанализированы в естественных условиях в виде внутримышечных инъекций (рисунок 3.1 дк) 19.
- Кариотипирование может быть осуществлена на клонально производные SMSC линий, чтобы подтвердить статус диплоидных (см. раздел 2.2, Рисунок 3.1 л) 25.
- Этот метод может быть адаптирован для культивирования эмбриональных мышц (раздел 3).
2.1. Вывод Клональный
Первичная эксплантов миобластов культур (рис. 1а, б) являются полезными и точный инструмент для создания различных параметров роста дикого типа и мутантных скелетных мышц. Клональный вывод, изоляции линии клеток из одной клетки, является важным шагом в изоляции скелетных стволовые клетки мышц, а также может быть использован для субклон SMSC линиями трансфицированных конструкций RNAi или трансгены. Основанная SMSC и первичных культур эксплантов высоко плотности зависимых и будет "рейтинговых агентствч "(отключаться от блюда и умирают), если покрытие из при слишком низкой плотности клеток. Это потому, что SMSC релиз растворимых факторов, которые необходимы для поддержания роста и выживаемости клеток. Для имитации высокой плотности культуры и поставку этих факторов во время процесс клонирования, SMSC клонируются в самостоятельной кондиционированной среды. добавлением кондиционированной среды было установлено, необходимо предусмотреть возможность отдельных клеток к пролиферации в изолированной среде.
- Условные среды готовят из пролиферирующих SMSC культивировали в течение 48 ч от 33 до 75% слияния.
- СМИ, в которых эти клетки выращивают удаляется через 48 ч и фильтруется с помощью шприца 0,2 мкм фильтр, что обеспечивает стерильность кондиционированной среды и удаляет все остатки клеток и мусора.
- Это кондиционированной среды смешиваются в соотношении 1:1 со свежей питательной среды (клонирование среды, см. примечание 10) и используется в качестве питательных сред для одного клонирования клеток.
- Для достижения одной клетки разведения клетки диссоциированных на суспензии отдельных клеток тщательным trypsinisation (создана SMSC) или dispase лечения (первичные культуры эксплантов) и разбавляют до концентрации одна клетка на 100 мкл среды клонирования.
- 50 мкл этой суспензии клеток могут быть покрыты в каждую из центра 60 скважин из 96-луночного планшета.
- Клетки имеют право прикреплять путем инкубации при температуре 37 ° С в 5% CO 2 в течение 6 часов и каждую лунку, затем тщательно забил на наличие клеток. Уэллс, содержащий 0 или более одной ячейки со скидкой на данном этапе.
- Уэллс содержащая одну ячейку прилагается тщательно отмечены и колонию на основе данного одной ячейки тщательно контролируется (ежедневно в течение первых нескольких дней), чтобы гарантировать, что только одна колония, полученных из одной ячейки, присутствует. Клеточные линии были только производные из скважин, содержащий 1 ячейку. Рис 1в-е иллюстрирует расширение таких одну ячейку производные колонии.
- Как только колония достигает слияния в 96-луночного планшета можно пересевают в одну лунку 48-луночного планшета.
- Клонированных клеточных линий может быть расширена внимательно на 24 - и 6-луночных пока достаточного клетки доступны для пластинки в 25 см 2 колбы.
- Скелетных мышц происхождения этих культур может быть продемонстрирована экспрессия Myf-5 (рис. 1е) или другие скелетные мышцы-специфических маркеров, таких как MyoD и Пакс 7.
- На данном этапе линии замороженных вниз до дальнейшего расширения (см. Таблицу 1).
2.2. Кариотипирование
Кариотипирование является важным методом мониторинга фенотип клетки. Клеточные линии, полученные клональной вывод следует karyotyped, чтобы они сохранили дополнением диплоидных хромосом без грубой хромосомных перестроек, которые могут повлиять на их фенотип.
- Для кариотипирование клетки выращивают до конца экспоненциальной фазы (80% вырожденная) в 25 см 2 судна культуры (2 дня после субкультивирования) максимизировать долю митотических клеток в культуре.
- Двадцать четыре часа до кариотипирование клетки подаются с 10 мл свежей питательной среды. 0,2 мл 10 мг / мл колхицина (см. Примечание 11) добавляется к клеткам, которые инкубируют еще в течение 1 ч при 37 ° C.
- Через 1 ч клетки могут быть стандартной процедурой субкультуры trypsinisation исключением того, что как питательной среды и PBS моет запоминаются, чтобы максимально увеличить количество делящихся клеток собраны.
- Диссоциированных клеток, сохранить средний и PBS моет прядут в 1000 г в течение 3 мин для осаждения клеток и супернатант удаляют и сбрасывают в отбеливатель.
- Осадок клеток, затем ресуспендировали в 5 мл хлористого калия 0,0075 М ровно 4 минуты, прежде чем клетки снова осаждали с помощью центрифугирования.
- Большинство супернатант отсасывают, оставляя небольшое количество (~ 50-100 мкл) в трубе для повторного подвески. Ресуспендируют клетки, щелкая базе трубки сокола, пока клетка суспензии достигается. Затем клетки помещали на лед и зафиксирована в свежеприготовленный ледяной фиксатором (метанол: ледяной уксусной кислоты в соотношении 3:1) следующим образом: 10 мл фиксатора медленно добавляют по каплям к клеткам с помощью небольшой стеклянной пипетки Пастера ( это предотвращает слипание клетка).
- Клетки помещали на лед в течение 30 минут, а затем осаждали центрифугированием, после чего осадок клеток является ресуспендировали в 0,5 мл свежей фиксатором.
- Слайды производится путем отказа от фиксированных суспензии клеток на подготовленные слайды (см. раздел 3.2.2.1), которое состоялось под углом 45 °. Для обеспечения хорошо разнесены метафазных пипетки должны быть проведены не менее 30 см выше слайде.
- Для визуализации хромосом, слайды окрашиваются в течение 2 мин в Leishman в Морилка, разбавляют три тома Gurr буфера рН 6,8 до использования.
- Слайды сушат при комнатной температуре и монтируется в DePex монтажа среды.
2.2.1. Подготовка слайдов Кариотипирование
- Стекло слайды (Premium слайды микроскопом, VWR International, Великобритания) готовы для использования в кариотипирование протокол, размещая их на ночь в большой (стекло) контейнер серной кислоты.
- Слайды затем помещаются под струей воды в течение 8 часов, а затем сохраняется в 70% этанола, пока требуется.
- Перед использованием слайдов следует промыть под струей воды в течение еще 30 мин и высушивают на воздухе при комнатной температуре в течение 1-2 ч.
3. Создание первичных Micro-эксплантов культур из эмбрионов
Три штамма мыши были использованы для проверки этого метода, дикого типа (C57BL/10) вместе с MDX и CAV3KO (как дистрофические мутанты). Дистрофина-дефицитных мышей MDX возникла спонтанно в C57BL/10, эта линия была получена из Bullfield лаборатории в 1991 году и с тех пор постоянно поддерживаться в нашем инбредных колонии 26. CAV3KO дистрофические мышей, которые содержат мутацию в кавеолина-3 гена, были выведены на C57BL/10 фон для 10 поколений, прежде чем использовать в этом исследовании, 27. Каждая мышь линия вызвала энергично воспроизводимый результат, пролиферации и выживания профиль, который был эмбриональной стадии конкретных и различны для каждого штамма. Следующие протоколы были приспособлены для эмбрионов от Смита и Скофилд П. Н. (1994) 3, по существу, как в Меррик 21.
3.1. Эмбрион коллекции
- Для получения поставил эмбрионов, пары создаются как естественные (1:1) вязки и женщин проверили каждое утро для вагинального зажигания. В день обнаружения плагин, эмбрионов считаются E0.5 дней (12 часов после оплодотворения).
- После вагинального пробки были обнаружены мужчины удаляются из клетки, чтобы обеспечить точность эмбриональных постановки.
- Когда желаемая зачаточном состоянии достигается (E11.5 к E17.5) матери убитого шейки дислокации, живот побрился, кожи и прилегающих районах протереть 70% спиртом и матка удаляется через горизонтальный разрез брюшной с использованием стерильных рассекающих инструментов.
- Матка затем промывают один раз в культуральной среде первичных эксплантов (PECM), а затем помещается в небольшое блюдо со свежими PECM до вскрытия.
- E11.5 к E17.5 эмбрионы расчлененное из матки использованием рассекает микроскоп и помещены индивидуально в чашки Петри, содержащих PECM в готовности для подробного микродиссекции.
3.2. Эмбрион микродиссекция
- Индивидуальные эмбрионов еще более расчлененный, чтобы изолировать районы, богатые в скелетных мышцах (рис. 2а). Задние и передние конечности (hypaxial скелетных мышц) расчленены из, а также верхняя и нижняя стенки тела (преимущественно эпаксиальной скелетных мышц). Для этого разреза по длине грудной клетки, живота и таза создана, чтобы позволить внутренних органов эмбриона должны быть удалены.
- Для обогащения для эмбрионального скелетные мышцы стволовые клетки (eSMSc), голову, спинной мозг и все внутренние органы удаляют.
- В более ранних эмбрионов (E15.5-E17.5 эмбрионов) также можно удалить кожу и хрящи / кости еще раз для увеличения доли мышечных клеток в культуре.
3.3. Настройка культур эмбрионов Microexplant
- Как только передние, задние конечности и верхняя и нижняя стенки тела были расчлененные, что они помещаются в свежем PECM и дальнейшее микродиссекции производить маленькие кубики из ткани одинакового размера (~ 0,5 мм 3; рис. 2а).
- Эти microexplants затем положить в центр 60 скважин из 96-луночного планшета (один эксплантов на лунку), содержащие 50 мкл PECM на лунку. Минимум 60 скважин, содержащих 1 эксплантов на скважину устанавливаются, в эмбрион изучены.
- Для культивирования эмбрионов центра 60 скважин можно разделить на регионы, где обозначающие эксплантов была получена из (рис. 2б). Такая конструкция позволяет 15 скважин в каждом из которых, соответственно, передних конечностей, верхняя стенка тела, задних конечностей и нижней части тела стене эксплантов 21.
3.4. Мониторинг вырост
Нарост курс является надежной мерой темпа роста эмбриональных скелетных мышц и эксплантов в тщательно контролируемых условиях, описанных здесь очень воспроизводимые.
- Эксплантов инкубируют при 37 ° С и 5% CO 2 в течение 3 недель и забил на 3, 7, 14 и 21-й день культивирования использованием инвертированного микроскопа. Эксплантов оцениваются в соответствии с уровнем слияния клеток в каждой отдельной скважины (рис. 3, е).
- Фотографические изображения культур могут быть приняты, например, с помощью зеркальной камере прилагается к микроскопу и 100 ASA Фудзи (цвет) или Kodak TMAX (черно-белые) профессионального кино (рис. 3, е).
- Скелетныхмышцы-специфических антител, специфичных для Myf-5 может быть использован для демонстрации скелетных мышц происхождения eSMSc, в зависимости от штамма 80 95% клеток, изолированных с помощью этого метода являются Myf-5 положительным. Другие маркеры, такие как MyoD и Пакс 7 может быть использован для демонстрации скелетных мышц происхождения этих клеточных популяций. Хотя эти клетки содержат очень высокий процент эмбриональной скелетной мышцы стволовые клетки, она не может считать (особенно для молодых эмбрионов), что все они скелетных мышц или происхождения, что все они стволовых клеток. Для выделения чистых популяций стволовых клеток необходимо клонально получить первичные культуры эксплантов, как описано в разделе 2.1.
3.5. Субкультивирования Первичная Эмбриональные эксплантов
После сливающиеся, эксплантов культур отображения морфологических особенностей SMSC (рис. 3, е) может быть как субкультивировали 3 вытекает, 21:
- Культура среду удаляется из выбранных скважин, фильтруется с помощью 0,2 мкм Acrodisc R_ шприц фильтр и сохранены для использования в качестве кондиционированной среды. Среды можно хранить при температуре 4 ° С в течение 1 недели.
- 100 мкл dispase разбавленным 1:10 в PECM добавляется в каждую лунку и пластины затем вернулся в 37 ° C инкубаторе в течение 20 мин.
- Кончика пипетки затем используется, чтобы мягко очистить ослабил клетки с поверхности хорошо.
- Клеточной суспензии центрифугируют при 1000 г в течение 3 мин для осаждения клеток и супернатант удаляют и выбрасывают.
- Клетки ресуспендировали в 200 мкл смеси 1:01 условных средних и PECM.
- Клетка смесь передается 48-луночного для дальнейшего расширения.
- Ибо в пробирке клетки анализ может быть покрыты при плотности 5 х 10 3 клеток / см 2, как в 48-луночных планшетах (каждый из которых содержит 9 мм 2 стерильных покровное стекло) или в 8-хорошо стеклах камеры. Для ячеек дифференциации анализа выращивали в течение ночи до 50-60% слияние прежде чем они будут переданы в дифференциации разрешительной среды (см. раздел 4 в деталях пробирке метод) в течение 3 дней, до фиксации.
4. В пробирке Анализ скелетных мышц стволовых клеток и первичных культур
4.1. Подготовка клетки
- Dispase субкультивировали (см. раздел 3.3) первичных эмбриональных культур эксплантов высевают в среде PECM / условный на покровные стекла в 48-луночных планшетах при плотности 3 х 10 3 клеток / см 2 и позволило присоединить.
- Для оценки апоптоза и пролиферации покровных моют дважды в PBS, фиксировали в 4% параформальдегида (см. раздел 4.2) в PBS в течение 20 мин при комнатной температуре, а затем еще 10 мин PBS стирки.
- Покровные подготовлена таким образом можно хранить при температуре 4 ° С до 1 недели в ФСБ или PBS / глицин.
4.2. Подготовка Параформальдегид Fixative
- В вытяжной шкаф, весят 4 г параформальдегида (PFA, Sigma-Aldrich, Великобритания) и добавить в стеклянной бутылке 100 мл стерильной PBS с магнитной мешалкой. Маски и перчатки для защиты.
- В вытяжной шкаф, раствор нагревают и постоянно перемешивают на магнитной плите, пока порошок не растворится. Это занимает примерно 5-10 мин при температуре 65 ° C. Необходимо соблюдать осторожность, чтобы предотвратить повышение температуры выше 70 ° С, так как существует риск взрыва решение при высоких температурах.
4.3. Апоптоза и пролиферации Пробирной
- Исправлена покровные (полученного, как в разделе 4.1) окрашиваются по 10 мкг / мл DAPI в течение 3 мин.
- Покровные стекла моют раз в PBS (от 5 до 10 мин) и перевернутый на месте монтажа vectashield среды на стекло 17, 18.
- Края покровного запечатаны лака для ногтей (см. Примечание 12).
- Для хранения, слайды, завернутые в фольгу и помещают при 20 ° C.
- Для подсчета, слайды рассматриваются под флуоресценции (УФ-фильтр) на прямой микроскоп и забил за апоптоза и митотических клеток с использованием окуляра сетки. Двадцать случайно распределенных сетки подсчитывают (что составляет ~ 1000 клеток), и клетки морфологически характеризуются как не апоптоза, или апоптоза митотической (рис. 3 г).
- Митотический и апоптоза индексы рассчитываются как доля от общего числа клеток.
4.4. Иммуногистохимия
Клетки фиксируют на покровные также может быть использован для иммуногистохимии. Для антиген выборка с использованием покровные скороварки должны быть надежно закреплены на стеклах с использованием стандартных скрепок. Иммуноокрашивание может быть использован для идентификации пролиферирующих клеток, используя антитела к Ki67 (1 / 1, 000 разбавление), для установления личности, используя антитела к Myf-5 (1 / 1, 000 разбавление), или исследовать экспрессию генов (см.Раздел 4.5). Иммуноокрашивание можно достичь с помощью ряда методов, следующие (описано в (28, 29)) используется обычно по авторам:
- Буфера натрия цитрат подогревается в скороварке. Для поиска антигена, слайды содержащие секционного ткани помещаются в буфер нагревается и нагревается под давлением в течение 2 мин. Давление достигается твердо блокировки крышки скороварки и размещение на вес. После 2 мин поиска времени прошло скороварке, затем осторожно положил под проточной холодной водой, чтобы уменьшить давление. Для предотвращения буфера вскипания, следует проявлять осторожность, чтобы не снимать крышку, пока давление выравнивается с атмосферным давлением. Давление достаточно снижается, когда вес можно легко удалить (без силы) и снятой крышкой. Слайды затем удаляется из буфера и отмывали в PBS комнатной температуре в течение 10 мин.
- Слайды предварительно заблокированы путем погружения их в 3% перекиси водорода / водопроводной воде в течение 5 мин, а затем промывают три раза PBS + 0,05% Твин 20 (10 мин на мытье).
- Блокировка достигается за счет 30 мин инкубации в TNB блокирующего буфера (поставляется в комплекте TSA) при комнатной температуре.
- Первичные антитела разбавляют в буфере ТНБ для соответствующего разбавления (к которым пришел титрование, см. примечание 12) и инкубировали в течение ночи при температуре 4 ° С (или же от 1 до 2 часов при комнатной температуре).
- После трех 10 мин моется в PBS + 0,05% Твин-20, слайды инкубируют в течение 1 часа при комнатной температуре в соответствующие биотинилированного второго антитела разводят в TNB буфера.
- После еще трех 10 мин моется в PBS + 0,05% Твин-20, слайды инкубируют в течение 30 мин в стрептавидин-HRP (поставляется в комплекте TSA) разводят 1:100 TNB в буфере, а затем промывают три раза (10 минут каждый) в PBS + 0,05% Твин-20.
- Biotinyl tyramide (усиление реагента; TSA комплект) добавляется к каждому разделу на срок от 8 до 15 минут (точное время должны быть получены за счет оптимизации экспериментов).
- После усиления, мыть слайды в три раза (10 минут каждый) в PBS + 0,05% Твин-20, а затем выдержать в течение 30 мин в SA-HRP.
- После еще три моет (10 мин каждая) в PBS + 0,05% Твин-20, визуализировать использованием 3,3 _-диаминобензидина tetrahydrochloride хромогена (DAB) в течение 5 до 10 мин. Затем проводят два последних моет в воде перед counterstaining слайдов в гематоксилин-coverslipping. DAB является известным канцерогеном и следует обращаться с осторожностью (как и для Колхицин, раздел 3.2.2).
4.5. Дифференциация
- SMSC высевали на покровные стекла или камеру слайдов (см. Примечание 13) также могут быть дифференцированы до фиксации для myotube анализа.
- Для этих экспериментов клетки высевают при плотности 10 4 / см 2 и позволил приложить от 6 до 8 ч.
- Затем клетки перешли к дифференциации в разрешительной условиях в течение 3 дней (см. Примечание 14).
- Дифференциация среда состоит из DMEM + 0,5% FCS с добавлением 2% лошадиной сыворотки и 1% глютамина. Эта дифференциация разрешительной культуральной среде заменяется с интервалом 48 ч.
- Покровные затем фиксировали в 4% параформальдегида, что и выше (разделы 3.4.1 и 3.4.2).
4.6. Трансфекция SMSC: экспрессия трансгенов и shRNAi Создает
Стволовые клетки и первичные культуры поддаются трансфекции и с большинством методов трансфекции ставка в SMSC и первичных клеток скелетных мышц является очень низким (<10%), предотвращение использования переходных методов трансфекции. Чтобы преодолеть это было стандартной практикой в нашей лаборатории, чтобы изолировать клональной производные от трансгенов трансфицированных культурах (см. раздел 3.2.1) после трансфекции с фосфатом кальция или lipofectamine. Кроме клетки могут быть эффективно трансфицированных использованием заражения вирусно упакованных конструкций. Рис 1м показывает стабильные выражение β-галактозидазы в PD50A, клональной производных SMSC изолированных под G418 выбор после инфицирования pIRV, репликации дефектной ретровирус, несущих гены для neo/G418 сопротивление и β-галактозидазы (19). Эта клеточная линия была использована для формально показать, что SMSC ведут себя как функциональные стволовые клетки в естественных условиях (см. Рисунок 3.1). В то время как поколение стабильной клональной клеточной линии выражения маркерный ген, желательно в естественных условиях стволовые экспериментов клеточной трансплантации, это отнимает много времени и неудовлетворительное метод анализа функции гена в лабораторных условиях. По этим причинам авторы недавно разработали оптимизированные модификации Lipofectamine 2000 трансфекции реагент, способна передавать трансфекции ставки от 60 до 70%. Это позволяет проводить анализ функции гена использованием временной трансфекции трансгенов или RNAi конструкции в SMSc или первичных культур эксплантов (рис. 3 часа, я). Авторы используют короткие шпильки RNAi вектор (pSHAG RNAi) (30) для создания shRNAi конструкции способны генов конкретного нападения на экспрессию мРНК в SMSC. Успех техники shRNAi зависит от двух элементов: (а) эффективный метод трансфекции и (б) дизайн короткой последовательности шпильки, которое специфически распознает гена-мишени. ShRNAi построить направлены на EGFP может быть использована для проверки методом РНК-интерференции нокдаун (рис. 3j, т).
4.7. Оптимизированный LipofectamineTM 2000 Трансфекция Протокол SMSC
- Клетки помещали на 5 до 10 4 клеток / см 2 в камеру слайдов в 250 мкл DF10 питательной среды и культивировали в течение 18 ч до 95% слияния (оптимальное слияния для каждой клеточной линии была создана на основе оценки трансфекции ставки на разной плотности).
- Для каждой скважины, 0,5 мкг ДНК (shRNAi векторов, трансгены) добавляется 33 мкл бессывороточной DMEM с добавлением 2 мМ глутамина и смешанных мягко в стерильную пробирку Эппендорф.
- Для каждой скважины, 1,25 мкл Lipofectamine 2000 Отдельно разводят в дальнейшем 33 мкл бессывороточной среды DMEM + глютамин, осторожно перемешивают и сохранить при комнатной температуре в течение 5 мин
- ДНК и lipofectamine смеси затем быстро складываются, смешанные мягко в течение 60 с помощью пипетки, а затем выдерживают при комнатной температуре в течение 19 мин, чтобы ДНК Lipofectamine 2000 комплексов в форме.
- Для трансфекции, 66 мкл сложную смесь добавляется к каждой камере также и слайды мягко качались в течение 10 с для обеспечения равного распределения комплексов.
- Клетки инкубировали в течение 24 до 72 ч при 37 ° С и 5% СО 2. В зависимости от конструкции, функциональной экспрессии генов или shRNAi нокдаун первым обнаружил между 8 и 24 ч после трансфекции.
5. Представитель Результаты
Когда эксплантов тщательно эксплантированных от взрослых скелетных мышц или из эмбрионов эксплантов начнет генерировать клетки в течение нескольких часов до 72 часов инкубации при температуре 37 ° С (5% CO 2 / воздух) (рис. 3А). Время, необходимое для того чтобы это произошло, зависит от источника эксплантов: эмбриональные эксплантов перерастет быстрее, чем пожилого возраста скелетных мышц эксплантов. По нашему опыту сроки результатом очень воспроизводимые 3, 29. Расширение клеточной популяции будут происходить в течение периода от нескольких дней (эмбрион эксплантов) или недель (более старые скелетные мышцы эксплантов) для создания высокой плотности агрегирования SMS ячейки первичных культур (см. рис 3Б-F для иллюстрации этих культур). Рисунках 1 и 3 показать представителю результаты успешного вывода и культуры скелетных мышц и эмбриональных эксплантов, клональной вывод и в естественных условиях трансплантацию скелетных мышц производные взрослых стволовых клеток, β-галактозидазы маркировки, кариотипирование и myf-5 иммуногистохимии эмбриональных SMSC, чтобы иллюстрировать происхождение скелетных мышц . клеточных популяций На рисунке 3 показана представитель результате результатом скоринга (с использованием Myf-5 иммуногистохимии для визуализации SMSC); морфологии эмбриональных мышц первичных элементов; DAPI окрашивание на апоптоз и протокол shRNAi трансфекции. Более подробную информацию можно найти в подписи к рисункам, связанные с этими двумя цифрами. Рисунок 2 иллюстрирует процедуру, начиная с эмбриона микро-рассечение для генерации обогащенной популяции эмбриональных стволовых клеток скелетной мускулатуры.
Таблица 1: Расчет таблицы для оценки числа криопробирки необходимые для максимальной жизнеспособности клеток в процессе клеточного заморозить вниз протоколов
| Пластина / Колба / камера слайд | Объем культуры среда | PBS моет | Объем трипсина | Количество заморозить вниз флаконах (3.1.2) |
| 96-а | 50 мкл | 2 х 100 мкл | 25 мкл | N / A |
| 48-а | 150 мкл | 2 х 200 мкл | 50 мкл | N / A |
| 24-а | 500 мкл | 2 X 700 мкл | 200 мкл | N / A |
| 6-а | 3 мл | 2 х 3 мл | 500 мкл | 1 |
| Малый (25 см 2) | 10 мл | 2 х 10 мл | 1 мл | 2 |
| Средний (80 см 2) | 10 мл | 2 х 10 мл | 3 мл | 4 |
| Большой (175 см 2) | 10 мл | 2 х 10 мл | 5 мл | 8 |
| Палата также | 500 мкл | 2 х 500 мкл | 100 мкл | N / A |
N / A = не применяется; числа клеток были слишком низкими, чтобы заморозить вниз, если только несколько скважин были заморожены вместе.
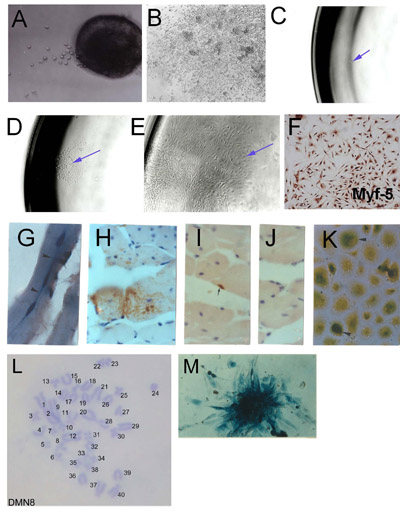
Рисунок 1. Выделение скелетных мышечных стволовых клеток (SMSC) от microexplants: () Раннее нарост из эксплантированных взрослых скелетных мышц (день 2) (B) Основанная эксплантов результат показывает агрегированных культур и высокой плотности клеток.. Клональный вывода SMSC. (С) одной клетки изолированных в 96 ячейках. (D) колонии единое происхождение клетки. (E) создана клональной населения. (F) Проверка SMSC идентификационные данные с помощью Myf-5 иммуногистохимии. Клетки, полученные из SMSC клон PD50A (выражая β-галактозидазы) в принимающих мышей через 3 месяца (G) и (HJ) 14 месяцев после инъекции 2000 PD50A клетки мыши в передней большеберцовой мышцы. (G) Три недавно плавленый (в центре города ядер ) β-галактозидазы-позитивные клетки (синие пятна) в мышечных волокон (продольное сечение). (Н) Обширный вклад β-галактозидазы-положительных клеток (коричневые пятна, обнаружены анти-β-галактозидазы антител) в мышечных волокнах (поперечное сечение ). (I), β-галактозидазы-положительных ячейки спутника (коричневые пятна, обнаружены анти-β-галактозидазы антител). (J) Вторичный контроль антител (без окрашивания). (К) β-галактозидазы-позитивные клетки (синие пятна) размножаться в культуре, когда изолированы от инъекции мышцы хост 12 месяцев после инъекции. (L) Кариотип мыши клональной линии SMSC (DMN8) с указанием нормальных диплоидных хромосом дополнение. (М) гистохимии показывает β-галактозидазы выражение в колонии клеток PD50A ( Рисунок 3.1 г, к, воспроизводятся с разрешения AACR прессы, Смит и Шофилд, 1997).
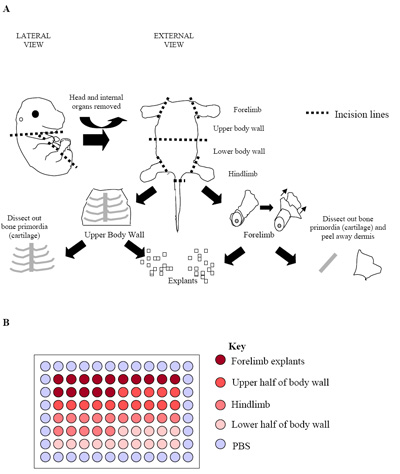
Рисунок 2. () Иллюстрация процесса рассечение эмбриона. Цифра E15.5 эмбриона, где кости первичного (хрящ), могут быть легко выявлены и расчлененных свободной от окружающих скелетной мышечной ткани. На данном этапе, и в более поздних эмбрионов этап (E15.5 E17.5), дерму также удалены, чтобы максимизировать долю скелетные мышечные клетки получены. (B) установки первичных культур эксплантов в 96-луночного планшета. Каждый эмбрион был использован для производства одной пластины, как показано выше. Обычная практика состоит в пластине повторяет из трех отдельных эмбрионов (три пластины = 180 скважин) создать продукт ставок.
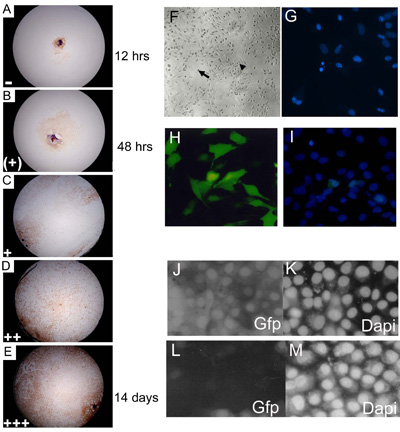
Рисунок 3. Эмбриональные первичных культур эксплантов были забиты на 3, 7, 14 и 21 дней культуры и назначен представителем результатом уровне слияния уровне. (AE) C57BL10 E15.5 первичных эмбриональных культур эксплантов окрашивали Myf-5 для иллюстрации 0 14% (); 15 24% (+), 25 49% (+), 50 74% (++); 75 100% ( + + +) уровни слияния. Доля скважин показывает каждом уровне нарост (на каждый день забил) умножалась на произвольное число (= 1, (+) = 2, + = 3; + + = 4 и + + + = 5) до сведения воедино данных , чтобы дать окончательное значение нарост. Примерно 85% от дикого типа (C57BL/10) первичный eSMSc пятно для скелетных маркер мышечных клеток Myf-5. Увеличение на 10. (F) Основанная эмбриональных культур морфологические характеристики взрослого SMSC, биполярные клетки (стрелка) и сферической мономорфных клеток (большая стрелка). (G) Определение апоптоза фрагментация ядер с использованием DAPI окрашивания. (HI) Высокий уровень (~ 75%) трансфекции GFP-экспрессирующих построить в SMS-клеточных линиях использованием оптимизированных Lipofectamine 2000 трансфекции методом. (I) Подсчет общего числа клеток оказывается помощь DAPI контрастирующая. RNAi использованием pSHAGshRNAigfp (JM) отменяет GFP выражение в SMSC (см. (29) для примера эта конструкция используется в качестве контроля). (J) Управление (макет трансфекции), показывающие GFP выражение в линии GFP SMSC. (К) DAPI контроль . (L) shRNAiGfp 24 ч после трансфекции. (М) DAPI управления shRNAiGfp трансфекции клеток (L).
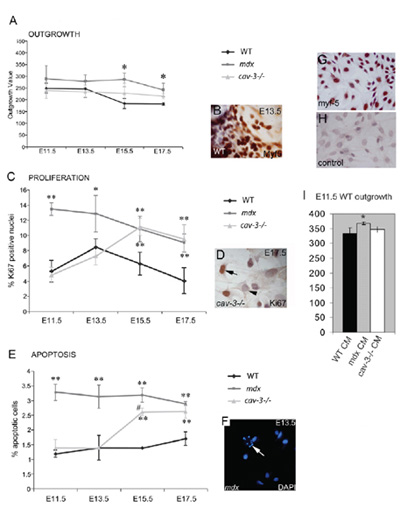
Рисунок 4. Дистрофические, эмбриональные Myf5-положительных миобластов являются гиперпролиферативных и склонны к апоптозу. (А) нарост скорость эмбриональных миобластов из мышц культуры эксплантов яы увеличился как в MDX мутантов E11.5 и в CAV-3 (-/-) мутантов на E15.5 и E17.5 по сравнению с WT эксплантаты культивировали в параллель. (B) Myf5-immunostained эксплантов. (С) гиперпролиферацию эмбриональных миобластов в MDX мутантов E11.5 и в CAV-3 (-/-) мутантов E15.5, как это определено Ki67-положительных иммунореактивности (D). (Е) Повышенный апоптоз от E11.5 в эмбрионах MDX и от E15.5 в CAV-3 эмбрионов (-/-), как показал DAPI окрашивания (F), стрелка в F указывает на апоптоза клеток. * Р <0,05 по сравнению с WT; ** р <0,01 по сравнению с WT; * р <0,05 при сравнении с MDX CAV-3 (-/-) (G, H) E15.5 первичной культурной WT эмбриональных миобластов с Myf5 окрашивания. (G) и второй элемент управления антител (Н). (I) нарост скорость E11.5 эксплантов WT увеличился (* р <0,05) E11.5 MDX эксплантов-кондиционированной среды (СМ), но не в CAV-3 (-/-) или WT CM. Планок погрешностей указывают SD Эта цифра приводится в авторском авторов и был впервые опубликован компанией Биологи в Меррик и соавт., 2009.
6. Примечания: основные меры и возможные модификации
- Когда талой клетки придают при очень низкой плотности клеток целесообразно заменить только половину среды, чтобы предотвратить крах культуры.
- SMSC изолированы от дистрофических мышц восприимчивы к апоптозу, лечение должно проводиться с особой осторожностью. Дистрофические SMSC (например, DFD-13 клеточной линии, которая была создана из скелетных мышц получена из 5-недельных дистрофические (MDX) мышей) должны быть выращены на более высоких плотностей клетка, чем обычно для миобластов. Такие апоптоз чувствительных клеточных линий также криоконсервированных при более высокой плотности (см. разделы 1.1 и 1.2), (19).
- Альтернативный метод удаления клетки монослоя использует dispase, который обеспечивает мягкий метод клеточной диссоциации, с тем преимуществом, что она может быть проведена в присутствии ФТС и кальция (оба присутствуют в DF10). Dispase поэтому могут быть использованы для субкультуры и расширение основной скелетной мышцы эксплантов культур и earlystage SMSC клоны (см. разделы 2 и 3).
- Для больших колбах количество трипсин / ЭДТА использоваться, должны быть увеличены следующим образом: 75 мм 2 колбы (3 мл трипсина) и 175 мм 2 колбы (5 мл трипсина). Аналогично для небольших участков поверхности уменьшить количество трипсина используется (см. Таблицу 1).
- Кроме того, диссоциации можно контролировать с помощью инвертированного микроскопа, это рекомендуется для новичков.
- Криоконсервация клеточных линий, как правило, осуществляется с помощью сливной большой (175 мм 2) пластиковый сосуд. Между 7 и 9 криопробирки могут быть получены из одного такого большого судна, в зависимости от профиля выживания клеточной линии будучи криоконсервированных. Первичные культуры и вновь созданных клеточных линий, часто очень тугоплавкий, чтобы заморозить до процедуры. Для улучшения восстановления и успех замораживания вниз таких клеток два подхода могут быть использованы (по отдельности или в комбинации). (А) содержание ФТС заморозить вниз смесь может быть увеличена с 10% (максимум до 50%). (Б) заморозить вниз процесс можно замедлить путем размещения криопробирки в газовой фазе N2 в течение 12-24 ч до передачи флаконов в жидкой фазе.
- Удобный способ проверить фирму крепления haemacytometer покровное является поиск Кольца Ньютона (радуга отражения в стекле) на покровное или, наоборот, провести haemacytometer вверх ногами над открытой ладонью.
- Изменение эксплантов метод может быть использован для краткосрочного культур для использования в иммуногистохимии, распространение или апоптоз анализов. Микродиссекции эксплантов размещены на стекле с использованием 8-и слайды камеры. Альтернативным методом является использование 9 мм 2 покровные помещены в 24-луночных планшетах. В обоих случаях два эксплантов передаются в каждую лунку в 150 мкл среды DF20. Кроме того, первичные культуры может быть субкультивировали по dispase метод и покрытием выходят на покровные стекла помещены в 24-луночных планшетах или непосредственно в 8-и слайды камеры.
- Для количественного анализа результатом ставки минимум 60 скважин, содержащих 1 эксплантов на лунку установлены, на мышечную / мышь напряжения. Чтобы установить параметры роста на напряжение не менее трех отдельных животных, должны быть использованы. Плиты и отдельных скважин, не кормили в то время как результат в настоящее время забил.
- Для клонирования создана SMSC линии, достаточно одной культуре клеток в 1:01 сочетание условных средних и DF10 среды. Для первичных эксплантов необходимо увеличить содержание сыворотки культуральной среде до 20%.
- Колхицин является высокотоксичным и известное канцерогенное вещество, должны быть обработаны с адекватной медицинской помощи. Применение двойных перчаток и работающих в пределах назначенного лоток имеет важное значение. Все одноразовые (т.е. Gilsonсоветы) помещают в стакан хлорной извести (5% гипохлорита натрия) в течение ночи до удаления с большим количеством воды Фолло крыла день.
- Мы в настоящее время используют первичные антитела, специфичные к Ki67 и Myf-5 на каждую 1 / 1, 000 разбавления. Оптимальные для разведения первичных антител должна быть установлена эмпирически для каждого антитела, которые будут использоваться и идеально также для различных партий одного и того же антитела, даже тогда, когда получены из того же источника.
- Палата слайдов можно также использовать для этого анализа. Перед установкой клеток в 4% PFA, культуральная среда удаляется, а клетки дважды промывали 37 ◦ C стерильной PBS. Также камер, прокладка и клея удаляются и стеклах помещены в 50 мл стеклянный сосуд, содержащий Коплин свежеприготовленный 4% параформальдегида при комнатной температуре, которая затем плавно покачивался на Гиро-рокер шейкер R_ в течение 25 мин. Слайды затем дважды промывают PBS (комнатной температуры) и либо использовать сразу или хранить в PBS на 4 ◦ С (кратковременно; 1-2 недели) для иммуногистохимического (IHC) анализ.
- Если более широкие myotube образование требуется первичных клеток скелетных мышц могут быть дифференцированы на срок до 8 дней.
Обсуждение
Микродиссекции культурами эксплантов может быть использован для надежно и воспроизводимо изолировать популяции клеток, содержащих очень высокая доля (~ 85%) пролиферативной Myf-5 положительных скелетные мышцы стволовые клетки (SMSC). В строго контролируемых условиях культуры, описанные здесь первичных культур эксплантов может быть использован для характеристики роста поведения генетически мутантных мышей SMSC и может быть использован в качестве средства получения myotubes для подробного анализа в пробирке дифференциации процессов. Тщательный уход и обработку этих культур позволяет долгосрочных культуры и расширения. Используя методы, описанные здесь также можно получить клональной скелетных мышц линий стволовых клеток из эксплантов культур с помощью одного разведения клеток. Для достижения распространения изолированных одиночных клеток во время клонирования ", кондиционированной среды" используется, чтобы имитировать нормальное требование этих клеток с высокой плотностью культуры. Метод применим (с изменениями) в эмбриональных, взрослых и пожилых и взрослых тканях и в дополнение к мыши может быть использован для выделения клеток из скелетных мышц других видов, включая человека (Рао и Смит, не опубликовано), куриного эмбриона и рыбы ( лосось) 24. Клонально производные SMSC могут быть проанализированы в естественных условиях в виде внутримышечных трансплантации и в этих условиях вводили SMSC будет сочетаться с принимающими myotubes образованием гибридных мышечных волокон. Внутримышечно вводят SMSC не образуют опухолей и были найдены в принимающих мышцы спутниковой позиции ячейки более чем через год после инъекции, предполагая, что они могут быть эндогенными контроля сателлитных клеток стволовых клеток niche.These может быть повторно изолирован от инъекции хосты как пролиферативная SMSC более чем через 12 месяцев после инъекции хост 19.
Раскрытие информации
Благодарности
Мы благодарим Патрика Паддисон за его дар вектор трансфер shRNAi. Ангела Sloan создания образа GFP RNAi на рисунке 3. Мы также благодарим следующие организации финансирования для их поддержки:
Мышечной дистрофии кампании номер гранта RA2/592/2; SPARKS номер гранта 02BHM04, Королевского общества номер гранта 574006.G503/1948./JE и СИББН номер гранта 6/SAG10077.
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM/F12 1:1 mix | Sigma-Aldrich | Liquid medium: (Dulbecco’s Modified Eagles’s medium and Ham’s F12 medium, 1:1 v/v) | |
| 100× Glutamine (200mM) | Sigma-Aldrich | Diluted in medium to a 1× concentration of 2 mM (Glutamine HYBRI-MAX R) | |
| Fetal calf serum (FCS) | From a number of different companies | Batch tested on primary cultures and skeletal muscle cell lines. 10-20% supplement to liquid media | |
| Heraeus Labofuge 300 | Heraeus Instruments | Lab centrifuge capable of reaching 1,000 rpm | |
| 15 ml Falcon centrifuge tubes | Fisher Scientific | Must fit lab centrifuge | |
| Tissue culture plasticware (25, 75 or 175 mm2 tissue culture vessels; 96-well tissue culture plates. 60 mm Petri dishes). | Nalge Nunc international | ||
| Humidified CO2 incubator (Heraeus) | Heraeus Instruments | Ours is copper lined, recommended for reducing contamination | |
| Sterile hood with laminar air flow (Heraeus) | Heraeus Instruments | Ours is a Class II hood – suitable for use with Human tissues | |
| Water Bath | Grant Equipment | Maintained always at 37°C | |
| Inverted microscope | Leica Microsystems | ||
| 70% Ethanol | For sterilization (animals, dissection instruments) and swabbing benches, hood, etc. | ||
| Calcium- and magnesium-free phosphate-buffered saline (PBS) | Sigma-Aldrich | Cell culture-tested PBS (Dulbecco’s formula) is purchased as a ready-mixed powder or in tablet form and made up with doubledistilled water before sterilization by autoclave. PBS consists of 2.68 mM potassium chloride (KCl); 1.47 mM potassium phosphate monobasic (KH2PO4); 0.137 M sodium chloride (NaCl); and 8.1 mM sodium phosphatedibasic (Na2HPO4). PBS can be prepared from scratch as follows: 200 mg KCl, 200 mg KH2PO4, 8 g NaCl and 1.15 g Na2HPO4/l of double-distilled water followed bysterilization by autoclave. | |
| CryoTube vials | Nalge Nunc international | ||
| A Neubauer haematocytometer and coverslips | Fisher Scientific | For estimating cell counting | |
| Hand counter | Fisher Scientific | ||
| Dissection microscope, Zeiss Stemi 1000 | Carl Zeiss, Inc. | For preparation of explants | |
| Small sterile hood | |||
| Sterile dissection instruments (including Jeweler’s forceps) | Sterilised by autoclave | ||
| Sterile plastic collecting vessels (7 ml bijou tubes or 20ml universals) | Nalge Nunc international | ||
| Warm PECM | Sigma-Aldrich | Made up in the sterile hood and warmed to 37°C in the tissue culture waterbath. DMEM:F-12 supplemented with 20% FCS, 1% glutamine and + 1% penicillin & streptomycin solution | |
| Dispase (50 μg/ml, equivalent to 6 units/mg) | Available from MP Biomedicals, UK | ||
| 10 μg/ml 4_,6 Diamidino-2-phenylindole, dihydrochloride (DAPI). | Sigma-Aldrich | For microscopic visualization of apoptosis and mitosis | |
| Vectashield fluorescent mounting fluid | Vector Laboratories | ||
| Fluorescent upright microscope with ultraviolet filter (we use a Nikon Eclipse E600) | Nikon Instruments | ||
| Digital camera and imaging software (we use a Nikon Coolpix 995 camera; A Nikon D3 camera | Nikon Instruments | ||
| OpenLab4.0a software | PerkinElmer, Inc. | ||
| Photoshop CS4 | Adobe |
Ссылки
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270, 725-727 (1997).
- Askanas, V., Engel, W. K. A new program for investigating adult human skeletal muscle grown aneurally in tissue culture. Neurology. 25, 58-67 (1975).
- Smith, J., Schofield, P. N. The effects of fibroblast growth factors in long term primary culture of dystrophic (mdx) mouse muscle myoblasts. Exp Cell Res. 210, 86-93 (1994).
- Fell, H. The cell in culture. J Clin Pathol. 11, 489-495 (1958).
- Stewart, D. C., Kirk, P. L. The simultaneous measurement of several parameters of embryo heart explants growth in vitro. J Cell Physiol. 40, 183-198 (1952).
- Harvey, A. L., Robertson, J. G., Witkowski, J. A. Maturation of human skeletal muscle fibres in explant tissue culture. J Neurol Sci. 41, 115-122 (1979).
- Zammit, P. S., Heslop, L., Hudon, V., Rosenblatt, J. D., Tajbakhsh, S., Buckingham, M. E., Beauchamp, J. R., Partridge, T. A. Kinetics of myoblast proliferation show that resident satellite cells are competent to fully regenerate skeletal muscle fibers. Exp Cell Res. 281, 39-49 (2002).
- Konigsberg, I. . The embryonic origin of muscle. , (1986).
- Trainor, P. A., Tan, S. S., Tam, P. P. Cranial paraxial mesoderm: regionalization of cell fate and impact on craniofacial development in mouse embryos. Development. 120, 2397-2408 (1994).
- Tajbakhsh, S., Rocancourt, D., Cossu, G., Buckingham, M. Redefining the genetic hierarchies controlling skeletal myogenesis Pax-3 and Myf-5 act upstream of MyoD. Cell. 89, 127-138 (1997).
- Tremblay, P., Dietrich, S., Mericskay, M., Schubert, F. R., Li, Z., Paulin, D. A crucial role for Pax3 in the development of the hypaxial musculature and the longrange migration of muscle precursors. Dev Biol. 203, 49-61 (1998).
- Tajbakhsh, S., Bober, E., Babinet, C., Pournin, S., Arnold, H., Buckingham, M. Gene targeting the myf-5 locus with nlacZ reveals expression of this myogenic factor in mature skeletal muscle fibres as well as early embryonic muscle. Dev Dyn. 206, 291-300 (1996).
- Tam, P. P. A study of the pattern of prospective somites in the presomitic mesoderm of mouse embryos. J Embryol Exp Morphol. 92, 269-285 (1986).
- Cossu, G., Kelly, R., Donna, S. D. i., Vivarelli, E., Buckingham, M. Myoblast differentiation during mammalian somitogenesis is dependent upon a community effect. Proc Natl Acad Sci USA. 92, 2254-2258 (1995).
- Shainberg, A., Yagil, G., Yaffe, D. Control of myogenesis in vitro by Ca2+ concentration in nutritional medium. Exp Cell Res. 58, 163-167 (1969).
- Dodson, M. V., Martin, E. L., Brannon, M. A., Mathison, B. A., McFarland, D. C. Optimization of bovine satellite cell-derived myotube formation in vitro. Tissue Cell. 19, 159-166 (1987).
- Smith, J. Muscle Growth factors, ubiquitin and apoptosis in dystrophic muscle: Apoptosis declines with age in the mdx mouse. B Appl Myol. 6, 279-284 (1996).
- Smith, J., Fowke, G., Schofield, P. Programmed cell death in dystrophic (mdx) muscle is inhibited by IGF-II. Cell Death Differ. 2, 243-251 (1995).
- Smith, J., Schofield, P. N. Stable integration of an mdx skeletal muscle cell line into dystrophic (mdx) skeletal muscle: evidence for stem cell status. Cell Growth Differ. 8, 927-934 (1997).
- O Shea, L., Johnson, C., Rooney, M., Gleeson, R., Woods, K., Smith, J. Adipogenesis and skeletal muscle ageing. Mech Ageing Dev. 122, 1354-1355 (2001).
- Merrick, D. . A role for Igf-2 in fast skeletal muscle specification during myogenesis in dystrophic and wild type embryos [dissertation]. , (2006).
- Stadler, L. K. J., Merrick, D., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Abstr. Genet.Res. 90, 281-289 (2008).
- Merrick, D., Stadler, L. K. J., Larner, D. P., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Dis Model Mech. 2, 374-388 (2009).
- Matschak, T., Stickland, N. C., Smith, J. Explants of embryonic Atlantic salmon muscle in culture. Proc Soc Exp Biol A. 1, 23-23 (1997).
- Smith, J., Hooper, M. L. Dominance and independent segregation of metabolic cooperation competence and pluripotency in an embryonal carcinoma cell hybrid. Exp Cell Res. 181, 40-50 (1989).
- Bulfield, G., Siller, W. G., Wight, P. A., Moore, K. J. X chromosome linked muscular dystrophy (mdx) in the mouse. Proc Natl Acad Sci USA. 81, 1189-1192 (1984).
- Hagiwara, Y., Sasaoka, T., Araishi, K., Imamura, M., Yorifuji, H., Nonaka, I., Ozawa, E., Kikuchi, T. Caveolin-3 deficiency causes muscle degeneration in mice. Hum Mol Genet. 9, 3047-3054 (2000).
- Westbury, J., Watkins, M., Ferguson-Smith, A. C., Smith, J. Dynamic temporal and spatial regulation of the cdk inhibitor p57 (kip2) during embryo morphogenesis. Mech Dev. 109, 83-89 (2001).
- Merrick, D., Ting, T., Stadler, L. K. J., Smith, J. A role for Insulin-like growth factor 2 in specification of the fast skeletal muscle fibre. BMC Dev Biol. 7, 65-65 (2007).
- Paddison, P. J., Caudy, A. A., Hannon, G. J. Stable suppression of gene expression by RNAi in mammalian cells AQ4. Proc Natl Acad Sci USA. 99, 1443-1448 (2002).
- Smith, J., Merrick, D. Skeletal Muscle Microexplant Culture and Isolation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 633, (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены