Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Генерация рекомбинантного вируса гриппа от ДНК плазмиды
В этой статье
Резюме
Спасение вирусов гриппа А из плазмиды ДНК является одним из основных и существенных экспериментальная методика, которая позволяет исследователям гриппа для создания рекомбинантных вирусов изучить несколько аспектов биологии вирусов гриппа, а также для использования в качестве потенциальных векторов или вакцин.
Аннотация
Усилия число групп гриппа исследования сыграли ключевую роль в развитии и совершенствовании гриппа генетики вируса наоборот. Первоначально создана в 1999 году
протокол
1. Вирус гриппа спасательных трансфекции
Грипп вирус принадлежит к семейству Orthomyxoviridae отрицательных РНК вирусов с оболочкой. Гриппа, геном вируса состоит из восьми различных генов РНК отрицательной полярности, которые кодируют, по крайней мере, 11 вирусных белков (рис. 1) 4. Мы сосредоточимся, в настоящем докладе, на спасение одного из наиболее распространенных лабораторного штамма, A/PR/8/34 гриппа, 5, используя ambisense плазмид (PDZ), содержащий 8 грипп A/PR/8/34 вирусных сегментов ( Рисунок 2).
Для спасения рекомбинантных вирусов гриппа с плазмидной ДНК, мы рекомендуем 3 независимых трансфекции за каждый рекомбинантный вирус. Если более чем один рекомбинантный вирус спасения пытались, масштаб соответственно для следующих шагов, чтобы количество вирусов, чтобы их спасли. После трансфекции и инфекции Протокол составлен для 6-а-пластин. Схематическое изображение протокол показано на рисунке 3.
- OptiMEM-Lipofectamine 2000 (LPF2000) смеси: Подготовьте 250 мкл СМИ OptiMEM и 6-8 мкл LPF2000 в трансфекции. Инкубируйте в течение 5-10 минут при комнатной температуре (RT). Между тем, готовят смесь плазмиды трансфекции.
- Плазмиды смесь трансфекции: Подготовка плазмиды коктейль трансфекции в 50 мкл СМИ OptiMEM. Мы обычно используем 1 мкг каждого гриппа ДНК плазмиды на спасение. Добавить 1 мкл PDZ плазмиды (на 1 мкг / мкл) PB2, PB1, PA, HA, NP, NA, M и NS в пробирку, содержащую 50 мкл СМИ OptiMEM.
- OptiMEM-LPF2000 ДНК-плазмиды смеси: Добавить 250 мкл с шагом 1,1 в ДНК плазмиды гриппа смесь трансфекции (шаг 1.2). Выдержите эту смесь в течение 20-30 минут при комнатной температуре. Между тем, готовят суспензии 293T и MDCK клеток для трансфекции.
- Подготовка 293T/MDCK совместно культуры: Прежде чем начать, довести PBS 1X, DMEM 10% FBS 1% PS средства массовой информации, и ЭДТА-трипсина смеси до 37 ° C. Плотность клетки должны быть на 80-90% слияния день трансфекции. Как правило, один сливной 100 мм блюдо 293T и один сливной 100 мм блюдо MDCK клетки могут быть использованы в течение 10-12 спасает. Мы собираемся использовать 250 мкл клеток на лунку. Обе клеточные линии будет ресуспендировали в общей сложности 3 мл DMEM 10% FBS 1% PS.
- Тщательно ресуспендирования каждой клеточной линии в 10 мл DMEM 10% FBS 1% PS в 15 мл центрифужную пробирку. У вас будет одна трубка для 293T клетки и одна трубка для MDCK клеток.
- Ресуспендируют 293T клетки в 3 мл DMEM 10% FBS 1% PS и когда ресуспендировали, доставить 3 мл до MDCK клетки ресуспендируют этих клеток. Это даст вам смесь 293T и MDCK клетках, которые будут использоваться для ваших коллег-культуры.
- Добавить 250 мкл 293T/MDCK клеток на лунку (10-12 6-и скважин).
- Через 20-30 минут РТ инкубации (шаг 1.3), добавить 1 мл DMEM 10% FBS 1% PS к OptiMEM-LPF2000 гриппа ДНК плазмиды смеси.
- Добавить 1,3 мл (шаг 1.5) в скважинах с 250 мкл 293T/MDCK клетки (шаг 1.4).
- Осторожно встряхните 6-хорошо тарелку и потом трансфекции инкубировать в течение ночи (ON) в инкубаторе при температуре 37 ° С и 5% СО 2.
- На следующий день, около 16-24 часов после трансфекции, изменение трансфекции СМИ и инкубировать трансфекции клеток в DMEM 0,3% BA 1% PS, содержащей 1 мкг / мл TPCK-трипсина в течение 48 часов.
- После 48 часов смены СМИ, передача супернатант из трансфекции клеток в микроцентрифужных трубки.
- Центрифуга супернатант культуры тканей в микроцентрифужных в течение 1-2 минут, 13000 оборотов в минуту.
- Infect свежие MDCK клеток в 6-луночных планшетах (покрытие накануне) или 10-дневных куриных эмбрионах с 200 мкл центрифугировали культуре ткани супернатантах с шага 1.10. Инкубируйте клетки и / или яиц при температуре 37 ° С в течение 2-3 дней.
- Инфекция из 10-дневных куриных эмбрионах: Все процедуры для заражения куриных эмбрионах осуществляется в стерильных условиях.
- Свеча 10-дневных яйца использованием световых просвечивание окно, чтобы увидеть интерфейс между воздушного мешка и аллантоисной полости. Сделайте карандашом метку на интерфейс границы.
- С 5 иглу шприца мл сделать отверстие в скорлупе.
- С 1 мл шприц, заражают каждое яйцо с 200 мкл тканевой культуры супернатантов с пункта 1.10.
- Закройте отверстие в скорлупе растопленным воском с помощью ватного тампона.
- Инкубируйте инфицированных яйцами 37οC течение 2-3 дней.
- Инфекция свежих MDCK клеток: за день до прохождения супернатант культуры тканей от 293T/MDCK совместно культур, предварительноПаре 6-луночный планшет блюда с MDCK клетках достичь 80-90% слияния следующий день. Как правило, сливающийся 100 мм культуре ткани пластина может быть разделена на 6-8 скважин. Вымойте клеток, в два раза, с PBS 1X, trypsinize и подготовить 6-луночных планшетах. Осторожно встряхните руками пластин, чтобы иметь форме распределения клеток. Культуры клеток, ON, в 37 ° С инкубатор, 5% СО 2. Перед инфекции, проверить клетки под микроскопом, чтобы подтвердить монослоя, а затем, приступить к инфекции:
- Вымойте клеток, в два раза, с 1 мл PBS 1X.
- Infect с 200 мкл центрифугировали супернатантах культуры ткани в течение 1 часа при комнатной температуре. Не позволяйте клетки сухой. Рок 6-а-пластин каждые 10 минут.
- Через 1 час вирусного поглощения, удалить вирус из средств массовой информации MDCK клеток и добавить 2 мл DMEM 0,3% BA 1% PS, содержащей 1 мкг / мл TPCK-трипсин.
- В 48-72 часов после прохода, в зависимости от эффективности трансфекции и вирусной нагрузки, цитопатический эффект (ЦПЭ) будет наблюдаться в MDCK инфицированных клеток. CPE предполагает успешное спасение. Тем не менее, анализ HA (раздел 2) все равно должны быть выполнены, чтобы подтвердить наличие вируса в супернатантах культуры тканей.
- Инфекция из 10-дневных куриных эмбрионах: Все процедуры для заражения куриных эмбрионах осуществляется в стерильных условиях.
- Урожай аллантоисной жидкости зараженных куриных эмбрионах: Все процедуры для сбора аллантоисной жидкости из зараженных яиц производится в стерильных условиях. Примерно 8-12 мл аллантоисной жидкости можно получить из каждого 10-дневного возраста-инфицированные яйца. До уборки аллантоисной жидкости, инкубировать куриные яйца в течение 2 часов (или на) при 4 ° С, чтобы убить куриного эмбриона и коагуляции крови.
- Вымойте яичной скорлупы с 70% этанола создать стерильные условия.
- Открытое яйцо, тщательно, более воздушная полость, нажав ложкой. Удалить сломанный яичной скорлупы с помощью щипцов.
- С 1 мл иглой, удалить аллантоисную мембраны, не нарушая желток яйца.
- Стабилизировать куриного эмбриона с помощью шпателя, как Вы ведете 10 мл пипетки в аллантоисной жидкости. Собрать аллантоисной жидкости насколько возможно в 15 мл центрифужную пробирку на льду в ведерке со льдом, не нарушая или сбор любых желтка яйца. Используйте 15 мл центрифужную пробирку для каждого яйца.
- Центрифуга течение 5 минут при 4 ° С и передачи аллантоисной жидкости (без учета гранулированный красных кровяных телец) в свежем 15 мл пробирок центрифуги.
- Хранить пробирки центрифугировали аллантоисной жидкости при температуре 4 ° С, пока они не проверяются на наличие вируса с спасли гемагглютинации (ГА) анализа.
2. HA анализ, чтобы подтвердить спасательных рекомбинантных вирусов гриппа
Гемагглютинации анализа (ГК) широко используется для обнаружения присутствия спасенных вируса в культуре ткани MDCK супернатанты и / или аллантоисной жидкости заготовленной яйца. Кроме того, тесты иммунофлюоресценции (РИФ) может быть также выполнена. После анализа выявляет наличие спас вирус, вирус должен быть доска очищается и генетический состав вирусов будет подтверждено RT-PCR и секвенирования.
Наличие вируса в культуре ткани MDCK супернатанты и / или в аллантоисной жидкости из зараженных яиц можно определить макроскопически использованием HA куриного (или другого источника) красных кровяных телец (эритроцитов). Наличие вируса вызывает гемагглютинации РБК в то время как отсутствие вируса допускает образование красных гранул в нижней части скважины (рис. 4). В случае вируса гриппа, считается, что примерно в 10 3 -10 4 бляшкообразующих единиц (БОЕ), которые необходимы для положительного сигнала в анализе HA, поэтому IFA может осуществляться параллельно с анализа HA, чтобы подтвердить истинно отрицательный результат. IFA с первичной защиты от гриппа антител более чувствителен, чем HA анализа, потому что меньше, чем 103-104 вирусы могут быть обнаружены с помощью этой техники. Вполне возможно, чем супернатанты или аллантоисной жидкости, которые HA-отрицательных положительно на IFA. В этом случае вирус должен быть усилен пассажи, опять же, в MDCK клетках или в яйца. Аллантоисной жидкости и / или тканевых культур супернатанты из второй проход должен теперь быть четко положительный анализ HA.
HA анализы проводятся в V-дно 96-луночных планшетах. Отрицательные (например, PBS 1X) и положительных (тканевая культура супернатанты и / или аллантоисной жидкости из инфицирования вирусом гриппа) контрольных образцов должны всегда быть включен в любой анализ HA утвердить ее.
- Внесите 50 мкл PBS 1X в каждую лунку V-дно 96-луночного планшета.
- Добавить 50 мклMDCK тканевая культура супернатанты и / или аллантоисной жидкости из инфицированных яиц первой скважины, а сделать 2-кратный серийных разведений для следующих скважин. Отменить дополнительные 50 мкл от последнего хорошо.
- Добавить 50 мкл 0,5% -1,0% куриных эритроцитов (подготовлен в PBS 1X) в каждую лунку.
- Инкубируйте V-дно 96-луночного планшета в течение 30-45 минут (до красной точки отображаются в нижней части отрицательного контрольного образца PBS), на льду. Читайте и interpretate результатов, как указано на рисунке 4.
3. Прохождение супернатанты тканевых культур
Отрицательный результат анализа HA может быть результатом низкой эффективности трансфекции с низким уровнем вируса присутствует в культуре ткани супернатанты и / или аллантоисной жидкости. Прохождение этих образцов в пресной MDCK и / или куриных эмбрионов позволит усиление вируса (как показано на рисунке 3) инфекции проводятся, как описано выше в разделе 1.11.2.
4. Представитель Результаты
Успешное спасение вируса гриппа будет подтверждено наличие положительного анализа HA (рис. 4). Кроме того, существование CPE в клетках, инфицированных супернатантах культуры тканей или с аллантоисной жидкости из яиц предложит положительные вирусные спасения.
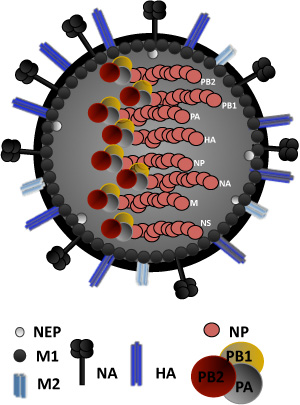
Рисунок 1. Вирус гриппа структуру: Вирус гриппа окружена двойной липидный слой, содержащий два вирусные гликопротеины (HA, NA) и, кроме того, белка ионного канала М2. ГК вирусный белок привязанности, ответственные за связывание с сиаловой кислотой содержащих рецепторы. Н. А. отвечает за вирусной освобождения из клетки хозяина. Под липидный бислой, является белком слой, состоящий из внутренней поверхности конверта матрица белка 1, M1, который играет роль в вириона собраний и бутонизации и экспорт ядерных белков (НЭП), необходимого для ядерного экспорта вирусных ribonucleocapsids. Ядро вируса состоит из рибонуклеопротеидных (RNP) комплекс, состоящий из 8 одноцепочечных РНК отрицательный вирусных генов encapsidated от вирусных нуклеопротеидов, NP. Связанный с комплексом RNP являются вирусные РНК-зависимой РНК-полимеразы подразделения П.А., PB1 и PB2. Неструктурных белков NS1 и PB1-F2, кодируемых РНК сегменты NS и PB1, соответственно, не являются частью вириона структуры.
Рисунок 2. Грипп плазмид вирус спасению: восемь генов вируса гриппа клонировали в плазмиду ambisense PDZ указаны. PDZ плазмиды 6, полученных от экспрессии белка плазмиды pCAGGs 7, является двунаправленным плазмиды вектор с человека РНК-полимеразы I промоутер и последовательность мыши терминатора, который кодирует РНК-геномный отрицательный смысл, а в противоположной ориентации на полимеразной Я объединиться, полимераза II транскрипции кассеты (курица β-актин промотора и полиА) кодирует вирусные белки из того же вирусного гена. кДНК из каждого вирусного сегмента генерируются RT-PCR с прямого и обратного праймеров содержащие эндонуклеазы SAPI сайт рестрикции и некодирующих областей каждого сегмента (черные ящики в конце вирусных генов). ПЦР продукт клонировали в PDZ переваривают Сап-I.
Рисунок 3. Восемь-плазмиды основе гриппа спасательная система: PDZ плазмид, содержащих 8 грипп вирусные гены являются со-трансфекции, в суспензии, в 293T-MDCK клетках совместно культур (день 1). Двадцать четыре часа после трансфекции, средств массовой информации, не содержащей FBS но TPCK / трипсин заменяется (день 2). Сорок восемь часов после изменения информации, супернатант культуры ткани собирается и используется для заражения MDCK или 10-дневных эмбрионов куриных яиц (день 4). 48-72 часов после усиления, культуры тканей супернатанты из инфицированных клеток MDCK или аллантоисной жидкости из яйца собирали и анализировали на наличие вируса, HA (день 6). Если ни один вирус не обнаружен, то же супернатанты и / или аллантоисной жидкости могут быть вновь пассировать на свежий MDCK клеток и / или куриных эмбрионов.
Рисунок 4. Гемагглютинина анализа (HA): гемагглютинации РБК от вирусной частицы видна макроскопически и является основой для выявления вирусных частиц в культуре ткани супернатанты и / или аллантоисной жидкости. Хотя анализ HA не делает различий между вирусной частицы, которые являются инфекционные и частиц, которые разлагаются и уже не способен инфицировать клетки, анализ является хорошим индикатором наличия вируса в образцах. А) отсутствие (вверху) присутствия (внизу) вируса в биологических образцах определяется наличием РБК в нижней части пластины или их отсутствие, соответственноectively. Б) представитель результате анализа HA без каких-либо заметных уровней вируса (вверху) или наличие (внизу) вируса показано на рисунке.
Обсуждение
Спасательная рекомбинантных вирусов гриппа из плазмиды ДНК представляет собой простой и понятный процесс когда-то протокол регулярно проводится в лаборатории, но в начале, несколько вещей может пойти не так. Крайне важно иметь хорошую подготовку плазмиды для создания вируса. Правиль?...
Раскрытие информации
Благодарности
Авторы хотели бы поблагодарить прошлых и настоящих членов в Адольфо Гарсия-Састре и Питер Палезе лаборатории для развития гриппа обратном методов генетики и плазмиды. Исследования в AG-S лабораторий частично финансируется CRIP, NIAID финансируемых центром передового опыта по изучению гриппа и надзора (HHSN266200700010C) и NIAD гранты R01AI046954, U01AI070469 и P01AI058113. Исследования в LM-S лаборатории частично финансируется NIAID грант RO1AI077719.
Материалы
Клеточные линии
293T (каталожный номер CRL-11268) и MDCK (номер по каталогу CCL-34) клеточных линий ведутся в 37 ° C инкубаторе с 5% СО 2 в DMEM 10% FBS, 1% PS. Клетки доступной форме Американской коллекции типовых культур (АТСС, 10801 Университетского бульвара, Манассас, штат Вирджиния. 20110-2209 США).
Эмбрионов куриных яиц
Эмбрионах 10-дневных куриных яиц могут быть получены из Charles River Laboratories, конкретные Возбудитель птичьего питания взнос (SPAFAS) Птичий продуктов и услуг. Франклин Коммонс, 106 Рут 32, Северная Франклин, CT 06254 США. Яйца инкубируют при 37 ° С предыдущей и после вирусной инфекции. До и после вирусной инфекции, яйца candled для определения жизнеспособности эмбрионов. Это очень важно, чтобы искать мертвых икринок до и после вирусной инфекции. Перед инфекции мертвые яйца могут быть легко замечены отсутствие кровеносных сосудов, а также отсутствие эмбриона мобильности. Когда candled, живые эмбрионы двигаться. После вирусной инфекции мертвым яйцо (вероятно, связано с инфекцией гриппа вируса) будет легко узнать по плохим появление яйца с точки зрения малых и кровавые объема аллантоисной жидкости. Зараженные-яйца, отбрасываются в двойных мешках и автоклавируемый автоклавного следующие стандартные процедуры.
Куриные красных кровяных телец (эритроцитов)
Куриные РБК могут быть приобретены у Фермы Truslow, 201-Валли-роуд, Chestertown, Md 21620. Хранить при температуре 4 ° С. Для HA анализов, стирка 5 мл куриного РБК с 45 мл PBS 1X в 50 мл центрифужную пробирку. Центрифуга в течение 5 минут при 1000 оборотах, РТ. Отменить тщательно супернатант и использовать 1:1000 разбавления гранулированный РБК в PBS 1X (конечной концентрации 0,5-1,0% РБК).
Культуры ткани супернатанты и аллантоисную жидкости
Оба, культуры тканей супернатанты и аллантоисную жидкости можно хранить при температуре 4 ° С в течение короткого периода времени. После подтверждения вируса спасения, вирусов от клетки супернатанты или аллантоисной жидкости хранятся при температуре -80 ° C.
Плазмиды
Все плазмиды подготовлен с использованием рекомендаций плазмиды макси комплект следующих производителей. Все плазмиды аликвоту в концентрации 1 мкг / мл в DDH 2 O и хранится при температуре -20 ° C. Для кратковременного хранения, плазмиды можно хранить при температуре 4 ° C. Концентрация очищенной ДНК плазмиды определяется спектрофотометрически при 260 нм, с чистотой быть оценены с использованием 260:280 нм отношение. Препараты с 1,8-2,0 нм 260:280 отношения рассматриваются, выделяемых на цели вирус спасения. Кроме того, плазмиды концентрации и чистоты должен быть подтвержден в агарозном гель-хроматографии. Ambisense PDZ плазмиды (6), содержащий восемь гриппа A/PR/8/34 вирусных генов (7) показаны на рисунке 2.
Вирусы
Описанные протокол для спасения гриппа A/PR/8/34 может быть выполнена под уровня биобезопасности (BSL) 2 условий. Загрязненный материал, в том числе культуре ткани супернатанты и куриных эмбрионов, следует стерилизовать перед утилизацией. Спасение другой вирус гриппа, могут потребоваться более высокие BSL условиях и, следовательно, особые условия / безопасность измерений должны быть соблюдены.
Ткани питательных сред и растворов
DMEM 10% FBS 1% PS: 445 мл среды Дульбекко изменение Орла (DMEM), 50 мл фетальной телячьей сыворотки (FBS), и 5 мл 100X пенициллина / стрептомицина (PS). Хранить при температуре 4 ° С. Этот носитель будет использоваться для поддержания 293T и MDCK клеток, а также для трансфекции. DMEM 0,3% BA 1% PS: 495,7 мл DMEM, 4,3 мл 35% бычьего альбумина (BA). Хранить при температуре 4 ° С. Просто перед употреблением, добавить TPCK лечение трипсина в конечной концентрации 1 мкг / мл. Инфекционные СМИ.
10 раз фосфатным буферным раствором (PBS): 80 г хлористого натрия, 2 г хлорида калия, 11,5 г Na 2 HPO 4 .7 H 2 O, 2 г KH 2 PO 4. Добавить DDH 2 O до 1 л. Отрегулируйте рН до 7,3. Стерилизовать автоклаве. Хранить при комнатной температуре.
1X PBS: развести в 10 раз PBS 1:10 с DDH 2 O. Стерилизовать в автоклаве и хранить при комнатной температуре.
Ссылки
- Neumann, G., Watanabe, T., Ito, H., Watanabe, S., Goto, H., Gao, P., Hughes, M., Perez, D. R., Donis, R., Hoffmann, E., Hobom, G., Kawaoka, Y. Generation of influenza A viruses entirely from cloned cDNAs. Proc Natl Acad Sci U S A. 96, 9345-9350 (1999).
- Fodor, E., Devenish, L., Engelhardt, O. G., Palese, P., Brownlee, G. G., Garcia-Sastre, A. Rescue of influenza A virus from recombinant DNA. J Virol. 73, 9679-9682 (1999).
- Martinez-Sobrido, L., Garcia-Sastre, A. Recombinant influenza virus vectors. Future Virology. 2, 401-416 (2007).
- Palese, P., Shaw, M. L., Knipe, D. M., Howley, P. H. Orthomyxoviridae. The viruses and their replication. Fields Virology. , 1647-1689 (2006).
- Schickli, J. H., Flandorfer, A., Nakaya, T., Martinez-Sobrido, L., Garcia-Sastre, A., Palese, P. Plasmid-only rescue of influenza A virus vaccine candidates. Philos Trans R Soc Lond B Biol Sci. 356, 1965-1973 (2001).
- Quinlivan, M., Zamarin, D., Garcia-Sastre, A., Cullinane, A., Chambers, T., Palese, P. Attenuation of equine influenza viruses through truncations of the NS1 protein. J Virol. 79, 8431-8439 (2005).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient selection for high-expression transfectants with a novel eukaryotic vector. Gene. 108, 193-199 (1991).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены