Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Этикетка без На месте Изображений одревеснения в стенах растительной клетки
В этой статье
Резюме
Метод, основанный на конфокальной микроскопии комбинационного представлена, что позволяет без наклеек визуализации лигнина в стенках растительной клетки и сравнение одревеснения в различных тканей, образцов или видов.
Аннотация
Meeting growing energy demands safely and efficiently is a pressing global challenge. Therefore, research into biofuels production that seeks to find cost-effective and sustainable solutions has become a topical and critical task. Lignocellulosic biomass is poised to become the primary source of biomass for the conversion to liquid biofuels1-6. However, the recalcitrance of these plant cell wall materials to cost-effective and efficient degradation presents a major impediment for their use in the production of biofuels and chemicals4. In particular, lignin, a complex and irregular poly-phenylpropanoid heteropolymer, becomes problematic to the postharvest deconstruction of lignocellulosic biomass. For example in biomass conversion for biofuels, it inhibits saccharification in processes aimed at producing simple sugars for fermentation7. The effective use of plant biomass for industrial purposes is in fact largely dependent on the extent to which the plant cell wall is lignified. The removal of lignin is a costly and limiting factor8 and lignin has therefore become a key plant breeding and genetic engineering target in order to improve cell wall conversion.
Analytical tools that permit the accurate rapid characterization of lignification of plant cell walls become increasingly important for evaluating a large number of breeding populations. Extractive procedures for the isolation of native components such as lignin are inevitably destructive, bringing about significant chemical and structural modifications9-11. Analytical chemical in situ methods are thus invaluable tools for the compositional and structural characterization of lignocellulosic materials. Raman microscopy is a technique that relies on inelastic or Raman scattering of monochromatic light, like that from a laser, where the shift in energy of the laser photons is related to molecular vibrations and presents an intrinsic label-free molecular "fingerprint" of the sample. Raman microscopy can afford non-destructive and comparatively inexpensive measurements with minimal sample preparation, giving insights into chemical composition and molecular structure in a close to native state. Chemical imaging by confocal Raman microscopy has been previously used for the visualization of the spatial distribution of cellulose and lignin in wood cell walls12-14. Based on these earlier results, we have recently adopted this method to compare lignification in wild type and lignin-deficient transgenic Populus trichocarpa (black cottonwood) stem wood15. Analyzing the lignin Raman bands16,17 in the spectral region between 1,600 and 1,700 cm-1, lignin signal intensity and localization were mapped in situ. Our approach visualized differences in lignin content, localization, and chemical composition. Most recently, we demonstrated Raman imaging of cell wall polymers in Arabidopsis thaliana with lateral resolution that is sub-μm18. Here, this method is presented affording visualization of lignin in plant cell walls and comparison of lignification in different tissues, samples or species without staining or labeling of the tissues.
протокол
1. Подготовка образцов
- Горы гидратированных образцов растений, например, тополь стволовой древесины или Arabidopsis thaliana стволовых, в микротоме.
- Вырезать тонкие срезы (как правило, толщиной 20 мкм) с нативной ткани.
- Передача завода раздел на микроскопический слайд стекла.
- Замочите завод раздел D 2 O и накрыть скольжения стеклянной крышкой, которая запечатана на предметное стекло для предотвращения испарения D 2 O. Завод разделе готов для работы с изображениями, или это могут быть сохранены для будущего использования.
2. Пример измерений
- Применить погружение нефти на объективный микроскоп и / или покровным стеклом.
- Место и безопасное стекло микроскопа на пьезоэлектрический этапе сканирования микроскопа, с покровным стеклом перед объектива микроскопа.
- Посмотреть образец через покровным стеклом использованием высокой числовой апертурой объектива микроскопа погружения (100x, NA = 1,40) и найдите образец сфере интересов.
- После выключения всех других легких лабораторных и микроскоп источников, должность разрешением microspectroscopic измерения проводятся путем сосредоточения полосового фильтра монохроматического зеленого света (λ = 532 нм) от непрерывного лазера на образце с типовая мощность от 10 до 30 мВт ( см. рисунок 1 для Схема установки). Аутофлюоресценция может произойти в некоторых образцах, которые могут запретить полезные измерения, в этом случае возбуждения больше света длина волны лазера может быть целесообразным.
- Обратно рассеянных Стокса-смещается комбинационного свет собирается объектива микроскопа, проходит через дихроичных зеркала, отверстие, которое служит пространственным фильтром в конфокальной установки, и фильтр longpass, и фокусируется в щель решетки спектрометра, где свет рассеянный и спектрально обнаружены охлаждением ПЗС-камерой, что дает комбинационного рассеяния. СКР древесины тополя показано на рисунке 2, с характерными полосами лигнина в спектральную область между 1600 и 1700 см -1.
- Для визуализации химической и визуализация пространственного распределения лигнина, двумерной спектральной карта приобретается растрового сканирования образца через лазерный фокус с пьезоэлектрическими этапе сканирования и записи спектра комбинационного рассеяния для каждого образца положение. Трехмерная спектральная карты могут быть созданы путем укладки двумерных карт, для которых лазерного фокуса была усилена последовательно вдоль Z-направлении.
3. Анализ данных
- Для химической обработки изображений и лигнина визуализации, собранные данные анализируются с помощью MATLAB (MathWorks, версия 7.7). Данные расположены в трехмерном гиперспектральных куб, который состоит из двух пространственных измерениях и третье измерение спектральных сигналов.
- Для анализа лигнина, спектральную область между 1550 и 1700 см -1 считается (см. Рисунок 2). Пространственного распределения лигнина визуализируется путем интеграции интенсивности от 1550 до 1700 см -1 базовой коррекции спектров (см. Рисунок 3). В качестве альтернативы базовой коррекции, второй производной спектра можно вычислить и второй производной пиками использовались для анализа.
- Лигнин локализации и химии, особенно в связи с coniferaldehyde и кониферилового остатков алкоголя, может быть в дальнейшем проанализированы оценки площади под пиками установлены гауссовой три полосы найдены между 1600 и 1700 см -1 (см. вставку на рис 2 и работах 15. - 17).
- Интенсивность нормализации отношений между различными спектральными карт осуществляется с использованием в качестве эталона высота пика внешних OD растяжения полоса около 2500 см -1 в среднем спектров просвета, которые получаются при К-средних кластеризации классификации. Это очень важно и позволяет сравнивать интенсивности лигнина сигнала между различными измерениями, тканей, образцов и видов.
4. Представитель Результаты
Представитель СКР тополь (Populus узколистный) стволовой древесины показано на рисунке 2. Характерные полосы лигнина находятся в спектральном диапазоне между 1600 и 1700 см -1. Как, например, пространственное распределение лигнина в древесины тополя сечения представлены на рисунке 3. По сравнению с видимое изображение, морфологически различные области клеточной стенки становятся ясно различимыми из-за различной интенсивности сигнала лигнина. Сигнала высокой лигнина интенсивность наблюдается в клетке углами (CC) и, несколько меньше, в среднем соединения ламелей (CML). Нижний, но не иллюзорный, количество лигнина наблюдаются в S2 слой стены волокон. Изменчивость интенсивность сигнала лигнина находится в некоторой степени в УК, CML и S2, особенно от слоя к слою. Боковые пространственное разрешение в наших измерений составляет ~ 300 нм. Качества данных, хорошо подходит для сравнения между одревеснениеОбразцы и дальнейшего рассекать лигнина химии 15.
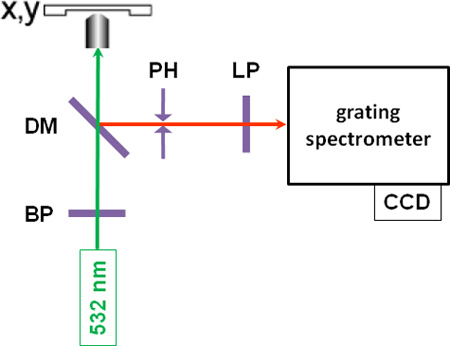
Рисунок 1: Схема инструментальной установки ВР. Полосовой фильтр; DM: дихроичных зеркала, PH: отверстие; LP: longpass фильтр.
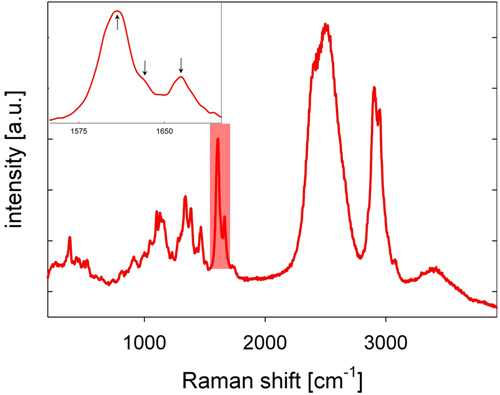
Рисунок 2: представитель СКР тополь (Populus узколистный) стволовой древесины, записанные в D 2 O. Подчеркнул спектральной области (также см. вставку) знаменует области спектра с тремя пиками в частности связано с лигнином.

Рисунок 3: комбинационное лигнина изображения (внизу) древесины тополя сечения (вверху: видимый образ), получается интегрированием интенсивности комбинационного сигнала от 1550 до 1700 см -1.
Обсуждение
Лигноцеллюлозной материалы являются иерархическими и гетерогенных как с точки зрения структуры и состава. Для углубленного характеристика аналитических инструментов, которые имеют химическую чувствительность, пространственное разрешение, и что дают представление этих материалов ?...
Раскрытие информации
Благодарности
Мы благодарим Эндрю Кэрролл, светлая Chaibang, Purbasha Саркар (Energy Biosciences институт, Беркли), Бахрам Парвин (Lawrence Berkeley National Laboratory) и Винсент Л. Чан (North Carolina State University) за плодотворное сотрудничество и полезные обсуждения. Эта работа была поддержана Энергия биологических наук института. Работа в молекулярной Литейное при поддержке Управления науки, Управление основной энергии наук, из Министерства энергетики США по контракту № DE-AC02-05CH1123.
Материалы
| Name | Company | Catalog Number | Comments |
| microscope slides | |||
| cover slips | |||
| D2O | |||
| nail polish | |||
| immersion oil | |||
| tweezers | |||
| pointed brush | |||
| microtome | |||
| confocal Raman microscope |
Ссылки
- Herrera, S. Bonkers about biofuels. Nat Biotechnol. 24, 755-760 (2006).
- Himmel, M. E. Biomass recalcitrance: Engineering plants and enzymes for biofuels production. Science. 315, 804-807 (2007).
- Pauly, M., Keegstra, K. Cell-wall carbohydrates and their modification as a resource for biofuels. Plant J. 54, 559-568 (2008).
- Pauly, M., Keegstra, K. Physiology and metabolism 'Tear down this wall. Curr Opin Plant Biol. 11, 233-235 (2008).
- Ragauskas, A. J. The path forward for biofuels and biomaterials. Science. 311, 484-489 (2006).
- Somerville, C. Biofuels. Curr Biol. 17, R115-R119 (2007).
- Ralph, J., Brunow, G., Boerjan, W. . Lignins in Encyclopedia of Life Sciences. , (2007).
- Chiang, V. L. From rags to riches. Nat Biotechnol. 20, 557-558 (2002).
- Atalla, R. H., Agarwal, U. P. Raman microprobe evidence for lignin orientation in the cell walls of native woody tissue. Science. 227, 636-638 (1985).
- Atalla, R. H., Agarwal, U. P. Recording Raman spectra from plant cell walls. J Raman Spectrosc. 17, 229-231 (1986).
- Fukushima, K. Regulation of syringyl to guaiacyl ratio in lignin biosynthesis. J Plant Res. 114, 499-508 (2001).
- Agarwal, U. P. Raman imaging to investigate ultrastructure and composition of plant cell walls: distribution of lignin and cellulose in black spruce wood (Picea mariana). Planta. 224, 1141-1153 (2006).
- Gierlinger, N., Schwanninger, M. Chemical imaging of poplar wood cell walls by confocal Raman microscopy. Plant Physiol. 140, 1246-1254 (2006).
- Gierlinger, N., Schwanninger, M. The potential of Raman microscopy and Raman imaging in plant research. Spectrosc Int J. 21, 69-89 (2007).
- Schmidt, M. Label-free in situ imaging of lignification in the cell wall of low lignin transgenic Populus trichocarpa. Planta. 230, 589-597 (2009).
- Agarwal, U. P., Argyropoulos, D. S. An Overview of Raman Spectroscopy as Applied to Lignocellulosic Materials. Advances in Lignocellulosics Characterization. , 201-225 (1999).
- Agarwal, U. P., Ralph, S. A. Determination of ethylenic residues in wood and TMP of spruce by FT-Raman spectroscopy. Holzforschung. 62, 667-675 (2008).
- Schmidt, M. Raman imaging of cell wall polymers in Arabidopsis thaliana. Biochem Biophys Res Comm. 395, 521-523 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены