Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Изоляция, обогащению и техническому обслуживанию ячеек медуллобластомой Стволовой
В этой статье
Резюме
Этот протокол описывает изоляции, обогащение, и поддержание медуллобластомой опухоли стволовые клетки, полученные из мутантных мышей с внематочной Соник деятельности путем ежа.
Аннотация
Brain tumors have been suggested to possess a small population of stem cells that are the root cause of tumorigenesis. Neurosphere assays have been generally adopted to study the nature of neural stem cells, including those derived from normal and tumorous tissues. However, appreciable amounts of differentiation and cell death are common in cultured neurospheres likely due to sub-optimal condition such as accessibility of all cells within sphere aggregates to culture medium.
Medulloblastoma, the most common pediatric CNS tumor, is characterized by its rapid progression and tendency to spread along the entire brain-spinal axis with dismal clinical outcome. Medulloblastoma is a neuroepithelial tumor of the cerebellum, accounting for 20% and 40% of intracranial and posterior fossa tumor in childhood, respectively1. It is now well established that Shh signaling stimulates proliferation of cerebellar granule neuron precursors (CGNPs) during cerebellar development 2-4. Numerous studies using mouse models, in which the Shh pathway is constitutively activated, have linked Shh signaling with medulloblastoma 5-9.
A recent report has shown that a subset of medulloblastoma cells derived from Patched1LacZ/+ mice are cancer stem cells, which are capable of initiating and propogating tumors 10. Here we describe an efficient method to isolate, enrich and maintain tumor stem cells derived from several mouse models of medulloblastoma, with constitutively activated Shh pathway due to a mutation in Smoothened (11, hereon referred as SmoM2), a GPCR that is critical for Shh pathway activation. In every isolated medulloblastoma tissue, we were able to establish numerous highly proliferative colonies. These cells robustly expressed several neural stem cell markers such as Nestin and Sox2, can undergo serial passages (greater than 20) and were clonogenic. While these cultured tumor stem cells were relatively small, often bipoar with high nuclear to cytoplasmic ratio when cultured under conditions favoring stem cell growth, they dramatically altered their morphology, extended multiple cellular processes, flattened and withdrew from the cell cycle upon switching to a cell culture medium supplemented with 10% fetal bovine serum. More importantly, these tumor stem cells differentiated into Tuj1+ or NeuN+ neurons, GFAP+ astrocytes and CNPase+ oligodendrocytes, thus highlighting their multi-potency. Furthermore, these cells were capable of propagating secondary medulloblastomas when orthotopically transplanted into host mice.
протокол
1. Микро-рассечение опухоль мозжечка, Диссоциация опухолевой ткани и покрытие
- Восстановление опухолевой ткани
- Больных мышей медуллобластомой часто runted, отображается гидроцефалия и типичных неврологических симптомов, включая паралич задних и неудачи, чтобы восстановить положение, когда отменяют. Чтобы получить опухолевой ткани, усыпить мышей углерода вдыхания газа. Важно не выполнять шейки дислокации, процедура, которая порождает давление на задний черепа и может поставить под угрозу целостность ткани опухоли.
- Обезглавливание выполняется сразу же после смерти с помощью пары ножниц, удаление волос и мышечную ткань как можно больше для хорошей визуализации черепа. Очистите поверхность черепа с Kimwipe пропитанный 95% этанола.
- Использование тонких ножницы, чтобы вырезать отверстие вдоль средней линии черепа, черепа и удаления ткани с помощью тонкой пинцетом, после чего весь мозг, включая опухоль мозжечка подвергается.
- Хотя cerebella здоровых взрослых дисплей четко определенных полушарий и червя, cerebella с опухолями мышей часто увеличены, аморфное с гладкой поверхностью и заметным кровеносных сосудов. Использование стерильных техник, получить опухоль мозжечка с помощью пинцета, поместить в ледяной ФСБ без Mg 2 + и Ca 2 +.
Примечание: все инструменты стерилизуются в 95% этаноле перед использованием. - Диссоциация опухолевой ткани
- Передача опухолевую ткань от PBS до 50% Accutase (разводят в PBS), примерно в 4 раза объема опухолевой ткани, пропустить через мясорубку с мелкой ткани ножницами в течение 3 минут при комнатной температуре, после инкубации при температуре 37 ° С в течение 4 минут , после чего ткань подвергается повторяющимся pipeting с 1-мл Pipetman дополнительные 3 минуты. Этот метод должен дать смесь отдельных клеток и небольших сотовых агрегатов.
- Развести суспензии клеток в 3 раза с PBS и центрифуги в течение 5 минут при 1000 г в гранулах клеток. Ресуспендируют осадок клеток в свежей среде нейронных стволовых клеток культуры и пластины на желатинизированный 60 мм Primaria блюдо культуры ткани. Мы используем Primaria блюда для расширения вложений на первый покрытие, последующие проходы могут быть покрыты на регулярные блюда культуры ткани.
Примечание: Пальто культуры блюда с 0,1% желатина, по крайней мере 30 минут. Подготовка свежих нейронных стволовых клеток культуры среда, состоящая из Neurobasal среде с глутамин, Пен-стрептококками, N2, B27, человеческого эпидермального фактора роста (25 нг / мл) и основной FGF (25ng / мл).
2. Обогащение, поддержание и расширение Клетки опухоли медуллобластомой по серийному Проходы
Обычно мы получаем много колоний через 1 неделю начального покрытия (рис. 1). Эти колонии могут быть отделены и replated на новые желатинизированный блюда для обогащения популяции опухолевых клеток. Первые изменения в новой культурной среде, а затем просто использовать 1-мл Pipetman механически отделить колоний следуют повторные pipeting в течение 4 минут для получения суспензии клеток (без Accutase необходимости). Проверьте под микроскопом, чтобы гарантировать, что большие скопления ячейки были диссоциированы. Затем обойтись суспензии клеток на новые желатинизированный блюда для дальнейшего культивирования и пройти ту же процедуру для дополнительных проходов. Одиноких опухолевых клеток, клеток крови и другие типы клеток удаляются серийный повторно посевов, оставляя прилагается опухолевые клетки быстро расширяться. Изменение питательной среды на второй день после первоначального посева, и через день после этого.
3. Иммунофлуоресцентного окрашивания и экспертизы культивируемых клеток
1. Рост опухолевых клеток на стеклянные покровные
На 1-й день, положите стекло покровное в каждом из 6-луночный планшет, затем добавьте 0,1% желатина в течение 30 минут при температуре 37 ° C. Семенной около 2-4X 10 5 опухолевых клеток на мл. Клетки должны приложить на ночь и нейронных стволовых клеток среда изменилась на 3 день. Окрашивание производится на 4-й день.
2 иммунофлуоресцентного окрашивания
Удалить питательной среды и промыть клетки дважды ледяным PBS. Fix клетки свежих составил 4% PFA в течение 15 минут. Кратко мыть клетки дважды с PBS и permeablize с 0,3% Triton (в PBS) в течение 5 минут. Кратко мыть клетки дважды с PBS и блок с 10% сыворотки козьего течение 40 минут. Инкубируйте клетки с первичными антителами в течение 90 минут, затем промыть клетки три раза PBS, в течение 5 минут каждый. Инкубируйте клетки с вторичными антителами в течение 60 минут, затем вымыть три раза с PBS, 5 минут каждый. Горы покровные на слайды с 5 мл водного монтажа средних и выполнять конфокальной микроскопии.
4. Дифференцировку опухолевых клеток
Удалить нEural стволовых клеток и средний кратко мыть клетки с PBS в два раза. Добавить дифференциации среды на 1-й день, изменение среды на 4-й день и определить уровень дифференциации с помощью иммунофлуоресценции окрашивания на 7 день. Дифференциация среда состоит из DMEM, Пен-Strep и 10% эмбриональной телячьей сыворотки.
5. Представитель Результаты
Морфология результаты
После лечения Accutase и нежный повторяющихся pipeting, опухолевой ткани должны быть главным образом распадается на небольших сотовых агрегатов и отдельных клеток. Многие значительные колонии можно наблюдать уже через 5 дней после начального покрытия, как показано на рисунке 1. Высокая пролиферативная опухолевые клетки часто биполярный с высокой ядерных / цитоплазматические отношения. Эти клетки обычно видны излучающих от небольших сотовых агрегатов придается желатинизированный поверхности. Клетки крови, маленькие и круглые, как правило, удалены от последующих изменений средствах массовой информации и серийный посевов. После нескольких проходов, можно наблюдать, равномерно распределенные, пролиферативная Ki67 + опухолевых клеток и мало загрязнения с другими типами клеток (рис. 2).
Выражение нейронных стволовых клеток маркеры, клонального анализа и дифференциации на несколько линий
Чтобы определить, пролиферативные клетки, полученные из диссоциированных мозжечка опухолевой ткани показывают характеристики опухолевых стволовых клеток, мы провели по дальнейшей характеристики стволовых клеток маркера выражение, клонального анализа и дифференциации потенции. Мы обнаружили, что эти отдельные клетки опухоли очень выразить нейронных стволовых клеток маркеры, такие как Sox2 и нестин (рис. 3). Как получить ткани от SmoM2-YFP опухоли, все опухолевые клетки экспрессируют YFP. В соответствии с недавнего исследования, сообщает, что первичные реснички имеют важное значение для развития Тсс пути зависит от медуллобластомой 12, SmoM2-YFP выражение было четко локализованы в ресничек Sox2 + опухолевых клеток (рис. 3). Когда покрытие на клональной плотностью 300 клеток на мл культуральной среды, мы наблюдали клональной экспансии из одной клетки опухоли к значительным колонии (рис. 4). Кроме того, эти клетки способны дифференцироваться в различные нейроны и глиальные типов клеток при культивировании в про-дифференциации условий (рис. 5).
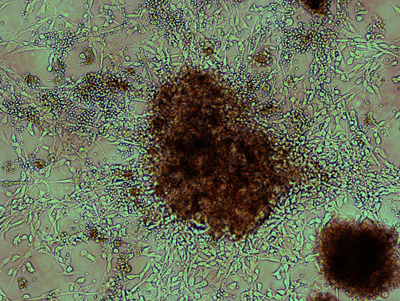
Рисунок 1. Морфология высоко пролиферативные колонии после первого покрытия диссоциированных тканей медуллобластомой. Как правило, значительная формы колонии в течение 5 дней после первоначального посева диссоциированных ткани опухоли и представительным проиллюстрирован здесь, в светлом поле. Би-полярные, удлиненные клетки излучают из плотной совокупности ячейки ядра. В приложении к опухолевые клетки маленькие, круглые красные кровяные клетки, которые постепенно исчерпывается серийный посевов.

Рисунок 2. Морфология создана медуллобластомой клетки больше трех проходов. Этот яркий образ поле показывает типичный вид установленных клетки медуллобластомой после нескольких проходов. Клетки остаются главным образом биполярный с высокой ядерных / цитоплазматические отношения. Мы показываем, ацетилированный окрашивания тубулина опухолевых клеток, большинство из которых езда на велосипеде, как показано сильным Ki67 выражения.
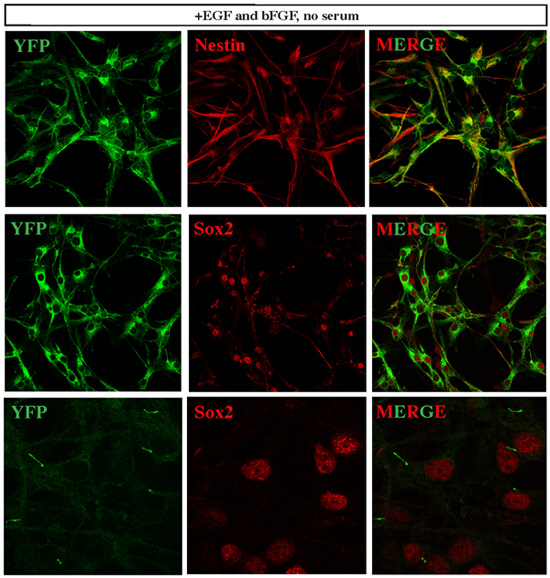
Рисунок 3. Основанная клетки медуллобластомой выразить нейронных маркеров стволовых клеток. SmoM2-YFP знаки клеток, экспрессирующих конститутивно SMO, следовательно Тсс деятельности путем. Все клетки установленных линий медуллобластомой ячейке выразили YFP, и большинство из них совместно выразили высокий уровень различных нейронных стволовых клеток маркеры, такие как нестин и Sox2. Интересно, что когда мы выступали YFP обнаружения сигнала с минимальной мощности лазера при конфокальной микроскопии, мы обнаружили сосредоточены YFP сигнала в ресничек Sox2 + клеток. Это наблюдение согласуется с последних 12 сообщают, что описанные существенную роль ресничек в развитии Тсс пути зависит от медуллобластомой.
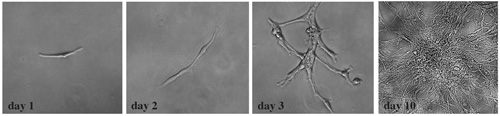
Рисунок 4. Основанная опухолевые клетки претерпевают клональной экспансии. После распада в суспензии отдельных клеток, опухолевых клеток высевали на 24 хорошо табличку на клональной плотностью 300 клеток на мл питательной среды. В каждую лунку мы наблюдали клонально расширен колоний. Эта серия ярких образов поле демонстрируют типичные изменения в течение 10-дневного периода культуры.

Рисунок 5. Дифференциация анализы созданы клетки медуллобластомой. Когда опухолевые клетки были переведены из EGF / bFGF содержащие бессывороточной среде, чтобы DMEM/10% FBS, YFP + опухолевых клеток значительно изменили свою морфологию и дифференцировались в различные типы клеток, в т.ч.ЛУДИНГ Tuj1 + или + Neun нейронов, GFAP + астроглиальных клеток или CNPase + олигодендроцитов.
Обсуждение
Мы описываем эффективный способ изолировать, обогащать и поддерживать медуллобластомой стволовых клеток из первичной опухоли ткани извлекаются из мутантных мышей с конститутивно Ежик сигнализации. Мы обнаружили, что один важный шаг в создании успешно здоровых стволовых клеток опух?...
Раскрытие информации
Благодарности
Это исследование было поддержано грантами Вандербильт-Инграм онкологический центр поддержки Грант (P30 CA068485), опухоли мозга у детей и Фонд Национальных институтов здравоохранения (NS042205).
Материалы
| Name | Company | Catalog Number | Comments |
| Neurobasal medium | Invitrogen | 21103049 | |
| hEGF | Invitrogen | PHG0311 | 25ng/ml |
| bFGF | Invitrogen | PHG0023 | 25ng/ml |
| N2 | Invitrogen | 17502048 | 1X |
| B27(-RA) | Invitrogen | 12587010 | 1X |
| Accutase | Invitrogen | A1110501 | 50% |
| Gelatin | Sigma-Aldrich | G1393 | 0.1% |
| Glutamine | Invitrogen | 25030081 | 2mM |
| Primaria dishes | Fisher Scientific | 087724C | |
| Sox2 antibody | EMD Millipore | MAB4343 | Mouse, 1:1000 |
| Nestin antibody | DSHB | rat401 | Mouse, 1:200 |
| YFP antibody | Molecular Probes, Life Technologies | A11122 | Rabbit, 1:2000 |
| GFAP antibody | Neuromics | CH22102 | Chicken, 1:1000 |
| Tuj1 antibody | Sigma-Aldrich | T5076 | Mouse, 1:2000 |
| NeuN antibody | EMD Millipore | MAB377 | Mouse, 1:2000 |
| CNPase antibody | EMD Millipore | MAB326 | Mouse, 1:1000 |
Ссылки
- Rossi, A., Caracciolo, V., Russo, G. Medulloblastoma: From Molecular Pathology to Therapy. Clin Cancer Res. 14 (4), 971-971 (2008).
- Wechsler-Reya, R. J., Scott, M. Control of Neuronal Precursor Proliferation in the Cerebellum by Sonic Hedgehog. P. Neuron. 22 (1), 103-103 (1999).
- Dahmane, N., Ruiz, A., Altaba, I. Sonic hedgehog regulates the growth and patterning of the cerebellum. Development. 126 (14), 3089-3089 (1999).
- Wallace, V. A. Purkinje-cell-derived Sonic hedgehog regulates granule neuron precursor cell proliferation in the developing mouse cerebellum. Curr Biol. 9 (8), 445-445 (1999).
- Fan, X., Eberhart, C. G. Medullablastoma Stem Cells. J Clin Oncol. 26 (17), 2821-2821 (2008).
- Yoon, J. W., Gilbertson, R., Iannaccone, S. Defining a Role for Hedgehog Pathway Activation in Desmoplastic Medulloblastoma by Identifying GLI1 Target Genes. International journal of cancer. 124 (1), 109-109 (2009).
- O'Dorisio, M. S., Khanna, G., Bushnell, D. Combining anatomic and molecularly targeted imaging in the diagnosis and surveillance of embryonal tumors of the nervous and endocrine systems in children. Review. Cancer metastasis reviews. 27 (4), 665-665 (2008).
- Corcoran, R. B., Bachar Raveh, T., Barakat, M. T. Insulin-like Growth Factor 2 Is Required for Progression to Advanced Medulloblastoma in patched1 Heterozygous Mice. Cancer research. 68 (21), 8788-8788 (2008).
- Gilbertson, R. J., Ellison, D. W. The Origins of Medulloblastoma Subtypes. Annual review of pathology. 3, 341-341 (2008).
- Ward, R. J., Lee, L., Graham, K. Multipotent CD15+ Cancer Stem Cells in Patched-1 Deficient Mouse Medulloblastoma. Cancer research. 69 (11), 4682-4682 (2009).
- Mao, J., Ligon, K. L., Rakhlin, E. Y. A Novel Somatic Mouse Model to Survey Tumorigenic Potential Applied to the Hedgehog Pathway. Cancer research. 66, 10171-10171 (2006).
- Han, Y. G., Kim, H. J., Dlugosz, A. A. Dual and opposing roles of primary cilia in medulloblastoma development. Nature medicine. 15 (9), 1062-1062 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены