Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Дважды флуоресценции На месте Гибридизация в пресной разделы мозга
В этой статье
Резюме
Этот протокол предполагает нерадиоактивных На месте Гибридизации процедура, которая позволяет одновременное определение двух видов стенограммы, на одной резолюции клетки, в тонких срезов мозга позвоночных.
Аннотация
Здесь мы опишем модифицированной версией двойной флуоресценции
протокол
Этот протокол был разработан и уточнены на основе стандартных радиоактивных и нерадиоактивных на месте гибридизация методы, ранее разработанные нами и другими для выявления одного или двух видов стенограмму в ткани головного мозга 1-7. Протокол, описанный ниже, общая длина 2 или 3 дня, в зависимости от ряда процедурных перерывов выбран конечным пользователем. Все шаги, описанные ниже, должны быть проведены при комнатной температуре, за исключением шага riboprobe гибридизации и пост-гибридизации стирок. Растворов и буферов, необходимых для всех этапов этого метода можно найти в конце этого протокола.
1. Подготовка тканей и Секционирование
- Обезглавьте и извлечь мозг испытуемого быстро, и поместите его в пластиковые формы адекватного размера.
- Обложка мозг ткани-Tek среда вложения и быстро местом для литья пластмасс в dry-ice/alcohol ванны для быстрого замораживания. Замороженные ткани могут храниться при температуре -80 ° С до использования.
- Использование криостат, собирать 2 или 3 мозга разделы на слайд на заряженные SuperFrost Плюс слайдов. Толщина секций должна быть 10-12 мкм. Слайды можно хранить при температуре -80 ° С до использования.
2. Подготовка сефадексе G50 столбцов для очистки зонда
"Сефадексом колонки могут быть приобретены из коммерческих источников, однако, мы приводим ниже недорогой альтернативой для создания колонн, которые будут необходимы для зонда очистки.
- Гидратов достаточное количество сефадексе G50 порошок РНКазой, свободной, DEPC обработанной воды (например, 2 г порошка в 100 мл DEPC-очищенной воды), кратко перемешать раствор и хранить при комнатной температуре для осаждения избыточных сефадексе G50.
- Удалить супернатант (верхний слой воды) после сефадексе G50 осадков.
- Повторите этот процесс более 3 - 5 раз.
- После последней промывки, вновь приостановить сефадексе G50 решение в ТЕ буфере (1:1), и храните при температуре 4 ° С до использования.
- Место автоклавного стекловаты в стерильный шприц 1 мл и сжимать его с поршнем, чтобы сделать компактный слой на дне, а затем поместить шприца в трубку 15 мл Falcon.
- Хорошо перемешайте решение сефадексе G50 в ТЕ. Заполните шприц / столбец с этим решением.
- Центрифуга колонку в течение 30 сек при 1000 оборотах в минуту.
- Повторите эту процедуру, пока колонна почти полностью заполнены сефадексе G50 бисером.
- Применяют по 200 мкл промывочного буфера колонки к колонке и центрифуги в течение 2 мин при 1000 оборотах в минуту. Отменить проточные.
- Применяют по 200 мкл блокирующего буфера колонки к колонке и вращать его в течение 2 мин при 1000 оборотах в минуту. Повторите этот шаг 4-5 раз, чтобы уравновесить колонке. Столбцы можно хранить при 4 ° С до использования, если запечатанный парафильмом.
3. Маркировка и очистка Riboprobes
Ниже мы подробно поколения и очистки одного riboprobe. Для dFISH, подготовка каждый зонд будет включать в себя ту же методологию, за исключением того, что один из зондов будет помечена дигоксигенин (DIG) с метками UTP в то время как другие с биотином, помеченные UTP.
- Подготовка концентрированной (> 150 нг / мкл) и очищенный линеаризованной кДНК решение представляет интерес для создания либо смысла (контроль) или антисмысловых riboprobes.
- В 1,5 трубки микроцентрифужную мл, добавить 0,5-1 мкг очищенной кДНК шаблон, 2 мкл 5X буфера маркировки зонд, 1 мкл 10X DIG (или биотин) маркировки смеси, 0,5 мкл RNasin и 1 мкл соответствующего РНК-полимеразы и принести окончательный объем раствора до 10 мкл РНКазы без (DEPC обработанных) воды.
- Инкубируйте раствор в водяной бане при температуре 37 ° С в течение 2 часов.
- Добавить 1 мкл тРНК (акции, 20 мкг / мкл), и 39 мкл блокирующего буфера колонки к решению.
- Подготовка Sephadex G50 колонке для зонда очистки. С этой целью, добавить 50 мкл блокирующего буфера в колонну и вращать его в течение 10 сек при 1000 оборотах в минуту.
Повторите этот шаг 2-3 раза, чтобы уравновесить колонки (то есть, полный 50 мкл применяется к столбцу восстанавливаются после цикла центрифугирования). - Применение датчика решение колонке Сефадекс G50, положение новой трубки микроцентрифужную в нижней части колонки, и вращать его в течение 3 мин при 1000 оборотов в минуту для получения очищенной 50 мкл riboprobe решение.
- Оценка качества и урожайности меченых riboprobe используя либо стандартный формальдегид-РНК в агарозном геле, или спектрофотометр.
4. После фиксации, ацетилирование и гибридизация
- Удалите разделы из морозильной камеры -80 ° С и позволяют комнатной температуре, чтобы уравновесить. Впоследствии, инкубировать секций в холодную, только что составила 3% параформальдегида решение в течение 5 мин.
- Кратко промыть секций в рhosphate солевым буфером (PBS) в два раза.
- Дегидрировать разделы по стандартной серии алкоголя (70, 95 и 100%; 2 мин каждый), и пусть они воздушно-сухой.
- Инкубируйте разделы ацетилирования раствор на 10 мин.
- Промыть разделах 3 раза в 2х ГНПП.
- Дегидрировать разделы еще раз через стандартные серии алкоголя, описанных выше, и дать им высохнуть на воздухе.
- Подготовка соответствующего объема гибридизации решение и добавить оба riboprobes к решению (датчик концентрации: 1 нг / мкл для каждого зонда). Общий объем гибридизации решения определяется на основе ряда разделов будет гибридизированных (16 мкл гибридизации раствора на раздел).
- Применить адекватные объемы гибридизации решение ткани и покровное слайды гарантируя, что ни наложения пузырьки воздуха ткани.
- Место слайды в держатель слайдов металла. Опустите держатель в масляной ванне минеральных установлена на уровне 65 ° С в течение ночи. Убедитесь, что покровные являются вверх (то есть, наружной стороны держателя слайдов должно быть в контакте с нижней части контейнера минеральное масло).
5. После гибридизации Моет
- На следующий день, осторожно снимите держатель слайдов из ванны минеральные масла и кратко промыть его в хлороформе, чтобы удалить излишки масла из слайдов.
- Место слайдов в решении 2х ГНПП течение 5-10 мин. Покровные стекла должны отделяться от слайды в то время как в растворе.
- Передача слайдов новое решение 2X ГНПП, и держать их в течение 1 часа при комнатной температуре.
- Передача участков в раствор, содержащий 2X ГНПП плюс 50% формамида. Температура этого решения должна соответствовать температуре, используемые в ночь процедуру гибридизации. Хранить слайды в этом растворе в течение 1,5 часов.
- Передача разделы решение 0.1X ГНПП предварительно нагревают до той же температуре гибридизации шаг. Инкубируйте разделы в этом растворе в течение 30 мин. Повторите этот шаг еще в течение 30 мин.
6. Обнаружение и визуализация Riboprobes
- Передача слайды в буфер ТНТ которых 0,3% перекиси водорода был добавлен, в течение 10 мин.
- Вымойте секций в тротиловом буфера, в 3 раза (10 минут каждый).
- Использование пера DAKO, рисовать и во всем районе, мозг разделов. Важно отметить, что следует проявлять осторожность, чтобы разделы не сухим.
- Применить 150 мкл буфера для ТНБ каждого слайда, и инкубировать разделы в этом растворе в течение 30 мин, во влажной камере.
- Удалите излишки решение ТНБ, наклоняя слайдов.
- Применяют по 150 мкл раствора, содержащего TNB пероксидаза-сопряженных анти-DIG антитела, и хранить слайды во влажной камере в течение 2 часов. Антитела концентрация должна определяться индивидуально для каждого стенограмму интересов до проведения dFISH.
- Вымойте секций в тротиловом буфера; 3 раза, 10 минут каждый.
- Применить 150 мкл Alexa 594-сопряженных tyramide рабочего раствора для каждого слайда, и хранить их во влажной камере в течение 1 часа. Это решение должно быть подготовлено в соответствии с указаниями производителя.
- Вымойте секций в тротиловом буфера; 3 раза, 10 минут каждый.
- Инкубируйте секций в буфер ТНТ которых 0,3% перекиси водорода был добавлен в течение 10 - 30 мин.
- Вымойте секций в тротиловом буфера; 3 раза, 10 минут каждый.
- Применить 150 мкл буфера ТНБ на слайд, и держать их во влажной камере в течение 30 мин.
- Удалите излишки решение ТНБ, наклоняя слайдов.
- Добавить 150 мкл раствора, содержащего TNB пероксидаза-сопряженных анти-биотин антитела, и хранить слайды во влажной камере в течение 2 часов.
- Вымойте секций в тротиловом буфера; 3 раза, 10 минут каждый.
- Применить 150 мкл Alexa 488-сопряженных tyramide рабочего раствора для слайдов и инкубировать разделы в течение 1 часа. Это решение должно быть подготовлено в соответствии с рекомендациями производителя.
- Вымойте секций в тротиловом буфера; 3 раза, 10 минут каждый.
- Добавить 150 мкл Hoechst раствора (1:1000 в тротиловом буфера) для разделов и держать их во влажной камере в течение 2 мин.
- Вымойте секций в тротиловом буфера; 3 раза, 5 мин каждый.
- Покровное секций с флуоресценции-совместимые монтажные среды (например, Vectashield или продлить antifade).
7. Представитель Результаты
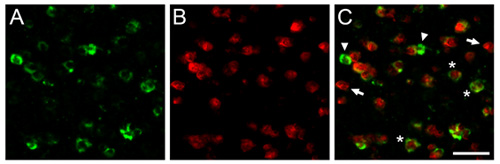
Рисунок 1. Здесь мы показываем, репрезентативные результаты, полученные в dFISH мозга зебры зяблик. Показаны микрофотографии полученных из caudomedial nidopallium стран (СМСС), аналог певчих птиц, млекопитающих кора аудитории. Мозг разделы подвергали гибридизации с биотинилированного riboprobe направлена против парвальбумина (А), маркером субпопуляции тормозящие нейроны, и DIG-меченых рибоЗонд направлены против деятельности зависит от генов zenk (Б), надежным маркером песни управляемых нейронами. С) Наложение (А) и (Б) показывает населения тормозных нейронов, которые активируются слуховой опыт. Стрелки и наконечники стрел свидетельствуют клетки помечены исключительно с каждой из двух riboprobes, и звездочки показывают представитель нейронов совместного выражения и стенограммы интерес. Шкала бар = 25 мкм.
Обсуждение
Мы использовали этот протокол для изучения того, как мозг позвоночных neurochemically и функционально организованным, и определить, как поведенчески-сенсорного воздействия соответствующих стимулов геномный механизм нейроны во взрослом мозге 8-10. Мы успешно использовали этот метод в тк...
Раскрытие информации
Благодарности
Работа поддержана грантами NIH / NIDCD и Шмитт Фонда RP.
Материалы
Решения
- Колонка промывочного буфера: 10 мМ Трис-HCl, 0,15 М NaCl, 0,05 мМ ЭДТА, 50 мкг / мкл тРНК, 0,1% SDS в 50 мл DEPC обработанной воды.
- Колонка блокирующего буфера: 10 мМ Трис-HCl, 50 мМ NaCl, 0,1 мМ ЭДТА в 50 мл DEPC обработанной воды.
- TNT буфер: 60 мл 1 М Трис-HCl, 18 мл 5 М NaCl и 1,8 мл Тритон Х-100 в 600 мл DEPC обработанной воды.
- TNB буфера: 100 мМ Трис-HCl, 8,3 мкг / мкл BSA, 0,15 М NaCl и 3% Тритон Х-100 в DEPC обработанной воды.
- ТЕ-буфера: 10 мМ Трис-HCl, рН 7,5 и 1 мМ ЭДТА, рН 7,5.
- Ацетилирование решение: 2,7 мл триэтаноламина плюс 0,5 мл уксусного ангидрида в 200 мл DEPC обработанной воды.
- Гибридизация решение: 50% формамида, 2X ГНПП, 2 мкг / мкл тРНК, 1 мкг / мкл BSA и 1 мкг / мкл поле в DEPC обработанной воды. Она нуждается в 16 л на секцию.
Ссылки
- Jin, L., Lloyd, R. V. In situ hybridization: methods and applications. J Clin Lab Anal. 11, 2-9 (1997).
- Stoler, M. H. In situ hybridization. Clin Lab Med. 10, 215-236 (1990).
- Komminoth, P., Werner, M. Target and signal amplification: approaches to increase the sensitivity of in situ hybridization. Histochem Cell Biol. 108, 325-3233 (1997).
- Kessler, C. The digoxigenin:anti-digoxigenin (DIG) technology--a survey on the concept and realization of a novel bioanalytical indicator system. Mol Cell Probes. 5, 161-205 (1991).
- Panoskaltsis-Mortari, A., Bucy, R. P. In situ hybridization with digoxigenin-labeled RNA probes: facts and artifacts. Biotechniques. 18, 300-307 (1995).
- Qian, X., Lloyd, R. V. Recent developments in signal amplification methods for in situ hybridization. Diagn Mol Pathol. 12, 1-13 (2003).
- Mello, C. V., Jarvis, E. D., Denisenko, N., Rivas, M. Isolation of song-regulated genes in the brain of songbirds. Methods Mol Biol. 85, 205-217 (1997).
- Pinaud, R. GABAergic neurons participate in the brain's response to birdsong auditory stimulation. Eur J Neurosci. 20, 1318-1330 (2004).
- Velho, T. A., Pinaud, R., Rodrigues, P. V., Mello, C. V. Co-induction of activity-dependent genes in songbirds. Eur J Neurosci. 22, 1667-1678 (2005).
- Tremere, L. A., Jeong, J. K., Pinaud, R. Estradiol shapes auditory processing in the adult brain by regulating inhibitory transmission and plasticity-associated gene expression. J Neurosci. 29, 5949-5963 (2009).
- Pinaud, R., Mello, C. V., Velho, T. A., Wynne, R. D., Tremere, L. A. Detection of two mRNA species at single-cell resolution by double-fluorescence in situ hybridization. Nat Protoc. 3, 1370-1379 (2008).
- Pinaud, R., Jeong, J. K. Duplex fluorescence in situ hybridization in the study of gene co-regulation in the vertebrate brain. Methods Mol Biol. 611, 115-129 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены