Method Article
Визуализация Митохондриальная ДНК репликации в отдельных клетках путем усиления сигнала EDU
В этой статье
Резюме
Мы разработали чувствительный метод для обозначения вновь синтезированных митохондриальной ДНК (мтДНК) в отдельных клетках для изучения мтДНК биогенеза. Техника объединяет включение образовательных вместе с tyramide усиления сигнала (TSA) протокол для визуализации мтДНК репликации в субклеточных отсеков нейронов.
Аннотация
Митохондрии являются ключевыми регуляторами клеточной энергии и митохондриального биогенеза является важным компонентом регулирования митохондрий номера в здоровые клетки 1-3. Один из подходов к мониторингу митохондриального биогенеза заключается в измерении скорости митохондриальной ДНК (мтДНК) репликации 4. Мы разработали чувствительный метод для обозначения вновь синтезированных мтДНК в отдельных клетках для изучения мтДНК биогенеза. Техника объединяет включения 5-этинил-2'-дезоксиуридина (EDU) 5-7 с tyramide усиления сигнала (TSA) 8 протокола для визуализации мтДНК репликации в субклеточных отсеков нейронов. EDU превосходит другие аналоги тимидина, такие как 5-бром-2-дезоксиуридина (BrdU), потому что первая реакция нажмите на этикетке EDU 5-7 не требует суровых лечения кислоты или фермента дайджестов, которые необходимы для раскрытия BrdU эпитопа . Мягкой маркировке Edu позволяет прямое сравнение его включения с других клеточных маркеров 9-10. Способность визуализировать и количественно мтДНК биогенеза обеспечивает необходимый инструмент для исследования механизмов, используемых для регулирования митохондриального биогенеза и даст представление о патогенезе связанных с наркотиками токсичности, старения, рака и нейродегенеративных заболеваний. Наш метод применим для сенсорных нейронов, а также другие типы клеток. Использование этой методики для измерения мтДНК биогенеза имеет большое значение в содействии пониманию как нормальных, так клеточной физиологии, а также негативно болезненных состояний.
протокол
1. Подготовка Нейроны
- Спинной корень ганглиев (DRG) нейроны, выращенные на стерильные (автоклавного) 12 мм стекла покровные в 24-луночных культуры пластины.
- 10 мМ запас EDU (в ДМСО, Click-IT EDU микропланшетов Пробирной Kit), как правило, разбавленного 1:100 в культуральной среде, чтобы сделать 10X решение EDU (100 мкМ), а затем разводят 1:10 в культуру скважин (например, 30 мкл 10X решение EDU в общей сложности 300 мкл питательной среды). DRG нейроны инкубировали с конечной концентрации 10 мкМ EDU при 37 ° С и 5% СО 2 между 2-24 часов. Продолжительность зависит от того, как лечение влияет на скорость синтеза мтДНК.
- В вытяжной шкаф, DRG нейроны устанавливаются в 2% параформальдегида в течение 10-15 минут при комнатной температуре, промывают два раза в 1X PBS 2-5 минут каждая мыть и хранить в свежем 1X PBS в течение 1 месяца при температуре 4 ° C.
- Покровные передаются с острым концом щипцов для подготовленных влажной камере (Corning биопроб блюдо с черными обоями дно для контраста, завернуть в алюминиевую фольгу для защиты светочувствительных компонентов и увлажняют водой, насыщенной Kimwipes) и размещены на листе парафильмом M, который обеспечивает гидрофобной поверхности, чтобы ограничить решения покровное. Протокол ниже на 28 покровные и решения готовятся для 32 покровные (около 14% дополнительного объема). Решения с дорогой или ограниченных компонентов сделаны так, что 75-80 мкл используются на каждом покровное. В противном случае, 200-300 мкл используют для мытья и блокировать решения тщательно промыть предыдущих решений.
- Повторно применять 1X PBS, чтобы покрыть поверхность каждой покровное (200-300 мкл). Подготовка Нажмите-IT анализа и tyramide усиления сигнала комплекты, как описано ниже и в инструкции производителя.
Подготовка Нажмите EDU-IT микропланшетов Пробирной Kit
Большинство компонентов из Нажмите EDU-IT Kit Пробирной микропланшетов приходят готовые и хранятся при температуре 4 ° С [2x Click-IT реакционного буфера (10x E Component), CuSO4 (100 мМ, компонентный F), нажмите-IT EDU фиксатором ( Компонент D) и блокировка буфера (2x компонент H)]. Кликните-IT EDU буфера Аддитивные (10x компонентов G) хранится при температуре -20 ° С, чтобы предотвратить его превращение желто-коричневый с течением времени. Этот компонент допускает повторяющихся циклов заморозки и оттаивания.
Орегон Зеленый 488 азид (компонент Б) следует разделить на небольшие порции (10-20 мкл), чтобы минимизировать циклов замораживания-оттаивания и хранится при температуре -20 ° C.
Для подготовки исходного раствора анти-Орегон Зеленый HRP конъюгата (компонент I), добавить 75 мкл Милли Q дН 2 O на флаконе. Смешать, осторожно пипеткой или инверсия, чтобы избежать пенообразования и хранить при 4 ° C. Не вихря.
Подготовка TSA Kit № 12, с HRP Коза Anti-IgG кролика и Alexa Fluor 488 Tyramide Kit
Для подготовки tyramide маточного раствора, растворите твердого материала (Alexa Fluor 488 tyramide, компонентный) в 150 мкл ДМСО (компонент B). Обратить флакон несколько раз, чтобы растворить любую tyramide покрытие стороны флаконе. Магазин маточного раствора в небольшой порции (10-20 мкл) при ≤ -20 ° C, сушеного и защищенном от света месте.
2. Click-это 5-этинил-2-дезоксиуридина (EDU) Маркировка
ПРИМЕЧАНИЕ: Все решения будут удалены с пипеткой лампа перевода с 200 мкл наконечник прикрепляется к концу, чтобы мягко удалить жидкость без потери клеток. Избегайте использования вакуумной линии, которые обычно удаляют решения слишком энергично. Колба пипетка используется, чтобы мягко наводнения покровные с 200-300 мкл промывочного решения тщательно промыть предыдущее решение.
- Клетки проницаемыми с 0,1% Triton-X-100 в растворе 1х PBS в течение 10 минут при комнатной температуре в закрытой влажной камере. Использование 1% Triton-X-100 растворы.
- Сделать 3000 мкл 0,1% Triton-X-100 путем добавления 300 мкл 1% Triton-X-100 акции 2700μL 1X PBS.
- Используйте 75-80 мкл на покровное.
- Удалить X-100 Triton раствора и прополоскать дважды 1X PBS.
- Эндогенная активность пероксидазы гасится 1% H 2 O 2 в растворе 1х PBS в течение 30 минут при комнатной температуре. Развести 30% H 2 O 2 решения с 1X PBS. Это решение должно быть свежим, но может быть сделано в течение 10 минут пермеабилизации ступеньку выше (шаг 3.1).
- Сделать 3000 мкл 1% H 2 O 2 путем добавления 100 мкл 30% Н 2 О 2 до 2900 мкл 1X PBS.
- Используйте 75-80 мкл на покровное.
- Удалить пероксидазы раствора и прополоскать дважды 1X PBS.
- Кликните-IT EDU Реакция
- Для 32 покровные (32 х 80 мкл =2560 мкл) в общей сложности 2560 мкл необходимо. 2x реакция сделана в 1280 мкл, которая составляет половину от общего объема реакции.
- Недавно подготовить Нажмите-IT Реакция Коктейль до начала 5 минут после исправления (шаг 3.5).
- Смешайте коктейль с помощью пипетки вверх и вниз. Не вихрь при принятии этой реакции.
2 х Реакция коктейль
Компоненты из Нажмите EDU-IT микропланшетов Пробирной KitПоловина Объем: 1280 мкл Милли Q дН 2 O 1132,8 мкл 2x Click-IT реакционного буфера (10x E Component) 100,3 мкл Кликните-IT EDU буфера Аддитивные (10x G Component) 25,6 мкл CuSO 4 (100 мМ, компонентный F) 25,6 мкл Орегон Зеленый азида (компонентный) 6,4 мкл Общий 1290,7 мкл
Примечание: объемы использованных выше пропорциональны объемам перечисленных в Click-IT EDU направлениях Пробирной микропланшетов комплект. Конечный объем Реакция Коктейль составляет немногим более 1280 мкл. - 2X Click-IT реакции разбавляют равным объемом Click-IT EDU фиксатором (Компонент D) непосредственно перед использованием. Смешивание их вместе делает единое решение для всех реакций покровные.
- Добавить 1290,7 мкл Click-IT EDU фиксатором (Компонент D) до 1290,7 мкл коктейля реакции. Используйте 75-80 мкл на покровное.
- После исправления нейронов с Click-IT EDU фиксатором (Компонент D) в течение 5 минут при комнатной температуре.
- Удалить исправить и добавить реакцию коктейль из выше (шаг 3.4). Крышка для защиты от света и инкубировать 25 минут при комнатной температуре. Аккуратно снимите Реакция коктейль. Промыть два раза разбавленным 1X блокирующего буфера (2х компонент H).
- Сделать 5200 мкл 1X блокирующего буфера путем разбавления 2600 мкл блокирующего буфера (2x компонент Н) с равным объемом MilliQ г H 2 O (2600 мкл). Используйте 75-80 мкл на покровное.
- Под эпи-флуоресцентного микроскопа, проверьте, Орегон Зеленый окрашивания в ядрах митотически активных клеток контроля.
3. Tyramide Усиление сигналов (TSA) образовательных сигнала
- Добавьте 1% АСП блок раствора в каждую покровное и инкубировать 30 минут при комнатной температуре.
- Сделать 6000 мкл 1% раствора блок TSA путем взвешивания 0,06 г АСП Blocking Reagent (TSA комплект № 12, компонентный D) и добавить его в 6000 мкл 1X PBS. Vortex перемешать. Добавление 5% козьего сыворотки в 1% растворе блок TSA будет часто помогают уменьшить неспецифическое связывание.
- Кратко спин анти-Орегон Зеленый пероксидазой хрена сопряженных фондовом антител (компонент I в Click-гТ Пробирной EDU микропланшетов), подготовленный 2-24 часов до АСП. Развести первичных антител 1:300 в 1% АСП блокирующий раствор и инвертировать или пипетки вверх и вниз, аккуратно перемешать. Не вихрь, чтобы избежать нарушения HRP-конъюгированных антител. Удалить 1% АСП блока решение, добавьте 75 мкл каждого покровное и инкубировать в течение ночи при 4 ° C.
- Антитела могут быть использованы более концентрированным, такие, как 1:150, но он поставляется в ограниченных количествах, так что используйте его с осторожностью. Опять же, добавление 5% козьего сыворотки в 1% растворе блок TSA будет часто помогают уменьшить неспецифическое связывание анти-Орегон Зеленый пероксидазой хрена конъюгированных антител.
- Сделать 2560 мкл 1:300 раствор антител путем добавления 8,53 мкл фондовом Кролик анти-Орегон Green-HRP (Click-яТ EDU микропланшетов Пробирной) до 2560 мкл 1% АСП блокировки. Смешать, осторожно пипеткой или инверсия.
- На следующий день, удалить раствор антител и полоскать три раза 1X PBS. Инкубируйте покровных в последней промывки для дополнительных 30-60 минут при комнатной температуре, чтобы несвязанных первичных антител удаляется.
- Подготовка Tyramide реакцию на 2560 мкл (32 покровные х 80 мкл).
- Сделать 400 мкл 0,15% H 2 O 2 решения (100X) путем добавления 2 мкл 30% H 2 O 2 (TSA комплект № 12, компонентный F) до 398 мкл буфера Усиление (TSA комплект № 12, компонентный Е) . Это должно быть сделано непосредственно перед необходимы.
- Для конечного объема 2560 мкл сочетать:
- 25,6 мкл Tyramide-488 (ВСТ набор компонентов)
- 2508,8 мкл буфера Усиление (TSA набор компонентов E)
- 25,6 мкл 0,15% H 2 O 2 (сверху для окончательного 0,0015% H 2 O 2)
- Удалить 1X PBS и инкубировать с Tyramide реакции в течение 15 минут при комнатной температуре.
- Удалить Tyramide реакции и полоскать три раза 1X PBS, вынашиваются в последней промывки в течение 30-60 минут при комнатной температуре, как раньше.
- Проверьте мтДНК маркировки под эпи-флуоресцентного микроскопа.
- Горы покровные на слайдах стекла микроскопа с antifade монтажа среды, такие как продление Золото с DAPI. Кроме того, маркировка EDU и усиления может сопровождаться стандартные люминесцентные иммуноцитохимии для обозначения других клеточных маркеров.
4. Представитель Результаты: Визуализация Митохондриальная ДНК репликации в качестве маркера для митохондриальной биогенеза
Мы заинтересованы в том, как сенсорные нейроны (рис. 1) регулировать количество митохондрий. Этот протокол будет этикетке вновь синтезированных мтДНК с флуоресцентным маркером, как способ измерения новых митохондрий. Включение синтетической нуклеотидной EDU затем нажмите химии Oregon Green-азид и последующего усиления с Alexa Fluor 488-tyramide приводит к маркировке мтДНК с зеленого флуоресцентного сигнала (рис. 2). Если все сделано правильно, усиливается зеленый сигнал достаточно выше, чем фоновой флуоресценции (например, сотовые аутофлюоресценция или побочный эффект HRP-АСП реакции).
Эта техника предназначена для обозначения новообразованных мтДНК для того, чтобы визуализировать и количественно мтДНК биогенеза в субклеточных отсеков нейронов (рис. 3). Маркировки Edu позволяет для последующего флуоресцентного иммуноцитохимии для обозначения других клеточных маркеров, таких как нейрофиламентов (рис. 3D).
Реакция TSA также может быть сделано с другими люминесцентными Alexa Fluor tyramides такие как Alexa Fluor 594-tyramide. В результате зеленый флуоресцентный сигнал ядерной от Oregon Green-азид нажмите реакции в ядре, но не зеленый сигнал в мтДНК, которая не обнаруживается до АСП. Усиления с Alexa Fluor 594-tyramide усиливает ядерной этикетки и показывает, включены EDU в мтДНК с красного флуоресцентного сигнала (рис. 4). Аналогичная процедура усиления используется для визуализации BrdU включения в вновь синтезированных мтДНК (рис. 5), однако, этот метод требует дополнительного шага для восстановления BrdU эпитопа либо суровых кислоты (HCl) или фермента вставку, которая не является необходимой для EDU маркировки.
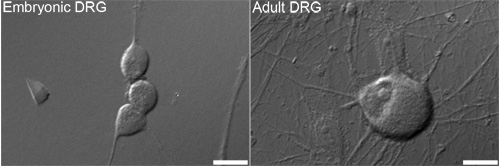
Рисунок 1. Представитель дифференциального интерференционного контраста (DIC) изображений эмбриональных (слева) и взрослых (справа) спинной ганглий корня (DRG) нейронов, которые обычно используются для анализа. Bars = 10 мкм.
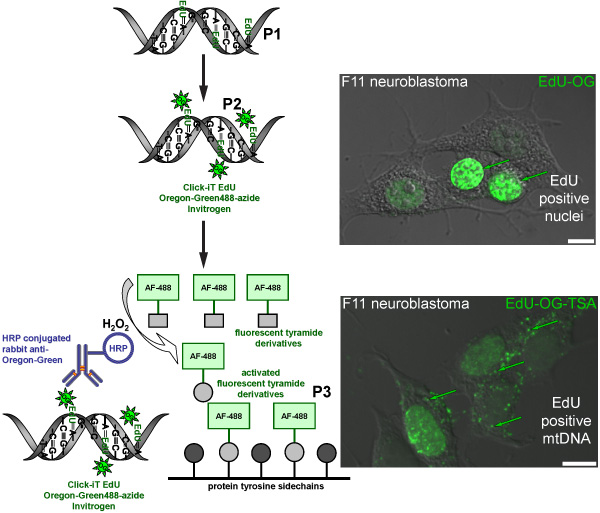
Рисунок 2. Схема представляющих порядок маркировки EDU в мтДНК с зеленого флуоресцентного сигнала. Схема представляет трехступенчатую протокол для маркировки EDU в мтДНК с зеленого флуоресцентного сигнала. Митотически активные клетки нейробластомы F11 служить в качестве положительного контроля и проиллюстрировать маркировки модель образовательных, которая была включена в ядерной и митохондриальной ДНК. Первый шаг (P1) является включение тимидина в аналоговом вновь синтезированных мтДНК путем инкубации клеток в присутствии EDU. Второй этап (P2) основана на кнопку химии для обозначения включены EDU с Oregon Green-азида. Зеленый сигнал виден в ядрах клеток, что реплицировать свою ядерную ДНК. Последний шаг (P3) для усиления Орегон Grееп-азид сигнала путем инкубации с HRP-сопряженных кролика антитела против Орегон Зеленый последующей инкубацией с Alexa Fluor 488 меченых tyramide в присутствии перекиси водорода (H 2 O 2) для визуализации зеленый сигнал в мтДНК.
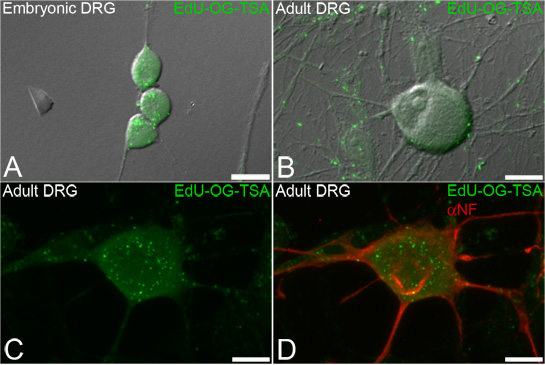
Рисунок 3. EDU маркировки мтДНК в спинной ганглий корня (DRG) нейронов. Нейроны инкубировали с EDU и сигнал затем усиливается выявить мтДНК, которые включены EDU. Представитель флуоресцентные изображения накладывается на проходящем свете показывает зеленые точечные сигналы усиливаются EDU (EDU-ОГ-TSA, зеленый) включен в недавно синтезированных мтДНК как эмбриональные () и взрослых (BD) DRG нейроны. Процедура EDU маркировки позволяет для последующего иммунофлуоресцентного метода нейронных маркеров, таких как нейрофиламентов (D, αNF, красным цветом). Шкала баров = 10 мкм.
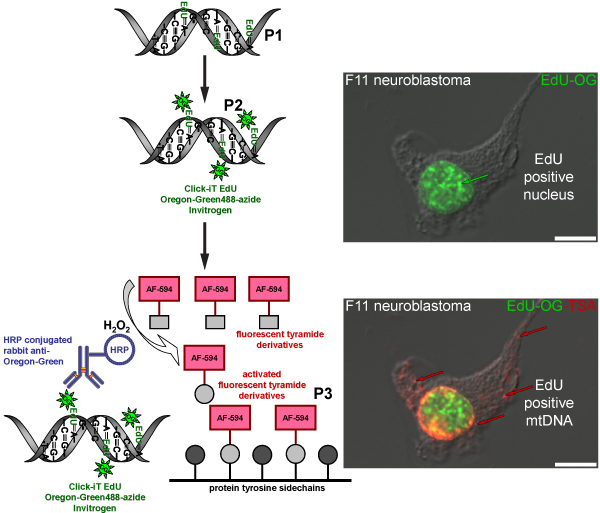
Рисунок 4. Схема представляющих порядок маркировки EDU в мтДНК с красного флуоресцентного сигнала. Схема представляет трехступенчатую протокол для маркировки EDU в мтДНК с красного флуоресцентного сигнала. Митотически активные клетки нейробластомы F11 служить в качестве положительного контроля и проиллюстрировать маркировки модель образовательных, которая была включена в ядерной и митохондриальной ДНК. Первый шаг (P1) является включение тимидина в аналоговом вновь синтезированных мтДНК путем инкубации клеток в присутствии EDU. Второй этап (P2) основана на кнопку химии для обозначения включены EDU с Oregon Green-азида. Зеленый сигнал виден в ядрах клеток, что реплицировать свою ядерную ДНК. Последний шаг (P3) для усиления Oregon Green-азид сигнала путем инкубации с HRP-сопряженных кролика антитела против Орегон Зеленый последующей инкубацией с Alexa Fluor 594 меченых tyramide в присутствии перекиси водорода (H 2 O 2) для визуализации красный сигнал в мтДНК.
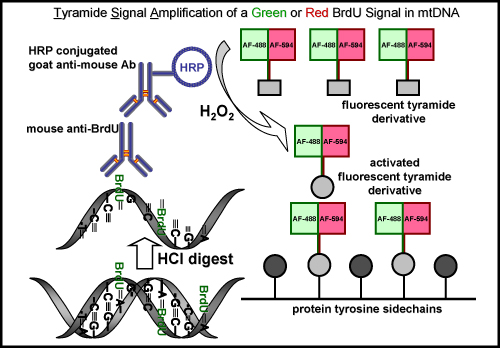
Рисунок 5. BrdU маркировки и tyramide усиления сигнала с зеленого или красного флуоресцентного сигнала в мтДНК. Схема представляет порядок маркировки BrdU во вновь синтезированных мтДНК либо зеленый или красный флуоресцентный сигнал. Первым шагом является необходимой для восстановления BrdU эпитопа либо кислоты (HCl) или фермента вставку, которая не является необходимой для маркировки EDU. Следующим шагом является инкубации с помощью мыши первичных анти-BrdU антителами. За ними следуют путем инкубации с пероксидазой хрена (HRP)-сопряженных антимышиного антител. Наконец, сигнал усиливается с зеленым или красным цветом помечены флуоресцентно tyramide в присутствии перекиси водорода (H 2 O 2) для визуализации сигнала в мтДНК.
Обсуждение
Мы разработали чувствительный анализ для обозначения вновь синтезированных мтДНК в отдельных клеток с использованием tyramide усиления сигнала EDU. Одна из самых больших проблем во время оптимизации этого протокола было противоречивым результатам между покровные. Изменения были внесены в Invitrogen комплект протоколов, чтобы избежать смешивания небольших объемов по отдельным покровные и принятия решений мастер, используемый для всех покровные. 75-80 мкл для каждого 12 мм круговую стекло покровное является идеальным объемом, чтобы полностью покрыть площадь поверхности, обеспечивая при этом достаточно решения дают согласующиеся результаты между образцами. Инкубационный раз и концентрации реагентов были оптимизированы, но улучшений можно рассматривать с поправкой на них.
Протокол предназначен для работы каждого процесса один раз. Однако некоторые шаги были повторяется с новыми решениями для восстановления образцы, которые не после первой попытки. В частности, нажмите EDU реакции шагов (3,4-3,6) были повторены без значительного увеличения фоновой флуоресценции. Анти-Oregon Green-HRP антител инкубации (4.1-4.3) и tyramide усиления (4,4-4,5) шаги были также повторяется, но чаще приводит к плохой сигнал-шум из-за повышенного фона флуоресценции.
Наиболее чувствительных реагентов Нажмите EDU-IT буфера Аддитивные (компонент G) и кроличьих анти-Орегон Green-HRP антител (компонент I) от Click-IT EDU комплект Пробирной микропланшетов. Кликните-IT EDU буфера Аддитивные постепенно желтеет со временем при хранении при 4 ° С, а также между 6-12 месяцев значительно темнеет. Хранение Click-IT EDU буфера Аддитивные при температуре -20 ° С, снимет эту проблему. Маркировки и tyramide шаги усиления работают лучше, когда кролик анти-Орегон Green-HRP антител используется в течение 4-6 месяцев воссоздания его в MilliQ дН 2 O.
Мягкая маркировка EDU в мтДНК позволяет прямое сравнение с дополнительными сотовой маркеров 9-11 и повышает полезность этого метода по сравнению с другими аналогами тимидина, такие как 5-бром-2-дезоксиуридина (BrdU), которая требует жестокого обращения для восстановления его эпитопом в ДНК. Наша лаборатория 11-12 и 13-15 других успешно использовали BrdU маркировать мтДНК. Техника BrdU маркировки похож на той, которая используется для EDU, но есть некоторые важные различия (рис. 5). После пермеабилизации шаг, перечисленных выше (3.1-3.2), BrdU эпитопа восстанавливается с денатурации шаг (2 N HCl в течение 30 мин при 37 ° С за которым следуют три моет в 1X PBS). BrdU затем помечены первичными антителами против BrdU (Vector Laboratories разбавленным 1:50 в 1% блокирующий раствор из TSA комплект и инкубировали в течение ночи при температуре 4 ° С). Вторичные антитела шаг необходим для усиления сигнала BrdU (антимышиного IgG конъюгированных с HRP от TSA комплектов № 2 и № 5, разбавленного 1:100 в 1% блокирующий раствор и выдерживают в течение 45 мин при комнатной температуре) до TSA шагов (4,3-4,5 выше). Наличие двух тимидина аналогов, EDU и BrdU, чтобы маркировать мтДНК является выгодным для выполнения двойной экспериментов этикетку мтДНК можно последовательно помечены в импульсно-маркировки парадигмы 11.
Наша лаборатория использует EDU и BrdU маркировки мтДНК для изучения регуляции митохондриального биогенеза в контексте диабетической невропатии, частым осложнением сахарного диабета. Мы успешно использовали усиления сигнала для измерения изменений в мтДНК биогенеза в отдельных нейронов 11-12. Эта техника будет полезна и в других экспериментах, направленных на изучение механизмов репликации мтДНК и оборота или для выявления препаратов, которые подавляют синтез мтДНК. Кроме того, основные принципы усиления сигналов EDU и BrdU могут быть применены в других исследованиях, которые измеряют репликации ДНК или ремонта.
Раскрытие информации
Благодарности
Работа выполнена при поддержке Национального института здоровья Гранты NS-38849 и DK-076160, детского диабета исследовательский фонд Центра по изучению осложнений при сахарном диабете, программы по неврологии Исследования и Открытия и Альфред Таубман А. Институт медицинских исследований в Университет штата Мичиган. Эта работа использованы Морфология и анализ изображений Ядро Мичиган диабета Научно-учебный центр, который финансируется Национальным институтом здоровья Грант 5P60 DK-20572 от Национального института диабета, желудочно-кишечных и почечных заболеваний. Авторы выражают благодарность Т. Скотт Кларк из молекулярных проб / Invitrogen за ценные советы по различным Нажмите EDU-IT маркировки наборы и щедрое пожертвование реагентов для поддержки первоначального развития техники усиления EDU.
Материалы
| Name | Company | Catalog Number | Comments |
| 12 mm coverslips | Fisher Scientific | 12-545-82 | |
| 245 mm x 245 mm BioAssay Dish | Corning | 431111 | |
| Parafilm M | Fisher Scientific | PM-996 | |
| paraformaldehye | Sigma-Aldrich | P6148 | |
| Triton X-100 | Sigma-Aldrich | T-8532 | |
| Phosphate buffered saline 10X solution | Fisher Scientific | BP399 | |
| Transfer Pipet | Fisher Scientific | 13-711-7M | |
| Hydrogen peroxide, 30% in water | Fisher Scientific | BP2633 | |
| Click-iT EdU Microplate Assay Kit | Invitrogen | C10214 | |
| TSA Kit #12, with HRP—goat anti-rabbit IgG and Alexa Fluor 488 tyramide | Invitrogen | T20922 | |
| TSA Kit #15, with HRP–goat anti-rabbit IgG and Alexa Fluor 594 tyramide | Invitrogen | T20925 | |
| ProLong Gold antifade reagent with DAPI | Invitrogen | P-36931 | |
| Polyclonal rabbit Neurofilament antibody | Chemicon International | AB1981 | |
| Mouse monoclonal anti-BrdU antibody | Vector Laboratories | VP-B209 | |
| TSA Kit #2, with HRP—goat anti-mouse IgG and Alexa Fluor 488 tyramide | Invitrogen | T20912 | |
| TSA Kit #5, with HRP—goat anti-mouse IgG and Alexa Fluor 594 tyramide | Invitrogen | T20915 |
Ссылки
- Chan, D. C. Mitochondrial fusion and fission in mammals. Annu. Rev. Cell Dev. Biol. 22, 79-99 (2006).
- Dimmer, K. S., Scorrano, L. (De)constructing mitochondria: what for. Physiology (Bethesda). 21, 233-241 (2006).
- Suen, D. F., Norris, K. L., Youle, R. J. Mitochondrial dynamics and apoptosis. Genes Dev. 22, 1577-1590 (2008).
- Clay Montier, L. L., Deng, J. J., Bai, Y. Number matters: control of mammalian mitochondrial DNA copy number. J. Genet. Genomics. 36 (3), 125-131 (2009).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proc Natl Acad Sci U.S.A. 105, 2415-2420 (2008).
- Buck, S. B., Bradford, J., Gee, K. R., Agnew, B. J., Clarke, S. T., Salic, A. Detection of S-phase cell cycle progression using 5-ethynyl-2'-deoxyuridine incorporation with click chemistry, an alternative to using 5-bromo-2'-deoxyuridine antibodies. Biotechniques. 44, 927-929 (2008).
- Yu, Y., Arora, A., Min, W., Roifman, C. M., Grunebaum, E. EdU incorporation is an alternative non-radioactive assay to [(3)H]thymidine uptake for in vitro measurement of mice T-cell proliferations. J Immunol Methods. 350 (1-2), 29-35 (2009).
- Heusden, J. V. a. n., Jong, P. d. e., Ramaekers, F., Bruwiere, H., Borgers, M., Smets, G. Fluorescein-labeled tyramide strongly enhances the detection of low bromodeoxyuridine incorporation levels. J. Histochem. Cytochem. 45 (2), 315-319 (1997).
- Cappella, P., Gasparri, F., Pulici, M., Moll, J. A novel method based on click chemistry, which overcomes limitations of cell cycle analysis by classical determination of BrdU incorporation, allowing multiplex antibody staining. Cytometry A. 73, 626-636 (2008).
- Kaiser, C. L., Kamien, A. J., Shah, P. A., Chapman, B. J., Cotanche, D. A. 5-Ethynyl-2'-deoxyuridine labeling detects proliferating cells in the regenerating avian cochlea. Laryngoscope. 119, 1770-1775 (2009).
- Lentz, S. I., Edwards, J. L., Backus, C., McLean, L. L., Haines, K. M., Feldman, E. L. Mitochondrial DNA (mtDNA) Biogenesis: Visualization and Duel Incorporation of BrdU and EdU Into Newly Synthesized mtDNA In. Vitro. J Histochem Cytochem. 58 (2), 207-218 (2010).
- Edwards, J. L., Quattrini, A., Lentz, S. I., Figueroa-Romero, C., Cerri, F., Backus, C., Hong, Y., Feldman, E. L. Diabetes regulates mitochondrial biogenesis and fission in mouse neurons. Diabetologia. 53 (1), 160-169 (2010).
- Davis, A. F., Clayton, D. A. In situ localization of mitochondrial DNA replication in intact mammalian cells. J. Cell Biol. 135, 883-893 (1996).
- Magnusson, J., Orth, M., Lestienne, P., Taanman, J. W. Replication of mitochondrial DNA occurs throughout the mitochondria of cultured human cells. Exp. Cell. Res. 289, 133-142 (2003).
- Amiri, M., Hollenbeck, P. J. Mitochondrial biogenesis in the axons of vertebrate peripheral neurons. Dev. Neurobiol. 68, 1348-1361 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены