Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение клапанные эндотелиальных клеток
В этой статье
Резюме
Мы предлагаем метод выделения и культивирования чистых популяций клапанов сердца эндотелиальных клеток (VEC). VEC может быть изолирован от обеих сторон пороге или листовку и сразу после, лежащие в основе интерстициальная клетка (ВМЦ) изоляции прост.
Аннотация
Сердце клапаны полную ответственность за сохранение однонаправленный поток крови через сердечно-сосудистой системы. Эти тонкие, волокнистые ткани подвергаются значительным механическим нагрузкам, как они открываются и закрываются в несколько миллиардов раз срок службы. Невероятная выносливость этих тканей происходит из-за резидентом клапанной эндотелия (VEC) и интерстициальные клетки (ВМЦ), которые постоянно ремонта и реконструируют в ответ на местные механические и биологические сигналы. Только недавно мы начали понимать уникальное поведение этих клеток, для которых в лабораторных экспериментов сыграло ключевую роль. Особенно сложным является изоляция и культуры VEC. Особое внимание должно быть использовано с момента ткань удаляется от хоста через окончательного покрытия. Здесь мы представляем протоколы для прямого изоляции, боковые конкретных изоляции, культуры, и проверка чистых популяций VEC. Мы используем ферментативного пищеварения следуют нежный технику соскабливания тампон, чтобы выбить только клетки поверхности. Эти клетки затем собирают в трубку и центрифугировали в гранулах. Осадок затем ресуспендировали и высевают в культуру колбы предварительно покрытых с коллагеном I матрицы. VEC фенотип подтверждается контакт ингибирует рост и экспрессию эндотелиальных специфических маркеров, таких как PECAM1 (CD31), фактор фон Виллебранда (фВ), и негативные выражения альфа-актин гладких мышц (α-SMA). Функциональные характеристики VEC связаны с высоким уровнем ЛПНП ацетилированного. В отличие от сосудистых эндотелиальных клеток, VEC имеют уникальную способность трансформироваться в мезенхимы, которое обычно происходит во время эмбрионального формирование клапана 1. Это также может произойти во время значительно увеличивал сливной должность в пробирке культуру, поэтому следует позаботиться должны быть направлены на прохождение в или около слияния. После выделения VEC, чистых популяций VIC могут быть легко приобретены.
протокол
1. Подготовка
- Автоклав в закрытом лотке инструментов следующие пункты:
- Зазубренные ткани щипцы - для обработки тканей листовки
- Ткань ножницы (8 см) - для обрезки ткани буклета, а также точками возврата
- Ватные тампоны - для выделения эндотелиального слоя из буклет или параболическими
- Сделать стерильный раствор коллагеназы
- Добавить 4,0 г порошкообразной DMEM до 250 мл 18 МОм воды.
- Добавить 1,11 г натрия бикарбоната.
- Добавить (600 ЕД / мл), 180 000 единиц коллагеназы.
- Добавить 1% (3 мл) Пенициллин / стрептомицин.
- Отрегулируйте рН раствора до 7,2.
- Доведите раствор до 270 мл.
- Стерилизовать раствор, проходя через фильтр 0,2 мкм.
- Добавить 10% (30 мл) стерильной эмбриональной телячьей сыворотки.
- Сделать стерильной среде эндотелиальные клетка
- Добавить 6,7 граммов порошкообразного DMEM до 400 мл 18 МОм воды.
- Добавить 1,85 г натрия бикарбоната.
- Добавить (50 ед / мл) 25000 единиц гепарина.
- Добавьте 1% (5 мл) Пенициллин / стрептомицин.
- Отрегулируйте рН раствора до 7,2.
- Доведите раствор до 450 мл.
- Стерилизовать раствор, проходя через фильтр 0,2 мкм.
- Добавить 10% (50 мл) стерильной эмбриональной телячьей сыворотки.
- Сделать стерильной среде интерстициальная клетка
- Добавить 13,37 граммов порошкообразного DMEM до 800 мл 18 МОм воды.
- Добавить 3,7 г натрия бикарбоната.
- Добавить 1% (10 мл) Пенициллин / стрептомицин.
- Отрегулируйте рН раствора до 7,2.
- Доведите раствор до 900 мл.
- Стерилизовать раствор, проходя через фильтр 0,2 мкм.
- Добавить 10% (100 мл) стерильного бычьего сывороточного.
2. Выделение Листовки клапанов сердца
- Акцизный корня аорты сразу и асептически из сердца после жертвоприношения.
- Тщательно промойте корня аорты крови с холодного стерильного DPBS. Крайне важно, чтобы удалить все компоненты крови как можно скорее ограничить VEC смерти и бактериального загрязнения. Антибиотики и противогрибковые не советуют на этом этапе, так как они являются потенциально опасными для VEC.
- Изолировать створок (3 на клапан) прямо с корнем и место в стерильные 15 мл коническую трубку, наполненную 12 мл холодной DPBS. Встряхните несколько раз, чтобы убрать мусор и пополнить свежими DPBS.
- Транспорт в лабораторию на льду.
- По прибытии в лабораторию, поместите контейнер с тканью под стерильный капотом.
3. Выделение слоя эндотелиальных
- Заполните стерильные 35 мм блюдо с 3 мл холодного раствора коллагеназы на клапан (3 листовки).
- Поместите все три листовки от 15 мл трубку в блюдо заполнено коллагеназы решение.
- Инкубируйте ткани в течение 5-10 минут при температуре 37 ° C.
- Аккуратно снимите слой эндотелиальных поворотом сухих стерильных тампона на поверхность листовку. Направление вращения и количество сдвига применяется крайне важно для чистоты вашего образца. Вращение тампона должны быть в обратном направлении к линейным движением руки создания контролируемого сдвига. Этот сдвиг является то, что подъемники эндотелиальных клеток из ткани. Количество силы, приложенной должно быть достаточно, чтобы чувствовать сопротивление тканей, но не проникают базальной мембраны.
- Иногда, приложите тампон внутри коллагеназы решение сместить клетки от кончика волокна. После моечные завершения текстуру эндотелиальных слой должен чувствовать себя немного более гладкой, чем раньше.
- Сбор суспензии клеток / коллагеназа и трансфер в новые стерильные 15 мл трубки.
- Центрифуги трубы при 1000 оборотов в минуту в течение 5 минут, чтобы гранулы любых изолированных клеток и аспирации супернатант. Если изоляция интерстициальные клетки, а также, выполнять этот протокол, в то время как эти клетки в настоящее время центрифугировали.
- Добавьте 3 мл эндотелиальных среды свиней на 15 мл пробирок, центрифуги второй раз, и аспирата СМИ. Это второй центрифугирования помогает фильтр некоторых нежелательных материалов, таких как кончик волокна.
- Повторное приостановить центрифугировали эндотелиальных клеток в 5 мл эндотелиальных среду свиного и пластины клеток в предварительно покрытых Т-25 колбу с коллагеном (используйте 1 флакон в центрифуге трубки).
- Пусть клетки растут по крайней мере за 2-3 дня до изменения эндотелиальных среды. Это помогает клеткам восстановиться и разделить с изоляцией процесс довольно жесткие и клетка выход может быть низким. Очень важно, чтобы переход клетки возле слияния с контактного торможения может привести к клеточной трансформации.
4. Подготовка 60 мм культуры Блюдо для стороны Конкретные Изоляция
- Линия 60 мм стеклянных чашках Петри с алюминиевой фольгой (2 стеклянная посуда в leafleт). Алюминиевой фольги помогает снять парафин, таким образом, чтобы стеклянном блюде Петри могут быть повторно использованы для других выделений.
- Место парафин бисером в блюдах, около половины полном объеме, и крышка для автоклавирования.
- После автоклавирования, является полной и парафин расплавляется, переместить блюдо ансамбля в прохладное плоской поверхности. Как парафин остынет, он затвердеет и создать слой, который будет поддерживать иглой проколы.
- Через 30 минут стерилизовать блюдо может быть использован в качестве изоляции камеры для иммобилизации листовки ткани.
5. Выделение сторона Конкретные Эндотелиальная слоя
- Удалить листовки от 15 мл пробирки и поместите на подготовленную 60мм блюдо культуры стороне конкретные изоляции.
- Манипулирование листовки, чтобы ventricularis сторона лицевой стороной вниз на поверхности парафина оставив стороне фиброзный подвергается. Pin края листовки подвергать эндотелиальных слоя.
- Поместите несколько капель холодной коллагеназы на каждом (вверх-облицовки) эндотелиальных поверхность и инкубировать ткани в течение 5-10 минут при температуре 37 ° C.
- Как и прежде, аккуратно удалить слой эндотелиальных поворотом сухих стерильных тампона на поверхность листовку. Направление вращения и количество сдвига применяется крайне важно для чистоты вашего образца. Вращение тампона должны быть в обратном направлении к линейным движением руки создания контролируемого сдвига. Этот сдвиг является то, что подъемники эндотелиальных клеток из ткани и больше ничего. Количество силы, приложенной должно быть достаточно, чтобы чувствовать сопротивление ткани, но, не проникает в ткани.
- Иногда, приложите тампон внутри коллагеназы решение сместить клетки от кончика волокна. После моечные завершения текстуру эндотелиальных слой должен чувствовать себя немного более гладкой, чем раньше.
- Сбор суспензии клеток / коллагеназа и трансфер в новые стерильные 15 мл трубки. Укажите сторону специфику на этикетке (листовки с того же клапан может быть объединены вместе).
- Передача листовки новое блюдо культуры, чтобы ventricularis сторона в настоящее время подвергается и повторите шаги (5.3-5.6).
- После того как все клеточной суспензии / коллагеназа собирается, центрифуги трубы при 1000 оборотов в минуту для 5 минут, чтобы гранулы любых изолированных клеток и аспирации супернатант. Если изоляция интерстициальные клетки, а также, выполнять этот протокол, в то время как эти клетки в настоящее время центрифугировали.
- Добавьте 3 мл эндотелиальных среды свиней в трубах, центрифуги второй раз, и аспирата СМИ. Это второй центрифугирования помогает фильтр некоторых нежелательных материалов, таких как кончик волокна.
- Повторное приостановить центрифугировали эндотелиальных клеток в 5 мл эндотелиальных среду свиного и пластины клеток в предварительно покрытых Т-25 колбу с коллажем (используйте 1 флакон в центрифуге трубки).
- Пусть клетки растут по крайней мере за 2-3 дня до изменения эндотелиальных среды. Это помогает клеткам восстановиться и разделить с изоляцией процесс довольно суровым. Если вы заметили, доходность будет очень низкой, рассмотреть вопрос о переходе к меньшим колбу или хорошо пластины с межклеточной адгезии способствует росту клеток. Не забудьте проход возле слияния с контактного торможения может привести к клеточной трансформации.
6. Выделение интерстициальные клетки
- Заполните стерильные 15 мл центрифужную пробирку с 10 мл раствора на коллагеназы клапана (3 листовки).
- После моечные листовки эндотелиальных клеток, сразу же поместить их в соответствующие 15мл трубка с коллагеназы решение.
- Инкубируйте в течение примерно 12 до 18 часов (мягко агитировать по желанию).
- Смешайте деградированных ткани осторожно серологические пипетки до клеточной суспензии / коллагеназа становится гомогенизации. Это гомогенизации помогает разрушить ткань и освободить интерстициальные клетки.
- Центрифуга переваривается ткани в течение 5 минут при 1000 оборотах в минуту и аспирации супернатант.
- Добавьте 5 мл интерстициальная среда свиней на 15 мл пробирки, центрифугируют второй раз, и аспирата supernate.
- Повторное приостановить центрифугировали эндотелиальных клеток в 5 мл интерстициальная среда свиней и пластины клеток в Т-75 колбе (используйте 1 флакон в центрифуге трубки).
- Пусть клетки растут по крайней мере за 1-2 дня до изменения интерстициальной среда клетки. Там будет гораздо больше мусора, чем ткани с эндотелиальных клеток, но, что не ожидается. Клетки также должны вырасти до слияния быстрее, чем эндотелиальные клетки из-за выхода клеток и их характер.
7. Представитель Изображения

Рисунок 1. Морфологии изолированных клеток на 2-3 дней после изоляции. (А) VEC выставке типичной морфологией и эндотелиальных образуют кластеры, чтобы стимулировать экономический рост. (B) VIC морфологии похож на миофибробластов которые обычно веретенообразную форму и распространяться равномерно в течение колбу.
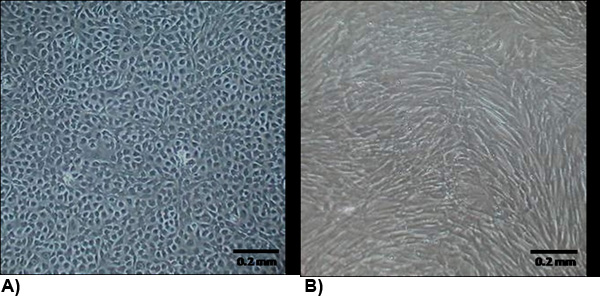
Рисунок 2. Морфологии изолированных клеток слияния. (А) VEC выставке типичной морфологией эндотелиальных которые, как правило, булыжник и роста контакт запрещена. (B) VIC морфологии похож на миофибробластов которые обычно веретенообразную форму, а не рост контакт запрещена.
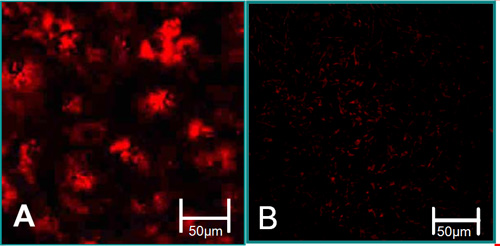
Рисунок 3. Функция характеристики изолированных клеток 6. (А) VEC связаны с высоким уровнем ЛПНП ацетилированного поглощения (красный). (B) ВИК связаны с низким уровнем ЛПНП ацетилированного поглощения.
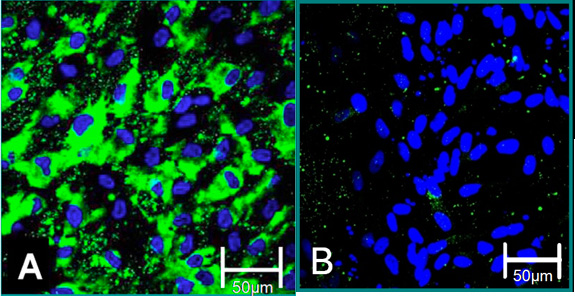
Рисунок 4. Сотовой маркеров изолированных клеток 6. (А) VEC фенотип способствовало положительное окрашивание на фактор фон Виллебранда (зеленый), синий (ядер). (B) VIC фенотип способствовал негативный окрашивание на фактор фон Виллебранда.
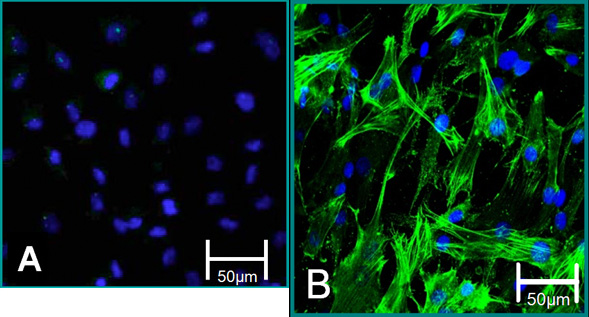
Рисунок 5. Сотовой маркеров изолированных клеток. (А) VEC фенотип способствовала отрицательная окраска для альфа-SMA (зеленый), синий (ядер). (B) VIC фенотип способствовало положительное окрашивание для альфа-SMA.
| Диссоциация агент | Диссоциация Техника | Сотовые коллекции | Количество сотовых | Ячейка Чистота | Загрязнение |
| ЭДТА (3 мм) без CaCl 2 | 5, 20, 60 мин. до того CaCl 2 | 20, 60, 120 мин. до сбора | - | + / - | + + + |
| ЭДТА (6 мм) без CaCl 2 | 5, 20, 60 мин. до того CaCl 2 | 20, 60, 120 мин. до сбора | + / - | + | + + + |
| Трипсин-EDTA (0,5 г / л) | 5, 10, 15 мин. до деактивации | Средний собраны сразу | + | + | + + |
| Коллагеназы II (300 ЕД / мл) | 5, 10, 15 мин. до деактивации | Средний собраны сразу | -, +, + + | -, + + + | + |
| Коллагеназы II (600 ЕД / мл) | 5, 10, 15 мин. до деактивации | Средний собраны сразу | +, + + + + + | + +, + +, - | - |
Таблица 1. Результаты предварительных клапанной эндотелиальных протоколов изоляторе.
Обсуждение
Понимание клапанной биологии была нарушена технические трудности выделения и культивирования чистых популяций клапанной эндотелиальных клеток. Типичные методы изоляции включают ферментативного переваривания основных базальных матрицы или химической диссоциации эндотелиальных о...
Раскрытие информации
Благодарности
Это исследование проводится при поддержке NSF КАРЬЕРА награду, Хартвелл Фонда и Американской ассоциации сердца (# 0830384N).
Материалы
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium | Mediatech, Inc. | 50-103-PB | |
| Fetal Bovine Serum | GIBCO, by Life Technologies | 26140 | |
| Penicillin Streptomycin | GIBCO, by Life Technologies | 15140-122 | |
| 0.25% Trypsin-EDTA | GIBCO, by Life Technologies | 25200 | |
| Heparin Sodium Salt | Sigma-Aldrich | H4784-1G | |
| Collagenase Type 2 | Worthington Biochemical | LS004176 | |
| DPBS | GIBCO, by Life Technologies | 21300-058 | |
| Rat Tail Collagen | BD Biosciences | 354236 | |
| Critical Swabs | VWR international | 89031-270 | |
| Sodium Bicarbonate | Sigma-Aldrich | 55761 | |
| T25 Flasks | BD Biosciences | 353018 | |
| T75 Flasks | BD Biosciences | 353136 | |
| 24 Well Plate | Falcon BD | 353047 | |
| 60x15 mm Dishes | VWR international | 25384-092 | |
| 60x15 Glass Dishes | VWR international | 89000-310 | |
| Paraffin Embedding Wax | Electron Microscopy Sciences | 19304-01 | |
| Precision Glide Needles | BD Biosciences | 305165 | |
| 500 mL Nalgene Filters | VWR international | 73520-985 | |
| 1L Nalgene Filters | VWR international | 73520-986 | |
| Tissue Forceps | Fine Science Tools | 11023-15 | |
| FSC Tweezers #5 | Fine Science Tools | 11295-00 |
Ссылки
- Thompson, R. P., Fitzharris, T. P. Morphogenesis of the truncus arteriosus of the chick embryo heart: the formation and migration of mesenchymal tissue. Am J Anat. 154, 545-556 (1979).
- Johnson, C. M., Fass, D. N. Porcine cardiac valvular endothelial cells in culture: A relative deficiency of fibronectin synthesis in vitro. Lab Invest. 49 (5), 589-598 (1983).
- Manduteanu, I., Popov, D., Radu, A., Simionescu, M. Calf cardiac valvular endothelial cells in culture: production of glycosaminoglycans, prostacyclin and fibronectin. J Mol Cell Cardiol. 20 (2), 103-118 (1988).
- Cheunyg, W. Techniques for isolating and purifying porcine aortic valve endothelial cells. JHVD. 17 (6), 674-681 (2008).
- Paranya, G., Vineberg, S., Dvorin, E., Kaushal, S., Roth, S. J., Rabkin, E., Schoen, F. J., Bischoff, J. Aortic valve endothelial cells undergo transforming growth factor-beta-mediated and non-transforming growth factor-beta-mediated transdifferentiation in vitro. Am J Pathol. 159 (4), 1335-1343 (2001).
- Butcher, J. T., Penrod, A., Garcia, A. J. M., Nerem, R. M. Unique morphology and focal adhesion development of valvular endothelial cells in static and fluid flow environments. Arterioscler Thromb Vasc Bio. 24 (1), 1429-1434 (2004).
- Simmons, C. A., Grant, G. R., Manduchi, E., Davies, P. F. Spatial heterogeneity of endothelial phenotypes correlates with side-specific vulnerability to calcification in normal porcine aortic valves. Circ Res. 96, 792-799 (2005).
- Butcher, J. T., Tressel, S., Johnson, T., Turner, D., Sorescu, G., Jo, H., Nerem, R. M. Transcriptional Profiles of Valvular and Vascular Endothelial Cells Reveal Phenotypic Differences: Influence of Shear Stress. Arterioscler Thromb Vasc Biol. 26, 69-69 (2006).
- Parachuri, S., Yang, J. H., Aikawa, E., Melero-Martin, J. M., Khan, Z. A., Loukogeorgakis, S., Schoen, F. J., Bischoff, J. Human Pulmonary Valve Progenitor Cells Exhibit Endothelial/Mesenchymal Plasticity in Response to Vascular Endothelial Growth Factor-A and Transforming Growth Factor-β2. Circ Res. 99 (8), 861-869 (2006).
- Shi, Q. Evidence for circulating bone marrow-derived endothelial cells. Blood. 92, 362-367 (1998).
- Rehman, J., Li, J., Orschell, C. M., March, K. L. Peripheral blood endothelial progenitor cells are derived from monocyte/macrophages and secrete angiogenic growth factors. Circulation. 107, 1164-1169 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены