Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Прижизненные микроскопия микроциркуляции мозга мыши, используя Закрытая черепно Window
В этой статье
Резюме
Прижизненные микроскопии следовать временным и пространственным гемодинамики и воспалительных явлений в пиальных микроциркуляцию.
Аннотация
Это экспериментальная модель была разработана для оценки мыши пиальных микроциркуляции при остром и хроническом, физиологических и патофизиологических гемодинамики, воспалительных и метаболических условиях, используя в естественных условиях флуоресцентной микроскопии. Закрытой черепно окно находится над левой теменно-затылочной коры мышей. Местные микроциркуляцию записывается в реальном времени через окно с помощью эпи и флуоресцентной подсветкой, и измерения диаметров судов и красных кровяных телец (эритроцитов) скоростей выполняются. РБК скорость измеряется в режиме реального времени кросс-корреляции и / или флуоресцентными меченых эритроцитов. Лейкоцитов и тромбоцитов приверженность мягкой мозговой оболочки сосудов и оценки перфузии и сосудистой утечки сделаны с помощью флуоресценции меченых маркеров, таких как альбумин-FITC и анти-CD45-TxR антител. Микроциркуляции может быть повторно видеокассету в течение нескольких дней. Мы использовали в первый раз закрыть окно мозга прижизненной микроскопии для исследования микроциркуляции пиальных следовать динамические изменения в ходе Plasmodium инфекции berghei ANKA у мышей, и показать, что выражение CM связано с нарушениями микроциркуляции характеризуется сужением сосудов, глубокое снижение артериального потоков и в конечном итоге сосудистого коллапса.
протокол
1. Краниотомия
Трепанация черепа в 8-к-10-недельных мышей должна быть выполнена заранее, как описано выше 1, кроме того, что титан бар не помещается в голове животного. Хронические черепно окно стабильной подготовки позволяет рассмотрение пиальных микроциркуляцию даже месяцев после имплантации. Как правило, мы проводим наши исследования через 2-3 недели после имплантации черепных окна.
2. Прижизненные микроскопии
- Два-три недели после трепанации черепа, температура тела, а затем проверили мышь слегка анестезировали изофлуран (4% для индукции, 1-2% за обслуживание). Свет анестезии используется для предотвращения стресса животных и дискомфорт во время эксперимента.
- Животных помещали в положении лежа на стереотаксической рамы и головы тщательно крепится с помощью уха баров. Уровень регулируется с помощью правого и левого рычагов. Температура тела поддерживается использованием грелки. Потому что мыши с церебральной малярии развивать гипотермия, температура параметры должны быть скорректированы для каждого животного.
- Покровным стеклом на черепные окном мягко очищают ватным тампоном, смоченным нефтепродуктов и панорамное изображение судов под окном берется с помощью стереомикроскопа и цифровой камерой (Nikon Coolpix 995, Япония). Изображение выводится на экран, идентифицированы и датированы и будет использоваться в качестве карты для измерения диаметра сосуда и красные кровяные клетки (эритроциты) скоростями.
- Мышь затем переведен в прижизненной столик микроскопа (настраивается Leica-Макбейн, Сан-Диего, Калифорния). Капля воды помещается на черепные окна воспользовавшись хорошо образованные стоматологических акриловых, фокус настраивается. Измерения проводятся с использованием 20-кратный (LUMPFL-WIR, числовой апертурой 0,6, Olympus) цель погружения в воду. Же суда следуют, так что прямое сравнение их с исходным уровнем может быть выполнена, что позволяет более надежную статистику для малых популяций образца. Изображения получены с помощью цифровой низкой освещенности камера высокого скорости (Hamamatsu C9300-221, Япония), или низкой камеры аналог света (COHU 4815, Сан-Диего, Калифорния), подключенных к ленте видеомагнитофона (JVC, Япония), с временными метками (микроизображения Видео Системы, Бойертаун, штат Пенсильвания) и цветной монитор (PELCO, Кловис, штат Калифорния). Лента правильно определены до начала записи, и отметка времени позволяет идентифицировать события, документально время, через которое такие мероприятия были перекодировано.
- Первая проверка судов производится для оценки качества подготовки и, если кровь течет во всех судах. Затем выбор судов для измерения производится и оно должно включать венул и артериол различного диаметра (в нашем мыши пиальных препаратов, большинство судов диапазоне от 20 до 80μm) и охватывают различные места в местах, подверженных воздействию у окна. Артериол и венул можно легко дифференцировать, проверяя направление кровотока в разветвления сосуда (будь то распространяет или собирает кровь). В наших исследованиях, измерения производятся в 12 судов. Точное местоположение каждого пятна на измеряемый аннотированные в картине пиальных сосудов.
- Для каждого пятна, диаметр сосуда измеряется с помощью устройства сдвига изображения (Image сдвига, Vista электроники, Сан-Диего, Калифорния) 2. Как только место выбрано, образ судна выравнивается в вертикальном положении, и изображение будет стриженого пока против крайностей выравниваются и чтения документации. Это значение может быть переведен на микрометров от предыдущей калибровки для каждого конкретного увеличения использования Сетка Микрометр этап калибровки (Эдмунд оптики Inc, Баррингтон, штат Нью-Джерси).
- Каждое пятно регистрируется в течение не менее 30 секунд для эритроцитов слежения. Для слежения, образец крови собраны, и эритроциты флуоресцентно меченные красителем карбоцианиновых Дил (Molecular Probes, Карлсбад, Калифорния) и пропитала через хвостовую вену получить в естественных условиях концентрация ~ 0,4-0,5% 3. У животных, инфицированных Plasmodium berghei ANKA (PBA), выражающая зеленый флуоресцентный белок (GFP-PbA, пожертвование от исследований малярии и справочных реагентов ресурсный центр MR4, Манассас, Вирджиния, сданный на хранение CJ Janse А. П. воды), настой не меченых ячейки необходимо. Видео изображения записываются со скоростью 150 кадров в секунду. Этот показатель устанавливается для получения 5:59 изображения ячейки на одной кадров при определении скорости до 8 мм / с Видео изображения оцифрованы с персональным компьютером с помощью Adobe Premier 4.0, а ху данные координат для каждой ячейки изображения получены с использованием SigmaScan Pro 4.0 программное обеспечение (SPSS Чикаго, Иллинойс) 4. Сотовые положение которых определяется вручную, а не путем анализа изображения, учитывая, что глаз наблюдателя обучение было показано, чтобы дать хорошую оценку расположение в центре клетки,ч в целом соответствует положению максимальной флуоресценции наблюдалось во всех направлениях клетки. Несколько определения положения и скорости производится для каждой ячейки и в среднем для получения средней скорости РБК.
- При измерениях РБК скорости выполняться в автономном режиме, суммарное время наблюдения для каждой мыши не превышает 10-15 минут минимизации кардиодепрессивного последствий анестезии.
- Как только диаметр сосуда и измерения скорости РБК доступны, расчет кровотока в каждое судно может быть сделан по формуле: Q = V х π (D / 2) 2, где Q = кровотока, V = РБК скорости и D = диаметр сосуда.
- Эти процедуры можно повторять в течение долгого времени. Например, в мышиной модели церебральной малярии, мы выполняем ежедневные измерения, начиная с 4-й день инфекции. Значениями, полученными каждый день в течение каждой мыши нормированы по отношению ко дню 0 (до заражения), который считается 100%.
- В дополнение к диаметра сосуда и измерений кровотока, дополнительные оценки могут быть выполнены, например, улучшение оценки перфузии и анализ лейкоцитов и / или тромбоцитов прокатки и присоединения в мягкой мозговой оболочки сосудов. Эти измерения проводятся с помощью люминесцентных меченых маркеров. В случае малярии, мы также можем обнаружить циркулирующие или приверженцем паразитов путем использования штамма PbA которая выражает GFP.
- Для перфузионных оценки мы используем решения FITC-меченого альбумина (Sigma, St Louis, Миссури 50μg/mouse), и количественно лейкоцитов соблюдение пиальных судов мы используем антитела к пан-лейкоцитарный маркер CD45, меченных Texas Red (TxR) ( Invitrogen, Карлсбад, Калифорния 4μg/mouse). Для этого 25 мкл из альбумин-FITC (2mg/mL) и 20 мкл анти-CD45-PE антитела (200μg/mL) смешивают и вводят в подогретого хвостовую вену. Мышь может затем быть отображены немедленно, поэтому если утечка измерения займет альбумин-FITC разрешается циркулировать в течение 15 минут. Зеленый флуоресценции (518nm), испускаемых альбумин-FITC и GFP (PBA-GFP PRBC) захватывается использования и АЛЬФА Vivid: XF100-2 (Omega оптические, Brattleboro, VT), и анти-CD45-TxR флуоресценции (615nm) и выходе захватили с Vivid Стандарт: XF42.
- Меченных флуоресцентными альбумина позволяет улучшить визуализацию сосудистой сети, в том числе проникающие сосудов, и это особенно полезно в болезненных состояний, таких как церебральная малярия, чтобы проверить, не перфузии или под-перфузии сосудов. Она также может быть использован для измерения сосудистой утечки 5.
- Флуоресцентные меченных анти-CD45 антител позволяют легко идентифицировать и количественно лейкоцитов качения и сцепления с мягкой мозговой оболочки сосудов. Чтобы избежать предвзятости в количественном, мы количественно качения и сцепления в том же пятна предопределенных для измерения кровотока. Количественная оценка адгезии лейкоцитов производится путем подсчета количества лейкоцитов в 100 мкм, длина судна. Роллинг можно измерить с помощью подсчета числа лейкоцитов путешествия со скоростью, значительно медленнее, чем скорость крови в том же 100 мкм длиной, в течение 30 секунд.
3. Представитель результаты
Рисунок 1. (Шаг 2,6) Фотографии мыши пиальных сеть сосудистых доступны через черепную окна.
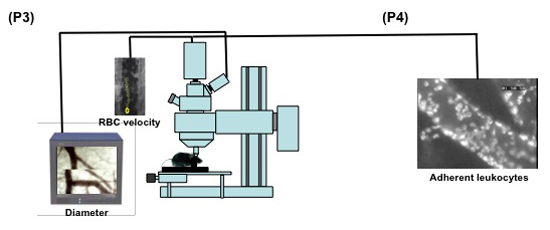
Рисунок 2. (Шаги 3.1-3.5) Схематическое отображение созданных для прижизненной микроскопии мыши пиальных микроциркуляцию. 1: прижизненной микроскопии; 2: 20X погружения в воду цели; 3: источник света; 4a: цифровой низкой освещенности высокоскоростной камеры; 4b: аналоговая камера; 5: мышь в стереотаксической раме; 6: компьютерный монитор, 7: аналоговый комбайна монитор, показывающий, как изображение стрижки (стрелка) делается для измерения диаметра сосуда.

Рисунок 3. (Шаг 3,6-3,8) микрососудистой эритроцитов измерения скорости по мобильному слежения с высокой скоростью флуоресценции видеозаписей. Картинки для F являются последовательность изображений одного пиальных судна, показывая один движущийся РБК пересечения микроскопических разделителем поля камеры. Руководство определения кадр за кадром позиций из 15 или более ячеек через поле, с его предварительно откалиброванной расстояние, позволяет вычислить среднюю скорость РБК в каждого судна с помощью таблиц Excel.
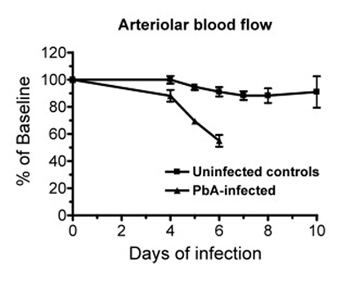
Рисунок 4. (Шаг 3,9) Данные представитель эксперимент показывает изменения в пиальных кровотока с течением времени в Plasmodium berghei ANKA (PBA) зараженных мышей (п = 5) и в неинфицированных контрольных мышей (п = 5). В то время как у контрольных мышей пиальных кровотока является относительно стабильным с течением времени, PbA-инфицированных мышах показывают заметное снижение кровотокаво время мозгового развития малярии (день 6). Данные среднее ± SEM.
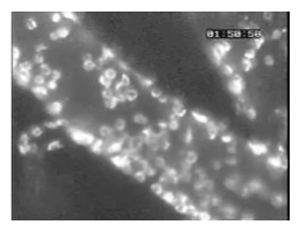
Рисунок 5. (Шаг 4,3) большое количество лейкоцитов приверженцем пиальных судов мыши инфицированных Plasmodium berghei ANKA, как показали окрашивания с анти-CD45-Texas Red флуоресцентных антител.
Обсуждение
Прижизненной микроскопии описаны здесь представляет собой уникальный и мощный инструмент для детального наблюдения пиальных микроциркуляцию в мышь. Это позволяет выделение отдельных артериол и венул и измерения изменений ряда параметров, таких как диаметре сосудов, РБК скорости, по...
Раскрытие информации
Благодарности
Эта работа была поддержана грантами R01-HL87290, R01-HL87290-S1 и R01-AI082610 из Национального института здоровья в LJMC.
Материалы
| Name | Company | Catalog Number | Comments |
| Isoflurane | Baxter Internationl Inc. | FDG9623 | |
| Carbocyanine dye Dil | Molecular Probes, Life Technologies | D306 | |
| Albumin-FITC | Sigma-Aldrich | A9771 | |
| Anti-CD45-TxR Ab | Invitrogen | MCD4517 | |
| P. berghei ANKA-GFP | MR4 | MRA-865 |
Ссылки
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. J. Vis. Exp. (15), (2008).
- Intaglietta, M., Tompkins, W. R. Microvascular measurements by video image shearing and splitting. Microvasc. Res. 5, 309-312 (1973).
- Briceno, J. C., Cabrales, P., Tsai, A. G., Intaglietta, M. Radial displacement of red blood cells during hemodilution and the effect on arteriolar oxygen profile. Am. J. Physiol. Heart Circ. Physiol. 286, 1223-1228 (2004).
- Bishop, J. J., Nance, P. R., Popel, A. S., Intaglietta, M., Johnson, P. C. Relationship between erythrocyte aggregate size and flow rate in skeletal muscle venules. Am. J. Physiol. Heart Circ. Physiol. 286, H113-120 (2004).
- Baldwin, A. L. Modified hemoglobins produce venular interendothelial gaps and albumin leakage in the rat mesentery. Am. J. Physiol. Heart Circ. Physiol. 277, H650-H659 (1999).
- Cabrales, P., Zanini, G. M., Meays, D., Frangos, J. A., Carvalho, L. J. Murine cerebral malaria is associated with a vasospasm-like microcirculatory dysfunction, and survival upon rescue treatment is markedly increased by nimodipine. Am. J. Pathol. 176 (3), 1306-1315 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены