Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Тестирование Protozoacidal активность лиганд-литических пептиды против термитов Gut Protozoa В пробирке (Protozoa культуры) и В естественных условиях (Микроинъекция в Термит кишке)
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мы существующему порядку демонстрации того, что лиганды связываются с поверхностью мембраны целлюлозы переваривания простейших в кишечнике Формозы подземных термитов помощью флуоресцентной микроскопии и лигандов, что в сочетании с литических пептидов убивать этих простейших В пробирке (Анаэробных простейших культуры) и В естественных условиях (Инъекции в кишке термитов).
Аннотация
We are developing a novel approach to subterranean termite control that would lead to reduced reliance on the use of chemical pesticides. Subterranean termites are dependent on protozoa in the hindguts of workers to efficiently digest wood. Lytic peptides have been shown to kill a variety of protozoan parasites (Mutwiri et al. 2000) and also protozoa in the gut of the Formosan subterranean termite, Coptotermes formosanus (Husseneder and Collier 2009). Lytic peptides are part of the nonspecific immune system of eukaryotes, and destroy the membranes of microorganisms (Leuschner and Hansel 2004). Most lytic peptides are not likely to harm higher eukaryotes, because they do not affect the electrically neutral cholesterol-containing cell membranes of higher eukaryotes (Javadpour et al. 1996). Lytic peptide action can be targeted to specific cell types by the addition of a ligand. For example, Hansel et al. (2007) reported that lytic peptides conjugated with cancer cell membrane receptor ligands could be used to destroy breast cancer cells, while lytic peptides alone or conjugated with non-specific peptides were not effective. Lytic peptides also have been conjugated to human hormones that bind to receptors on tumor cells for targeted destruction of prostate and testicular cancer cells (Leuschner and Hansel 2004).
In this article we present techniques used to demonstrate the protozoacidal activity of a lytic peptide (Hecate) coupled to a heptapeptide ligand that binds to the surface membrane of protozoa from the gut of the Formosan subterranean termite. These techniques include extirpation of the gut from termite workers, anaerobic culture of gut protozoa (Pseudotrichonympha grassii, Holomastigotoides hartmanni,
Spirotrichonympha leidyi), microscopic confirmation that the ligand marked with a fluorescent dye binds to the termite gut protozoa and other free-living protozoa but not to bacteria or gut tissue. We also demonstrate that the same ligand coupled to a lytic peptide efficiently kills termite gut protozoa in vitro (protozoa culture) and in vivo (microinjection into hindgut of workers), but is less bacteriacidal than the lytic peptide alone. The loss of protozoa leads to the death of the termites in less than two weeks.
In the future, we will genetically engineer microorganisms that can survive in the termite hindgut and spread through a termite colony as "Trojan Horses" to express ligand-lytic peptides that would kill the protozoa in the termite gut and subsequently kill the termites in the colony. Ligand-lytic peptides also could be useful for drug development against protozoan parasites.
протокол
Эксперимент 1: Добыча термитов кишечнике простейших в анаэробных условиях
- Используйте блок вентилятора (Кой Laboratories) в перчаточном ящике постоянно циркулировать воздух через осушитель и тип D катализатором Stak-Пакш для контроля влажности и кислорода и устранения неравномерности температур. Заполните перчаточный ящик с непрерывным потоком азота от 20 до 30 мин. Монитор кислорода с кислородным датчиком (С-квадрат, Inc) в течение 1 ч. Использование азота для достижения и поддержания анаэробных условиях, когда это необходимо.
- Подготовка Трагер U СМИ (Трагер 1934) и отрегулировать рН до 7,0. Брызгать фильтр стерилизованных средств массовой информации в перчаточный ящик со смесью 2,5% водорода, 5% углекислого газа и 92,5% азота в течение 1 ч для удаления кислорода остатков.
- Silanize все материалы, в том числе предметные стекла, микроцентрифужных трубки, пипетки, изделия из стекла и т.д., используемых в экспериментах с использованием Sigmacote для предотвращения адсорбции простейших или пептиды, на поверхности (Sigmacote, Sigma, # SL-2, http://www.sigmaaldrich.com/ и т.д. / medialib / Docs / Sigma/Product_Information_Sheet/1/sl2pis.Par.0001.File.tmp/sl2pis.pdf).
- Поскольку простейшие кишечника термитов строго анаэробные организмы, они не должны подвергаться воздействию кислорода. Поэтому следующие шаги выполняются в анаэробных условиях в перчаточном ящике (см. п. 1.1). С щипцы погружаться все тело термитов работника в 70% этанола и осторожно водоворот около 10 с для удаления поверхностных загрязнений.
- Удалить работника из этанола и дать высохнуть на чистую Kimwipe около 20 с Использование стерильных с острым концом пинцета держать работника живот и захватите кончик брюшка с другой парой щипцов, чтобы аккуратно потянуть кишки вверх или вниз в 45 градусов. Если кишечник втягивается под прямым углом и, слишком сильно она, скорее всего, развалится. Место 10 кишки в капле 100 мкл Трагер СМИ U на предметном стекле микроскопа.
- Пирс кишки с парой стерильных прекрасно рассекает зондов для выпуска простейших и мягко передачи кишки содержимое пипетки 200 мкл в 1 мл микроцентрифужных пробирку, содержащую 900 мкл Трагер U СМИ. После учета осаждения кишки фрагменты стен (5 сек), передача 900 мкл надосадочной в новую пробирку.
- Передача 10 мкл простейших культуры sigmacoted слайд микроскопа и проверить состояние простейших под микроскопом при 200-кратном увеличении.
- Подготовка контроль культур аэробных простейших Tetrahymena pyriformis, Amoeba зр., Эвглены зр. И Paramecium зр. (Каролина Биологические Компания питания, Берлингтон, штат Северная Каролина), а также ночной культуры кишечной палочки в культуральной среде рекомендованные поставщиком.
Эксперимент 2: Добавить лиганд в сочетании с флуоресцентным красителем на простейшие и бактерии культур для проверки привязки к поверхности мембраны и клеточной стенки
Мы использовали фагового дисплея библиотеки (New England Biolabs Inc, Ипсвич, Массачусетс), чтобы определить 19 гептапептида последовательности, которые связываются с простейших (протоколов, доступных на http://www.neb.com/nebecomm/ManualFiles/manualE8110.pdf). Лиганда с пептидной последовательности (ALNLTLH), которые показали сходство с предполагаемым гликопротеины известно из мембраны Trypanosoma brucei был синтезирован, и в сочетании с С-концевой флуоресцентного зонда (EDANS, 5 - ((2-аминоэтил) амино) нафталин-1-сульфокислоты кислоты, λmax = 341 нм, λem = 471 нм) с помощью твердофазного синтеза пептида состоянии (СКЭС), используя смолу EDANS NovaTag (EMD Biosciences). Здесь мы показываем, что лиганд связывается с простейших, которые были выделены из кишечника термитов и других свободно живущих простейших, но не к бактериям.
- Культура простейших, как описано в Exp. 1. Fix простейших с 10% формальдегида при температуре 4 ° С в течение 12 ч.
- Центрифуга простейшие решения (30 мкг, 10 мин), отказаться от супернатант и мыть гранул содержащих фиксированный простейших два раза в 1 мл Трагер U СМИ. Повторное приостановить гранул в 1 мл Трагер U СМИ. Кроме того, исправить другие простейшие, и E. кишечной бактерии для элементов управления.
- Инкубируйте фиксированных микроорганизмов в течение 1-2 ч при решении синтезировали лиганд связан с флуоресцентным красителем EDANS (подготовлен в воде) в конечной концентрации 50 мкМ. Лиганд растворяется в воде лучше, чем Трагер U СМИ.
- Соблюдайте микроорганизмов под флуоресцентным микроскопом при 400-кратном увеличении на абсорбцию максимум при 341 нм, а излучение в синей области при 471 нм.
Эксперимент 3: Тестирование protozoacidal деятельности лиганд связан с литическим пептида в пробирке (простейшие культуры)
Сопряженное лиганда и литической пептид Геката (Mutwiri и соавт. 2000) ранее был синтезирован в фонд белка ЛГУ.
- Silanize материалы и подготовить кишечник термитов простейших культуры в анаэробных перчаточный ящикс описанным в Exp. 1.
- Подготовка культур аэробных микроорганизмов контроля (например, кишечная палочка и свободно живущих видов простейших Т. pyriformis).
- В анаэробной среде перчаточный ящик, пипетки 6 аликвоты 198 мкл простейших культуры в 0,5 мл пробирок Эппендорф. Добавить 2 мкл 100 мкМ решение лиганд-литических пептида на половину порции (конец концентрации 1 мкМ) в кишечнике термита простейших культуры. Добавьте 2 мкл воды, чтобы другая половина порции (контроля).
- На настольные, подготовить аналогичные аликвоты Е. палочки и Т. pyriformis с 1 мкМ литических пептид, лиганд-литических пептид или воды.
- Через 1 ч, передача 10 мкл каждого простейших культуры слайдов. Сравните выживания очищенных простейшие, что и средства управления под микроскопом при 200-кратном увеличении.
- Через 1 ч пластины по 100 мкл ок. 10 -4 разведение Е. кишечной культур на BHI и инкубировать при температуре 37 ° С в течение ночи. Сравните количество колониеобразующих единиц на пластинах.
Эксперимент 4: Введение лиганд связан с флуоресцентным красителем в термитов в кишке
- Вытяните иглы (Модель GD-1, 1 х 900 мм) с использованием Narishige PC-10 стеклянных микропипетки съемник с двойным уровнем тепла этапа (65 и 48), чтобы получить чаевые размером 20-30 мкм. Подтвердить размер чаевых, измерив ее под микроскопом использованием микрометра.
- Наполните одну иглу с ок. 30 мкл 50 мкМ флуоресцентно отмечен лиганд, взвешенных в воде, используя прилагаемый шприц. Заполните другую иглу с водой для контроля. Прикрепить микропипетки (0,5 мкл потенциала и 32 мм длиной, ОАО Научно-Драммонд) для держателя в микроманипулятора. Прикрепить иглу держателя системы впрыска в секунду микроманипулятора. Установить исходные параметры инъекция примерно 1 с длительностью импульса и 10-12 фунтов на квадратный дюйм инъекции. Advance иглой медленно в микропипетки и ввести решения с помощью педали управляемой высокоскоростной электронной системой впрыска с контролем длительность импульса придает контролируемого потока газа азота, что обеспечивает постоянный объем воспроизводимо вводили. После инъекции, удалять микропипетки и записывать длину введенного раствора использованием Вернье суппорта. Рассчитать вводят объемом от известных параметров микропипетки. Отрегулируйте давление газа азота и длительность импульса изгнать 0,3 мкл раствора в одной инъекции.
- Сожмите конец термитов живота работник с мягкой щипцы для удаления настоящее экскрементов в прямой кишке. Остановите термитов работника путем охлаждения их на льду в течение 5 мин.
- Сделать приемники для проведения рабочих термитов, отрезая 100 мкл наконечники для пипеток использованием лезвие скальпеля. Отрежьте наконечник длиной 10 - 12 мм и использования в соответствии с размером термитов.
- Прикрепите приемник микроманипулятора. Место работника на чашку Петри на спинной стороне и аспирации работника с головой в приемник с помощью насоса всасывания азота, так что конечная работник выступает из приемника.
- Холдинг термитами в приемник, тщательно заранее заполненный иглы использованием микроманипулятора чтобы вставить его в рабочий анус. Inject 0,3 мкл раствора (флуоресцентно отмечен лиганд или воды для контроля).
- Место рабочих вводится с лигандом или воды в отдельные чашки Петри с влажной фильтровальной бумаги и держать их при температуре 26 ± 2 ° С при 78% относительной влажности
- Искоренить из кишки вводят термитов и собирать простейшие после 24 ч, как показано выше, в Exp. 1. Fix и соблюдать простейшие, как показано на Exp. 2.
Эксперимент 5: Тестирование protozoacidal деятельности лиганд связан с литическим пептида в естественных условиях (инъекции в термитов кишке)
- Silanize материалы, как описано в Exp. 1.
- Подготовка 500 мкМ решение лиганд-литических пептида в воде.
- Выполните шаги 3,1) через 3.4) подготовить стекло иглы, приемников и термитов рабочими.
- После методов, описанных в 3.5) вводят 0,3 мкл лиганд-литические решения пептид (лечение) или воды (контроль) в кишке на 20 рабочих термитов.
- Держите термитов в течение 24 ч, искоренить кишки с нескольких рабочих и наблюдать содержимое кишечника под микроскопом, как описано в 3.6). и 3.7).
- Как только смерть простейших в кишечнике термита подтверждена, сохранить оставшееся лечение термитов и контроля в чашки Петри с влажной фильтровальной бумагой и смертности наблюдать ежедневно.
Представитель Результаты:
Эксперимент 1: Как правило, кишки, кишки и задней кишки получены из одного куска, если процедура выполняется правильно (рис. 1а). Простейших находятся в высокой плотности в анаэробной части задней кишки и могут быть освобождены от пирсинга кишке щипцами (рис. 1, b 1 и 2). Крупнейший протоЗОА видов в кишечнике Формозы подземный термит является веретенообразных П. grassii, которая составляет 200-300 мкм, длину и 150 мкм, и их можно увидеть невооруженным глазом. Второй по величине вид грушевидный H. hartmanni (50-140 мкм долго и 30-80 мкм в ширину). Самый маленький вид конусообразной С. leidyi (15-50 мкм долго и 8-30 мкм, шириной;. Лай и др. 1983). Простейших видов показано на рисунке 2.
При оптимальных условиях культуры трех видов простейших, изолированных из кишечника Формозы подземных термитов останутся живы и здоровы, по крайней мере 72 часов в анаэробных Трагер U средств массовой информации (рис. 3а). Однако, если культура условия не являются оптимальными простейших умрет быстро. Если Есть остатки кислорода в СМИ, движение простейших будут немедленно прекращены. Если осмотическое давление слишком высокое или целостность мембран под угрозу поверхности мембраны простейших будет выпирают и клетки разрыва (рис. 3б). Если осмотическое давление слишком низкое или мембраны оказываются под угрозой, простейшие отсохнет и уменьшаться (рис. 3в).
Эксперимент 2: Мы подтвердили, что лиганд связан с флуоресцентным зондом связан со всеми тремя видами простейших с кишке из Формозы подземных термитов в заметных плотности. Связывание лигандов происходит на всей поверхности клетки (рис. 4). Связывание сайтов сосредоточены в передней части на простейших axostyle (лист микротрубочек) и ядра в P. grassii.
Мы наблюдали некоторый пятнистый аутофлюоресценция древесных частиц попадает в организм простейших. Тем не менее, аутофлюоресценция обычно легко отличить от специфического связывания лиганда, так как нет аутофлюоресценция поверхности, axostyle и ядра (рис. 4).
Мы также обнаружили флуоресценцию, во всех свободно живущих аэробных простейших видов (рис. 5), которая предполагает, что лиганд связывается со структурами общим для простейших. Тем не менее, не лиганд наблюдалась Е. палочки.
Эксперимент 3: Один мкМ лиганд-литических пептид убил всех трех видов простейших из кишечника Формозы подземных рабочих термитов и свободно живущих Т. pyriformis в пробирке менее чем за 10 мин, а контроль остался жив. На рисунке 6 показана прогрессирующая потеря целостности мембран из кишечника термитов простейших получавших лиганд-литических пептидов. Мембраны выпуклость и разрыва, простейшие сморщиваются и погибают. Нет разницы, которая наблюдалась в число Е. кишечной колоний между обработками лиганд-литических пептидов и воды. Литические пептид без каких-либо лиганда, тем не менее, снижение числа E. кишечной колоний значительно (рис. 7). Это говорит о том, что привязанность лиганда в некоторой степени защищает микроорганизмы, не цель из лизиса.
Эксперимент 4: Когда 0,3 мкл 50 мкМ флуоресцентно отмечен лиганд был введен в кишке термитов рабочими, привязка к П. grassii, С. leidyi и H. hartmanni было подтверждено с помощью флуоресцентной микроскопии похож на Exp. 2 (рис. 4). Термиты кишечнике ткани не показали флуоресценции.
Эксперимент 5: Инъекция 0,3 мкл 500 мкМ лиганд-литических пептид убил всех трех видов простейших в кишечнике Формозы подземных термитов в течение 24 часов. Термиты умерли в течение 10 дней после потери их симбиотические простейшие. Ранее Husseneder и Кольер (2009) вводили же концентрации литических пептида в термитов кишки. Без прилагается лиганд, это заняло больше времени, до простейших в кишечнике (72 ч) и термиты были мертвы (шесть недель). Это говорит о том, что лиганд увеличивает эффективность protozoacidal литических пептидов, скорее всего, путем связывания литических пептидов для простейших.
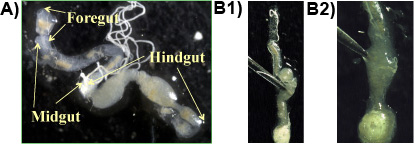
Рисунок 1. : Формозы подземных кишечнике термитов на слайде показаны основные разделы кишки (передней, средней, задней кишки), б 1 и 2: кишке прокалывается щипцами, чтобы освободить кишечник материалов, содержащих простейших.

Рисунок 2. Трех видов жгутиковых простейших обнаружены в задней кишке из Формозы подземный термит:) Pseudotrichonympha grassii, б) Holomastigotoides hartmanni, и в) Spirotrichonympha leidyi.

Рисунок 3. Простейшие в области культуры,) Здоровый простейших, б) простейших с выпученными мембран, в) Иссохшее простейших.

Рисунок 4. Подтверждение связывание лигандов связан с флуоресцентного зонда для термитов кишкипростейших (сверху вниз: П. grassii, Х. hartmanni, С. leydi), обрабатывали флуоресцентно отмечен лиганда и необработанных контрольных (с указанием аутофлюоресценция).

Рисунок 5. Лиганд привязки к свободно живущих аэробных простейших,) Tetrahymena, б) Amoeba, в) эвглены и г) Paramecium.
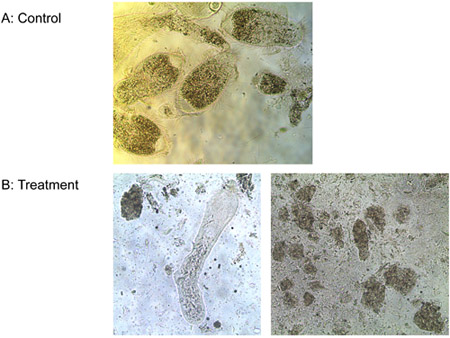
Рисунок 6. Лечение с простейшими) воды (контроль) и б) 1 мкМ лиганд-литических пептидов.
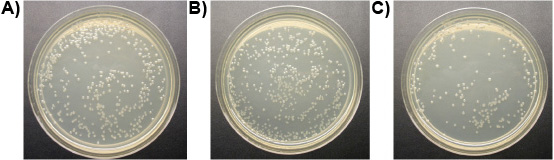
Рисунок 7. Е. кишечной колоний на чашках (10 -4 разведение):) обрабатывают водой (контроль), б) обрабатывали 1 мкМ лиганд-литических пептид, в) обрабатывали 1 мкМ литических пептидов.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Лиганд-литических пептидов, которые были успешно использованы для эффективного прицельное действие способствует разрушению раковых клеток (Гензель и Лейшнер 2004, Гензель и соавт. 2007). Основываясь на этой концепции, мы разработали гептапептида лиганд, который связывается с поверхн...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Благодарности
Мы благодарим доктор Элисон Ричард, бывший директор объекта ЛГУ пептид для флуоресцентной синтез лиганда, Interdisciplinaray Центра биотехнологических исследований, UF для лиганд-литического синтеза пептидов, а объект Socolovsky микроскоп для обеспечения доступа к флуоресцентных микроскопов. Финансирование было предоставлено развития SERDP поисковые программы (SEED) из Министерства обороны, Министерства энергетики и охране окружающей среды, биотехнологии AgCenter Междисциплинарная команда программы и штата Луизиана.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Sigmacote | Sigma-Aldrich | SL-2 | |
| EDANS | Novabiochem, EMD Millipore | ||
| Anaerobic glove box | Coy Laboratories, Inc. | Custom made | |
| Intellus environmental controller | Percival Scientific, Inc. | I36NL | |
| PC-10 Glass micropipette puller | Narishige International | PC-10 | |
| Glass needles (Model GD-1, 1 X 900 mm) | Narishige International | GD-1 | |
| Leitz micromanipulators | Vermont Optechs, Inc. | ACS01 | |
| Microinjector | Tritech Research, Inc. | MINJ-1 | |
| Microcaps | Drummond Scientific | 1-000-0005 | |
| LEICA fluorescence imaging system | Leica Microsystems | DMRxA2 | |
| LEICA dissecting scope | Leica Microsystems | MZ16 | |
| LEICA microscope | Leica Microsystems | DMLB | |
| Olympus dissecting scope | Olympus Corporation | SZ61 |
Ссылки
- Hansel, W., Leuschner, C., Enright, F. Conjugates of lytic peptides and LHRH or βCG target and cause necrosis of prostate cancers and metastases. Mol. Cell. Endocrinol. 269, 26-33 (2007).
- Husseneder, C., Collier, R. E. Paratransgenesis for termite control. Insect Symbiosis. Bourtzis, K., Miller, T. A. 3, CRC Press LLC. Boca Raton, Florida. Volume 3 361-376 (2009).
- Husseneder, C., Grace, J. K., Oishi, D. E. Use of genetically engineered bacteria (Escherichia coli) to monitor ingestion, loss and transfer of bacteria in termites. Curr. Microbiol. 50, 119-123 (2005).
- Husseneder, C., Grace, J. K. Genetically engineered termite gut bacteria deliver and spread foreign genes in termite colonies. Appl. Microbiol. Biotechnol. 68, 360-367 (2005).
- Javadpour, M. M., Juban, M. M., Lo, W. C., Bishop, S. M., Alberty, J. B., Cowell, S. M., Becker, C. L., Mc Laughlin, M. L. De novo antimicrobial peptides with low mammalian cell toxicity. J. Med. Chem. 39, 3107-3113 (1996).
- Lai, P. Y., Tamashiro, M., Fuji, J. K. Abundance and distribution of the three species of symbiotic protozoa in the hindgut of Coptotermes formosanus (Isoptera). Proc. Haw. Entomol. Soc. 24, 271-276 (1983).
- Leuschner, C., Hansel, W. Membrane disrupting lytic peptides for cancer treatments. Curr. Pharm. Des. 10, 2299-2310 (2004).
- Mutwiri, G. K., Henk, W. G., Enright, F. M., Corbeil, L. B. Effect of the Antimicrobial Peptide, d-Hecate, on Trichomonads. J. Parasitol. 86, 1355-1359 (2000).
- Trager, W. The cultivation of a cellulose-digesting flagellate, Trichomonas termopsidis, and of certain other termite protozoa. Biol. Bull. 66, 182-190 (1934).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены