Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Количественная Синапсы: Иммуноцитохимическая основе Пробирной количественно Synapse Количество
В этой статье
Резюме
Этот протокол содержит подробные сведения по количественному синапса числа как в диссоциированных нейронов культуры и в мозгу разделы, используя иммуноцитохимия. Использование купе-специфические антитела, мы обозначаем пресинаптических терминалах, а также участки постсинаптических специализации. Мы определяем синапсов как точки колокализации между сигналы, генерируемые этими маркерами.
Аннотация
Одним из наиболее важных целей в области неврологии, чтобы понять молекулярные сигналы, которые поручить ранних этапах формирование синапса. Как таковое оно стало необходимым разработать объективные подходы к количественной оценки изменений в синаптических соединений. Начиная от образца фиксации, этот протокол содержит подробные сведения по количественному синапса числа как в диссоциированных нейронов культуры и в мозгу разделы, используя иммуноцитохимия. Использование купе-специфические антитела, мы обозначаем пресинаптических терминалах, а также участки постсинаптических специализации. Мы определяем синапсов как точки колокализации между сигналы, генерируемые этими маркерами. Число этих colocalizations является количественно, используя подключение Puncta Analyzer (написаны Бари Уорк, предоставляются по запросу, c.eroglu @ cellbio.duke.edu) в рамках программной платформы анализа ImageJ. Синапс анализа, описанного в этом протоколе могут быть применены к любой нейронной подготовки ткани или культуры, для которых селективное пре-и постсинаптического маркеров. Этот анализ синапса является ценным инструментом, который может быть широко использован в изучении синаптических развития.
протокол
Решения по подготовке:
- Антитела буфера:
- 150 мМ NaCl
- 50 мМ Трис-Base (Fisher, Cat No:. BP152-5, 50 мм) - 1,21 г
- 1% BSA (Sigma, Cat No:. A2153, 1%) - 2,0 г
- 100 мМ L-лизина (Sigma, Cat No:. L-1137, 100 мм) - 3,65 г
- Отрегулируйте рН до 7,4
- 0,04% азида
- Регулировка громкости в 200 мл дистиллированной H 2 O.
- Фильтра через 0.22μm фильтр (Millipore, Cat No:. SCGPU02RE).
- PFA Diluant:
- 168 мл 0,5 М Na 2 HPO 4 (двухосновная)
- 72 мл 0,5 М Na 2 HPO 4 (одноосновная)
- 660 мл дистиллированной H 2 O
- 4% PFA фиксатором для культивированных нейронах (решение # 2):
- 10 мл 16% PFA решение (электронная микроскопия наук, Cat No:. 15711)
- 30 мл 4% PFA diluant (раствор № 2)
- 4% PFA в ФБР:
- 4 г PFA (Электрон Microscropy наук, Cat No:. 19210)
- 100 мл PBS (Invitrogen, Cat No:. 20012-027)
- Нагреть до 40 ° C, размешать в одночасье.
- Фильтра через 0.22μm фильтр (Millipore, Cat No:. SCGPU02RE)
- Блокировка буфера (Общий объем (для 24-луночного планшета) = (# покровные +1) х 200 мкл)
- 50% антител буфера (раствор № 1)
- 50% Нормальные сыворотки козьего (Gibco, Cat No:. 16210)
- 0,2% Тритон Х-100 (Roche Diagnostics Gmbh, Cat No:. 9002-93-1)
- 30% сахарозы в ФСБ
- 30 г сахарозы (МП Biomedicals, Inc, Cat No:. 821713)
- 70 мл PBS (Invitrogen, Cat No:. 20012-027)
- Смешать с stirbar до сахарозы в растворе.
- Довести объем до 100 мл с PBS
- Фильтра через фильтр 0,22 мкм (Millipore, Cat No:. SCGPU02RE)
Подготовка нейронных культур:
Протокол, описанный здесь, применимы к любой первичный нейронных культур, выращенных на 12 мм стекла покровные (Карл Гехт, № О, Cat No:. 99010) в 24-луночных планшетах (Falcon, 35-3047). Например, в нашей лаборатории культуры крысы ганглиозных клеток сетчатки (РСК) очищается от крыс сетчатки собран с С-5-7 1,2 животных. Клетки, выращенные на покровных стекла покрытые поли-D-лизина (Sigma, Cat No:. P6407) (. Cultrex, Cat No: 3400-010-01) и мышь ламинин. Мы используем эту культуру подготовки в несколько различных способов для наших синапса анализа. Один манипуляций, которые мы выполняем предполагает культивирование РГК либо в наличии или отсутствии астроцитов, выделяемые synaptogenic факторов. Кроме того, мы также используем эти различные условия лечения в экспериментах, где РГК были трансфекции с гиперэкспрессией белка интересов. В последнем случае, мы сотрудничаем трансфекции клеток с ячейки метки (например, GFP или tdTomato). Эти различные экспериментальные подходы влияют на один выполняет определенные шаги синапса анализа, который мы прояснить ниже.
1. Крепление диссоциированных Очищенная РГК
- Удалить культуру средств массовой информации из RGC-содержащих скважин и добавить 500 мкл (для 24-луночного планшета) 4% параформальдегида (PFA) предварительно нагретого до 37 ° С в каждую лунку. Разрешить клетки исправить в течение 7 минут при комнатной температуре.
- После фиксации промыть клетки 3 раза фосфатно-солевом буфере (PBS) (Invitrogen, Cat No:. 20012-027). ВАЖНО: Клетки никогда не должны оставаться без жидкости в колодцах, когда-то буфер будет удален из хорошо он должен быть немедленно заменен следующего буфера. В этот момент клетки готовы к иммунной окраски.
2. Блокировка Неспецифические сайты связывания на РГК
- Подготовка блокирующего буфера, содержащего 50% нормальной козьей сывороткой (NGS, Gibco, Cat No:. 16210) и 0,2% Тритон Х-100 (Roche Diagnostics Gmbh, Cat No:. 9002-93-1). После удаления PBS из каждой лунки, добавить 200 мкл блокирующего буфера в каждую лунку и блока в течение 30 минут при комнатной температуре.
- Удалите блокирующий буфер и промыть 3 раза PBS.
3. Применение Первичная Решение антител
- ВАЖНО: Не забудьте выбрать первичных антител для пре-и постсинаптических маркеры, которые получаются из различных видов.
- Подготовка первичного разведения антител в 90% антител буфера, 10% NGS раствора, содержащего пре-и постсинаптических антител пары по вашему выбору. Например кролика против SYNAPгрех (пресинаптических маркеров) (1:750, цитозольного домена, Synaptic Systems) и мышь анти-Гомера (постсинаптические маркер) (1:500, мышь, Synaptic Systems). ВАЖНО: Центрифуга первичного разведения антител в течение 5 минут при максимальной скорости в центрифуге настольный для удаления осажденного антител.
- Добавить 200 мкл первичных антител решение в каждую лунку.
- Инкубируйте течение ночи при 4 ° C. Пластины должны быть помещены в большой контейнер, который увлажняется, чтобы предотвратить высыхание первичного решения. Break Point: Ячейки могут остаться в первой смеси антител на срок до 3 дней до продолжения протокола.
- На следующий день, удаление первичного антитела из каждой лунки и промыть лунки 3 раза PBS.
4. Применение вторичных Решение антител
- Подготовка вторичного решение антител содержащий вторичные антитела, разбавленного 1:1000 антител буфера, содержащего 10% NGS. ВАЖНО: Центрифуга вторичного разведения антител в течение 5 минут при максимальной скорости в настольной центрифуге для удаления осажденного антител. Пропуск этого шага приводит к высоким вторичном фоне антител.
Untransfected клеток: В случае отсутствия ячейки этикетки, использование Alexa-594 и Alexa-488 сопряженных вторичные для маркировки пре-и постсинаптических маркеры соответственно. Например мы используем козьего анти-кролик Alexa594 маркировать анти-synapsin антител и козьи антитела мыши Alexa-488 сопряженных вторичной по отношению к этикетке анти-Гомер антител. ВАЖНО: Используйте Alexa-488 сопряженных вторичные для первичных антител с более слабым сигналом.
Трансфицированных клеток: Выберите вторичными антителами, которые приспосабливают возбуждения спектра излучения флуоресцентной метки ваших клеток. Например, когда мы называем трансфекции клеток с tdTomato мы используем Alexa-647 сопряженных козьего анти-кролик признать анти-synapsin антител и Alexa-488 сопряженных антимышиного признать анти-Гомер антител. Кроме того, использование NGS в данном протоколе, является результатом нашего выбора вторичных антител, вырабатываемых в козла. - Добавить 200 мкл вторичных решение антител в каждую лунку.
- После инкубации в течение двух часов при комнатной температуре в темном месте, промыть 3 до 4 раз с PBS.
5. Монтаж Покровные
- Горы в покровных Vectashield монтажа среде с DAPI (Vector Laboratories Inc, Cat No:. H-1200) на стеклах (VWR научных, Cat No:. 48311-703).
- Осторожно применять четкие лака для ногтей по краям покровного стекла и дать высохнуть в течение по крайней мере 30 минут в сухом, темном месте. ВАЖНО: Не подталкивать или перемещения покровных при нанесении лака для ногтей, так как это привело бы к Шееринг клеток.
6. Изображений
Для обработки изображений, флуоресцентный микроскоп оснащен камерой способны запечатлевать снимки с 4-х различных каналов необходимо, чтобы иметь возможность изображения как синаптических маркеров, мобильный заполнить и ядер (DAPI / опционально). Клетки должны быть отображены использовании 63x нефти погружения цели. Мы образ с помощью Zeiss AxioImager флуоресцентный микроскоп с Zeiss План-Apochromat 63x/1.4 Нефть DIC ∞ / 0,17 цели.
- Выделите ячейки, которые являются не менее двух диаметров ячейки от своих ближайших соседей. Чтобы избежать предвзятости и обеспечить случайность клеточной селекции, если визуализации untransfected ячеек, выберите ячейки в канале DAPI, затем изображения во всех каналах. Если визуализации трансфицированных клеток выделить ячейки в канале соответствует флуоресцентной метки для идентификации трансфекции клеток (например tdTomato).
- Приобретать изображения:
Untransfected клеток: Для каждой выбранной ячейки, получить 8-битного изображения в GFP и Техас Красный каналы. Накладываются pseudocolored изображения должны иметь ваш пре-и постсинаптического маркеров в красный и зеленый, соответственно.
Трансфицированных клеток: Для каждой выбранной ячейки получить 8-битного изображения в GFP, штат Техас Красное и Cy5 (или Cy5.5) каналов. Накладываются pseudocolored изображения должны иметь ваш пре-и постсинаптического маркеров в красный и зеленый, соответственно. Псевдо цвета мобильный заполнить синим цветом.
7. Анализ изображения и сотрудничеству локализованных Puncta Количественное
- Мы используем Puncta Analyzer программа для количественного со-локализованы синаптических puncta. Puncta Analyzer подключить написана Бари Уорк, и может быть предоставлена по запросу (c.eroglu @ cellbio.duke.edu). Puncta Analyzer работает в ImageJ 1.26 (http://rsbweb.nih.gov/ij/, новые версии ImageJ не может запустить приложение). Для установки Puncta Analyzer просто поместите загруженное приложение в папку "Plugins" в папке ImageJ 1,26 каталог.
- Откройте один из ваших изображений с помощью ImageJ. Используйте один из инструментов выделения в IMAGе ^ меню, чтобы определить область интереса (ROI). Мы регулярно использовать инструмент кругового выделения для выбора региона примерно на одну ячейку диаметром радиально вокруг сомы интересов.
- С вашей области интереса (ROI) установлен, перейдите к плагины меню и выберите пункт "Puncta Analyzer".
- В "Параметры анализа" появившемся окне выберите "Красный коридор", "Зеленый канал", первое "вычитание фона" и "Установить файл результатов ...." Нажмите "OK". Вам будет предложено определить местоположение для сохранения результатов дюйма Эти результаты могут быть экспортированы в Excel для дальнейшего анализа.
- В окне, которое появится, убедитесь, что катящийся шар радиусом 50 выбрана, и снимите флажок "белый фон" вариант (эта модификация не требуется, но часто предпочитают пользователи приложения для удобства визуализации). Нажмите "OK".
- Появится новое окно вместе с маской, соответствующие вашим красный канал изображения. Отрегулируйте порог, пока не почувствуете, что красная маска соответствует как нельзя лучше к так много дискретных отдельных puncta не вводя слишком много шума. Это один из самых субъективных шагов этого протокола, поэтому позаботьтесь, чтобы разработать последовательный подход. Нажмите кнопку "Готово". Установить минимальный размер puncta до 4 пикселей и изменить ничего. Нажмите "OK".
- Повторите предыдущий шаг, на этот раз для зеленого канала.
- После завершения предыдущего шага, плагин будет обеспечивать количественную соответствующие puncta в каждом канале отдельно и colocalized puncta между двумя каналами.
МОЗГ РАЗДЕЛЫ:
Синапс анализа может быть применена к cryosections от мозга, и к любой другой системе нервной ткани (например, спинного мозга или сетчатки), при условии, что нет подходящих пре-и постсинаптического маркером пара (с антителами, которые хорошо работают в секциях), которые могут быть использованы для идентификации синапсов вы хотите определить. Синапс анализ может выявить временные регулирования формирование синапса в той или иной области мозга и могут количественно воздействие на синаптические связи в трансгенных животных или образец, который был изменен в некоторых других моды.
1. Сбор ткани мозга от мышей
Все животные процедур должно быть сделано в соответствии с протоколами IACUC животного.
- Усыпить мышей кровопускания и перфузии с PBS. Перфузии с PBS имеет решающее значение для удаления крови и уменьшает фоновый сигнал для окрашивания процедур. ВАЖНО: Не заливать с фиксаторов, такие как 4% PFA. Это отрицательно скажется на результатах окрашивания.
2. Фиксация
- Fix весь мозг в 4% PFA в PBS при 4 ° С в течение ночи. На следующий день промыть мозги 3 раза PBS.
- Cryoprotect мозги, сгруппировав их в 30% сахарозы в PBS. Ткань первоначально будет плавать. Хранить при температуре 4 ° С до ткань опускается на дно. На этом этапе криозащиты завершена.
3. Встраивание / Cryosectioning
- Вставить мозги на желаемой ориентации для секционирования (например, сагиттальной или корональной) в 2:01 раствор 30% сахарозы: (. Ткань-Tek, Cat No: 4583) октября в PBS. Замораживание встроенных мозги на ровной поверхности сухого льда. Замороженные встроенных мозги могут быть помещены в морозильник мешки и хранятся при температуре -80 до года до секционирования.
- Cryosection ткани в 12-16μm разделы и смонтировать на стеклах (Sigma, Cat No:. S4651). Слайды могут храниться до недели при температуре -80 ° C до окрашивания.
- Слайды должны быть окрашенных следует сушить при температуре 37 ° С в течение 30 минут и промыть 1x с PBS для удаления остатков октября
4. Блокировка Разделы
- Блок секций в 20% нормальной козьей сывороткой (NGS) в PBS в течение одного часа при комнатной температуре. ВАЖНО: Не включайте Тритон Х-100 на данном этапе. Перед добавлением блокирующим раствором, вы можете создать гидрофобный барьер вокруг разделы на вашем слайд с помощью Pen Elite PAP (DBS, Cat No:. K039)
5. Применение первичных антител
- Развести ваш основной антител в PBS с 0,3% Тритона и 10% NGS.
- В мозгу разделах мы используем PSD-95 (Zymed, Кролик, 1:500) для обозначения глутаматергической постсинаптических отсеков и VGlut1 или VGlut2 (Chemicon, морская свинка, 1:2500) для обозначения глутаматергической пресинаптических окончаний. Центрифуга первичного разведения антител в течение 5 минут при максимальной скорости в настольной центрифуге для удаления осажденного антитела если они присутствуют.
- Инкубируйте разделы в первичных решение антитела для 36-60 часов при 4 ° C.
6. Применение вторичных антител
- Вымойте первичных антител с погружением слайдов 3x в PBS в течение 15 минут каждый. После этого шага убедитесь, что для защиты ваших слайдов из прямого света.
- Разбавленныйвторичными антителами в разведении 1:200 в том же буфере, как описано для первичных антител. Например, для окрашивания VGlut/PSD95 мы используем козий анти морской свинки Alexa 488 (Vglut) и козьи антитела кролика Alexa 594 (PSD-95) (Invitrogen).
- Инкубируйте разделов в средней решение антител в течение 2 часов при комнатной температуре в темноте.
- Вымойте несвязанных вторичных антител с слайды, погружая слайды 4x в PBS в течение 15 минут каждый.
7. Монтаж
- Добавить мелкие капли Vectashield монтажа среде с DAPI (Vector Laboratories, Inc) на стеклах (VWR научных), а затем крышку слайды с покровные (VWR Научные, № 1,5, 48 393 241). Примените лак для ногтей, чтобы препятствовать движению покровные.
8. Изображений
ВАЖНО: конфокальной микроскопии, по крайней мере 3 канала необходима для визуализации описаны здесь. Мы изображение на Leica SP5 лазерной сканирующей конфокальной микроскопии использовании 63x целью погружения на нефть.
- Synaptic областях мозга интересов должны быть выбраны для сканирования последовательно между секциями. Например, в нашей синапса анализ сетчатки ганглиозных клеток синапсов на нейронах превосходной холмов, мы образ внешнего превосходной регионе холмов, прилегающих к нижней бугорок, который охватывает синаптических слой, который получает retinocollicular клеммы 7,8,9. Мы образ и количественно синапсов в верхнем 150 мкм синаптической зоне верхний бугорок, где РГК, как известно, установить синаптических контактов 9.
- Для каждого раздела, в обоих 488 и 594 каналов, мы изображения серийного оптических срезов в 0,33 мкм интервалы на общей глубине 5 мкм для общей сложности 15 оптических срезов. По крайней мере, 3 секции от каждого животного должен быть отображены и не менее 3 животных, должны быть включены в данных экспериментальных условиях.
- Максимальная прогнозы интенсивности (ПОМ) создаются из группы из 3 последовательных разделов уступая 5 ПОМ представляющих глубины 1 мкм каждая. Эти ПОМ количественно.
9. Изображение Количественное
- Может быть выполнена в точности, как описано для РГК, однако форма и размер ROI будет меняться в зависимости от какой области изображения, которые требуется определить.
Ключи к успеху:
Очищенная РГК:
- Перед установкой очищенных РГК (или другой диссоциированных культуры) не забудьте предварительно теплой 4% PFA в ванну с водой установлен в 37 ° С в течение ~ 20-25 минут (хранить при 4 ° С во все другие времена, не используйте PFA разведения старше 7 дней).
- В частности, для культурной нейронов, желательно не использовать вакуумный аспиратор во время мойки для всех промыть шагов. Gentler такие методы, как использование пипетки Пастера и всасывания лампы значительно улучшить качество вашего окрашивания.
- Будьте осторожны, не позволяйте вашей клетки высыхают во время полоскания шагов.
- Избегайте подталкивать или перемещение покровные во время нанесения лака для ногтей так как это может привести к стрижка клетки на покровное.
- Спином вниз все первичные и вторичные антитела, чтобы устранить любые осаждали антитела, которые окажут негативное воздействие окрашивания.
- Не забудьте выбрать первичных антител для пре-и постсинаптического маркеры поднял у разных видов. Невыполнение этого условия позволит устранить вашу способность различать два сигнала после применения вторичных антител.
Мозг форумов:
- Не заливать ваш мышей с фиксаторов, таких как PFA.
- Не включайте Triton-X 100 на вашем блокирующий раствор для мозга разделов. В противном случае ущерб качеству окрашивания на пресинаптических маркеров, в частности пресинаптических маркеров, которые связаны с синаптических пузырьков.
- Использование конфокальной микроскопии для получения изображения требуется для получения изображений, который имеет достаточно хорошим качеством выполнить синапса анализа.
Представитель Результаты:
Синапс анализа, описанного выше, предназначены для улавливания изменений в синаптических связей в пробирке и в естественных условиях. В нашей лаборатории мы используем синапса анализ, чтобы определить влияние либо один или несколько астроцитов, выделяемых молекул на формирование синапса. Мы обычно выполнения этой синапса анализа на очищенных РГК, что мы культура в пробирке.
Хорошо описывается влияние хронического применения астроцитов с кондиционером СМИ (ACM) в очищенной РГК культур несколько раз увеличить количество синапсов, которые образуются между РГК 3,4,5,6. Рисунок 1А и 1В показывают представитель образы untransfected очищенной РГК обрабатывали либо базальных питательной среды или с ACM. После окрашивания для возбуждающих пре-и постсинаптического маркеры, ACM-индуцированный рост сynapse формирование качественно очевидно (рис. 1А, 1Б). Действительно, этот вывод был подтвержден ряд исследований, которые использовали электрофизиологии, чтобы показать, что ACM-индуцированной синапсы являются функциональными и электронной микроскопии, чтобы показать, что синапсы ultrastructurally нормальной 3,4,6. Другая работа в нашей лаборатории выявила субъединицы кальциевых каналов α2δ-1 в качестве нейронов рецепторов для сильно synaptogenic астроцитов, выделяемые молекулы, тромбоспондин 3. Здесь мы включаем результаты эксперимента в очищенной РГК, которая была выполнена для определения повышение уровня α2δ-1 еще более усиливает ACM-индуцированной формирование синапса (рис. 3).
РГК были cotransfected либо пустой вектор или построить кодирования α2δ-1 с отдельным построить кодирования tdTomato через 5 дней в пробирке (DIV5). После хронического лечения либо ACM или GM, РГК были фиксировали и окрашивали по DIV 11. После immunolabeling пре-и постсинаптических маркеров возбуждающих синапсов мы видим качественно очевидным увеличение числа синапсов в очищенной РГК выражения либо пустой вектор (pcDNA3.1) или α2δ-1 (рис 1C, 1D). Мы количественно synaptogenic влияние ACM использованием Puncta анализатор для подсчета числа синапсов (рис. 2) не менее 15 нейроны от каждого условия. Образец такого размера позволяет вычислить среднее число синапсов в нейроне и найти статистически значимым, ~ 10-кратное увеличение в синапсах образована ACM обработанных нейронов, которые выражают пустой вектор (рис. 3, серые полосы). Кроме того, мы покажем, что гиперэкспрессия α2δ-1 приводит к значительному потенцирование ACM-индуцированной формирование синапса (~ 20 раз. Рис. 3, черные полосы).
В дополнение к культурным нейронов, мы можем количественно синаптической плотности в различных регионах мозга с помощью этой техники. Верхний бугорок является структура мозга, которая получает retinocollicular прогнозы, происходящих из РГК в сетчатке 7,8,9. За постнатального развития, число возбуждающих синапсов образована РГК на свои цели в верхний бугорок резко возрастает с P7 на P21 7,8,9.
Используя наши количественного технику, мы покажем, что число retinocollicular синапсы образуются в верхнем бугорке увеличивается от P7 на P14. Чтобы сделать это, мы количественно синаптической плотности при P7 и снова на P14. Мы пятно верхний бугорок для PSD-95 (постсинаптические) и для VGlut2 (пресинаптических маркеров специфичных для RGC синапсов в верхний бугорок). Внешний синаптической области верхний бугорок был образ (рис 4а) и со-локализованы VGlut2/PSD-95 синапсы были количественно (рис. 4В, 4С), по крайней мере 3 секции на одно животное и, по крайней мере 3 животных в момент времени. Количественная оценка полученных данных ясно показывает, в течение трех раз значительный рост числа синапсов между P7 и P14. Эти результаты согласуются с ранее опубликованными выводами использованием электронной микроскопии (рис. 4Д) 9.
В заключение, метод количественного числа синапсов мы описываем здесь является полезным инструментом для определения числа синапсов и плотность в культуре и в нервной ткани, что позволяет нам изучать последствия манипулирования формирование синапса в пробирке или в естественных условиях.
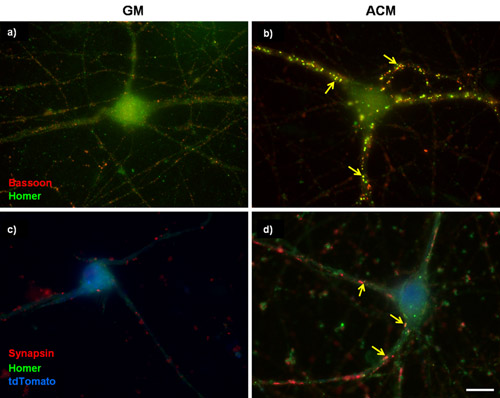
Рисунок 1: представитель синаптических окрашивания в очищенной РГК. (А и Б) 3 дня в пробирке (DIV) РГК культивировали либо в () базальной питательной среды (GM) или (б) про-synaptogenic мыши астроцитов кондиционированной среде (ACM) для 6 дополнительных дней. Затем клетки помечены для фагота (пресинаптических, красный) и Гомер (постсинаптические, зеленый). Мышь ACM сильно стимулирует формирование синапса между РГК, как это определено увеличение числа совместных локализованных фагота и Гомер puncta. (С и D) 5DIV РГК были трансфицированных плазмидой с гиперэкспрессией субъединицу кальциевых каналов α2δ-1. Трансфицированных клеток были идентифицированы с tdTomato заполнить ячейки (синий) и были витражи для пресинаптических synapsin маркер и постсинаптических Гомер маркером. Стрелки указывают синапсов. Шкала бар составляет 20 мкм.
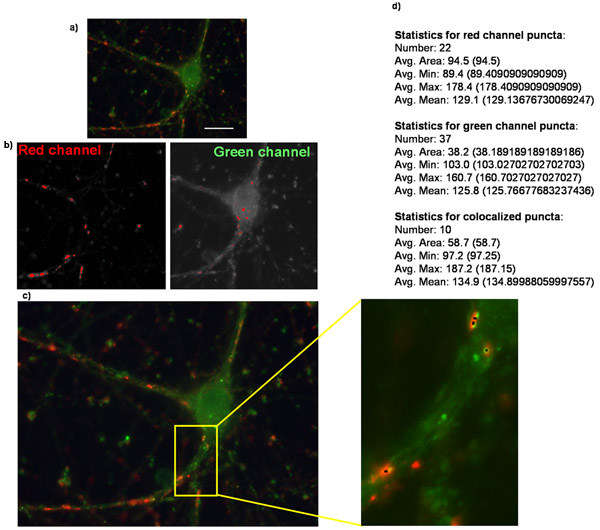
Рисунок 2:. Количественная оценка синапса номер с помощью анализатора Puncta На рисунке вы видите пример (а) исходное изображение очищенного ганглиозных клеток сетчатки гиперэкспрессией рецепторов тромбоспондин α2δ-1 и окрашивается для пресинаптических synapsin маркер и постсинаптических Гомер маркером. (Б) изображений, соответствующих масках созданных в каждом канале, при анализе puncta в Puncta Analyzer. (С) Puncta Analzyer будет создавать изображения, такие как показано здесь, в которой puncta обозначены мелкими черными точками (вставка). Кроме того, шош есть (г) численного вывода приложение, в котором puncta номер вместе с несколькими другими параметрами приведены в текстовой / числовой форме (жирный текст, добавленный для выразительности).
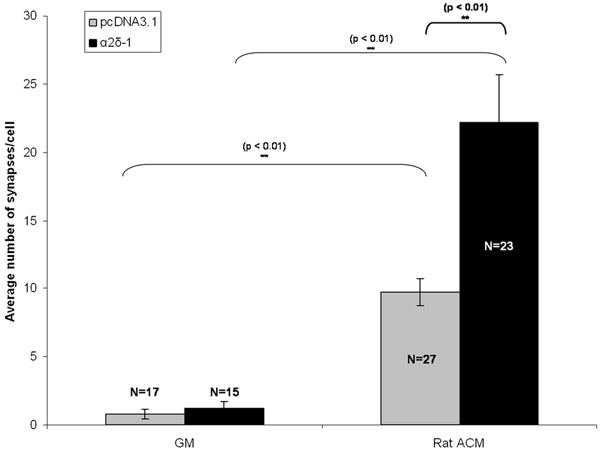
Рисунок 3:. Представитель результат для анализа синапса На рисунке вы видите synaptogenic эффект хронического лечения РГК с астроцитов с кондиционером СМИ (ACM) в трансфицированных РГК выражения либо пустой вектор (pcDNA3.1, серые полосы) или рецептор тромбоспондин α2δ-1 . Планки погрешностей представляют SEM. GM Медиа = рост. ACM = (Крыса) астроцитов Contitioned Media.
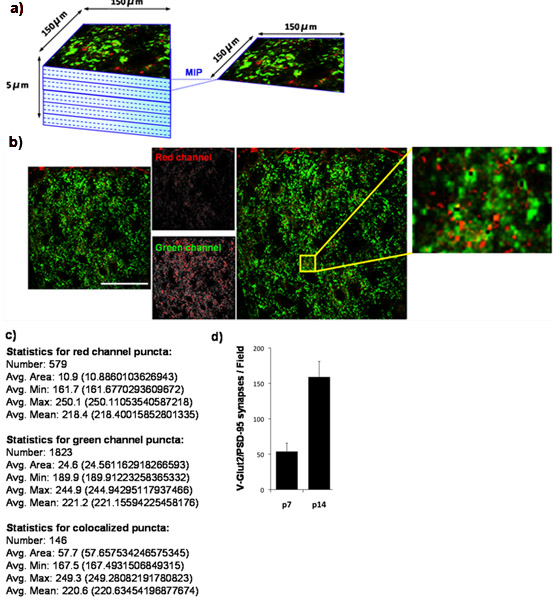
Рисунок 4:. Количественная оценка синаптической плотности в мыши верхний бугорок () Для определения развития изменений в число синапсов глутаматергической установленном РГК на превосходной цели холмов в грызун мозг, мы окрашенных cryosections из мозга мышей с антителами против пресинаптических Маркер VGlut2 (зеленый) и постсинаптические маркер, PSD-95, (красный). Мы отображаемого внешние 150 х 150 мкм область мыши верхний бугорок (SC), соответствующей области синапсов мишенью для РГК с помощью лазерной сканирующей конфокальной микроскопии. Z-Stack для каждого раздела SC была собрана для общей глубиной 5 мкм (15 х 0,33 мкм оптического разделы). Максимальная прогнозы изображение (ПОМ) были получены для группы из 3 последовательных оптических срезов уступая 5 ПОМ / секции каждая из которых представляет 1 мкм глубины. Ниже показан представителю MIP взяты из верхний бугорок на P14 мыши WT. Пресинаптических маркер, VGlut2, показана на зеленый и постсинаптических маркер, PSD-95, отображается красным цветом. (С) Цифровое продукции, произведенной Analyzer Puncta. (Г) Количественный анализ числа синапсов, по крайней мере 3 секции на животное с 3 животных в момент времени (погрешности представляют SEM). Шкала бар, составляет 50 мкм.
Обсуждение
Синапс анализа, описанного выше, основана в контексте наших экспериментальных целей, в которых мы ориентируемся в основном на возбуждающие проекции РГК, либо в очищенной культуры или в мозге разделе. Мы предоставили ссылку таблица с перечнем антитела, которые хорошо работают для марки...
Раскрытие информации
Благодарности
Анализатор Puncta Плагин для изображения J была написана Барри Уорк (текущий адрес: Physion Consulting) в лаборатории А. Бен Баррес (Стэнфордский университет).
Финансирования;
- Альфреда П. Слоуна
- Эстер А. и Иосиф Klingenstein фонд, Inc
- Широкий биомедицинских исследовательского фонда
- Лекарство от болезни Хантингтона с инициативой
Материалы
| Name | Company | Catalog Number | Comments | |||||
| Антиген | Вид | Моноклональные / Поликлональные | Продавец | Номер в каталоге | Разбавление | Работы в области культуры | Работает в разделах | |
| Пресинаптического | Synapsin | Кролик | Поликлональные | Synaptic системы | 106004 | 1:750 | У | Н. Д. |
| Synapsin | Мышь | Моноклональный | Synaptic системы | 106001 | 1:500 | У | У | |
| Фагот | Мышь | Моноклональный | Анализ образцов | VAM-PS003F | 1:500 | У | У | |
| Фагот | Морская свинка | Поликлональные | Synaptic системы | 141004 | 1:1000 | У | Н. Д. | |
| Synaptotagmin 1 | Кролик | Поликлональные | Synaptic системы | 105002 | 1:750 | У | N | |
| Synaptobrevin 2 (C1.69.1) | Мышь | Моноклональный | Synaptic системы | 104211 | 1:500 | У | У | |
| Synaptophysin (C1.7.2) | Мышь | Моноклональный | Synaptic системы | 101011 | 1:500 | У | У | |
| VGlut1 | Мышь | Моноклональный | Millipore | MAB5502 | 1:2500 | N | У | |
| VGlut1 | Морская свинка | Поликлональные | Millipore | AB5905 | 1:2500 | N | У | |
| VGlut2 | Морская свинка | Поликлональные | Millipore | AB2251 | 1:2500 | N | У | |
| Постсинаптические | PSD-95 (6G6-1C9 клон) | Мышь | Моноклональный | Affinity Био Реагенты | MA1-045 | 1:750 | У | N |
| PSD-95 | Кролик | Поликлональные | Zymed | 51-6900 | 1:500 | N | У | |
| Почтовый голубь | Мышь | Моноклональный | Synaptic системы | 160011 | 1:500 | У | Н. Д. | |
| Почтовый голубь | Крыса | Поликлональные | Millipore | AB5875 | 1:500 | У | У | |
| Gephyrin | Кролик | Поликлональные | Synaptic системы | 147003 | 1:500 | У | У | |
| Gephyrin | Мышь | Моноклональный | Synaptic системы | 147 | 1:200 | У | У |
Таблица 1: Список примеров хорошей пре-и постсинаптического маркеры, которые мы успешно использовали в нашей синапса анализа. Имейте в виду, что это не исчерпывающий список всех доступных маркеров. Y = Да, N = Нет, ND = не определена.
| Реагент | Компания | Кат. Нет. |
| PBS | Invitrogen | 20012-027 |
| поли-D-лизина | Сигма | P6407 |
| Ламинин | Cultrex | 3400-010-01 |
| Тритон Х-100 | Roche Diagnostics Gmbh | 9002-93-1 |
| Нормальная сыворотки козьего | Гибко | 16210 |
| VectaShield с DAPI | Vector Laboratories | H-1200 |
| Октябрь | Ткань-Tek | 4583 |
| Трис-Base (50 мМ) | Рыболов | BP152-5 |
| Бычьего сывороточного альбумина | Сигма | A2153 |
| L-лизина | Сигма | L-1137 |
| 16% PFA решение | Электронная микроскопия наук | 15711 |
| Гранулированный PFA | Электронная микроскопия наук | 19210 |
| 24-луночных культуры пластины | Сокол | 35-3047 |
| Антимышиного Alexa конъюгированных антител | Invitrogen | --- |
| Снабжение | Компания | Кат. Нет. |
| 12мм, № 0 стекла покровные | Карл Гехт Gmbh | 1105209 |
| № 1.5 покровное стекло (для срезов) | VWR Научные | 48393241 |
| Стекло слайдов | VWR Научные | 48311-703 |
Ссылки
- Barres, B. A., Silverstein, B. E., Corey, D. P., Chun, L. L. Y. Immunological, morphological, and electrophysiological variation among retinal ganglion cells purified by panning. Neuron. 1, 791-803 (1988).
- Meyer-Franke, A., Kaplan, M. R., Pfrieger, F. W., Barres, B. A. Characterization of the signaling interactions that promote the survival and growth of developing retinal ganglion cells in culture. Neuron. 15, 805-819 (1995).
- Eroglu, C. Gabapentin receptor alpha2delta-1 is a neuronal thrombospondin receptor responsible for excitatory CNS synaptogenesis. Cell. 139, 380-392 (2009).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 .
- Ullian, E. M., Sapperstein, S. K., Christopherson, K. S., Barres, B. A. Control of synapse number by glia. Science. 291, 657-661 (2001).
- Christopherson, K. S. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis. Cell. 120, 421-433 (2005).
- Godement, P., Salaun, J., Imbert, M. Prenatal and postnatal development of retinocollicular projections in the mouse. J. Comp. Neurol. 230, 552-575 (1985).
- Schmidt, J. T. Formation of retinotopic connections: selective stabilization by an activity-dependent mechanism. Cell. Mol. Neurobiol. 5, 65-84 (1985).
- Sachs, G. M., Jacobson, M., Caviness, V. S. Postnatal changes in arborization patterns of murine retinocollicular axons. J. Comp. Neurol. 246, 395-408 (1986).
- Elmariah, S. B., Oh, E. J., Hughes, E. G., Balice-Gordon, R. J. Astrocytes regulate inhibitory synapse formation via Trk-mediated modulation of postsynaptic GABAA receptors. J. Neurosci. 25, 3638-3650 (2005).
- Hughes, E. G., Elmariah, S. B., Balice-Gordon, R. J. Astrocyte secreted proteins selectively increase hippocampal GABAergic length, branching and synaptogenesis. Moll. Cell. Neurosci. 43, 136-145 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены