Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Органотипической культуре Кусочек GFP-экспрессирующих эмбрионов мыши для реального времени изображений периферической нервной вырост
Резюме
Мы представляем способ получения органотипической ломтиками середине беременности эмбрионов мыши для выращивания и замедленная съемка периферического отросток нерва.
Аннотация
Для многих целей, культивирование естественных мыши бывший эмбрионов в качестве органотипической ломтиками желательно. Например, мы используем линию трансгенных мышей (tauGFP), в котором расширенная версия зеленого флуоресцентного белка (EGFP) исключительно экспрессируется во всех нейронов развивающихся центральной и периферической нервной системы 1, что позволяет возможность как фильм иннервации передних конечностей и манипулировать этим процессом с фармакологическими и генетическими методами 2. Наиболее критичным параметром в успешном выращивании таких культур срез метод, посредством которого ломтиками готовы. После обширного тестирования различных методов, мы обнаружили, что vibratome является наилучшим устройством для среза эмбриона, что они обычно приводят к культуре, которая демонстрирует жизнеспособность в течение нескольких дней, и, самое главное, развивается в возрасте конкретным образом. Для середине беременности эмбрионы, это включает в себя нормальным следствием спинальных нервов из спинного мозга и спинной ганглий корня до своих целей на периферии и правильного определения костной и мышечной ткани.
В этой работе мы представляем метод обработки целых зародышей эмбриональных день (E) E10 в E12 на 300 - 400 мкм ломтиками для выращивания в стандартной тканевой культуры инкубатор, который может быть изучен на срок до двух дней после среза подготовки. Решающее значение для успеха такого подхода является использование vibratome резать каждый агарозном встраиваемый эмбриона. Это сопровождается выращивания ломтиками на Millicell культуры мембраны вставки помещается на небольшой объем среды, в результате чего техника культуре интерфейс. Один помете в среднем по 7 эмбрионов обычно производит не менее 14 ломтиков (2-3 ломтика передних конечностей региону в эмбрион), который немного отличается из-за возраста эмбрионов, а также толщина ломтиков. Около 80% культурных ломтиками показать нерва результат, который можно измерить througout 2 периода культивирования. Представитель результаты, используя линию tauGFP мыши продемонстрировали.
протокол
Часть 1: Подготовка для нарезки и культивирования.
- Подготовка 10-см пластин культуре ткани с нарезки среды (DMEM, 25% 1x HBSS, 25% эмбриональной телячьей сыворотки, 0,5% глюкозы, 1 мМ глутамина, 2,5 мМ HEPES, рН 7,3) и 3-х см Millicell-CM 0,4-мкм культуры мембраны вставками и держать в инкубаторе при температуре 37 ° С и 5% СО 2.
- Нагрейте 4% низкой температурой плавления агарозы в PBS в микроволновую печь и держать его при нагреве пластины так, чтобы он остался примерно на 37 ° C.
- Заполнить 10-см бактериологические чашки Петри с PBS (140 мМ NaCl, 2,7 мМ KCl, 10 мМ Na 2 HPO 4, 1,8 мм KH 2 PO 4) и место на льду.
- Настройка микротома устройство охлаждения или обеспечить, чтобы лоток буфера и охлаждающие элементы хранятся в морозильной камере предварительного охлаждения.
Часть 2: Эмбрион вложение.
- Рассеките эмбрионов из матки и рассмотреть их с перевернутой флуоресцентного микроскопа для проверки GFP выражения.
- Место эмбрионов на перевернутую 10-см чашку Петри и ориентировать их использования полосах ватмана, чтобы удалить чрезмерное PBS.
- Применение агарозы на эмбрион, чтобы исправить ее в этом положении. Давайте агарозном затвердеть.
- Ограничьте область вокруг эмбриона путем разрезания лезвие бритвы.
- Поворот встроенного эмбриона на его другой стороне.
- Применить дополнительные агарозы на эмбриональной ткани для того, чтобы эмбрион полностью внедрен.
- Подготовка агарозном блоке с чистые края и смонтировать на vibratome патрон использованием Loctite 406, специальный клей похожи на "Krazy Glue».
Часть 3: нарезки процедуры.
- Настройка предварительно охлажденном лоток буфера и охлаждающий элемент.
- Вставьте патрон с клееные ткани и добавить 1x HBSS (Са 2 +-Mg 2 +-свободный HBSS, 10 мМ HEPES буфере рН 7,3, 500 ед / мл пенициллина / стрептомицина), пока не охвачены.
- Вставьте и закрепите precleaned (70% этанол) микротома лезвия.
- Подготовка 350 - 450 мкм ломтиками и передача их с помощью укороченной стеклянные пипетки Пастера в пластины тканевой культуры держится на льду.
- Используя пару щипцов, тщательно удалить из агарозы каждый кусочек и трансфер в Millicell культуры мембран. Около 4 ломтика можно выращивать на одном мембраны в 10-см культуре ткани пластины заполнены 6 мл питательной среды.
- Инкубируйте ломтиками при температуре 37 ° С и 5% СО 2 (культуры среда: DMEM, 25% 1x HBSS, 25% эмбриональной телячьей сыворотки, 0,5% глюкозы, 1 мМ глутамина, 2,5 мМ HEPES, рН 7,3). Если человек совершает покадровой визуализации серии следует иметь объем среды постоянна. В случае серии приурочен визуализации для короткого промежутка времени достаточно, чтобы оставить среде, как она есть. Для более длительных периодов культуры изменений после 12-20 часов рекомендуется.
Часть 4: изображений спинного нерва на вырост микроскопом.
- Изображение спинномозговых нервов размещения 10-см культуре ткани пластины, содержащие мембраны Millicell культуры с ломтиками, при вертикальном флуоресцентный микроскоп.
- Этикетка ориентации Millicell культуры мембран на столике микроскопа в положение правильно во время следующей точке изображения.
- Изображение спинного нерва результатом использования 4-кратного (числовой апертурой [Н.] 0,1), 10x (NA 0.3), или 20x (NA 0.5) целей.
На рисунке 1 показано изображение серии изображением спинного нерва результат в течение 20 часов культуры с 4-кратным и 10-кратным целей.
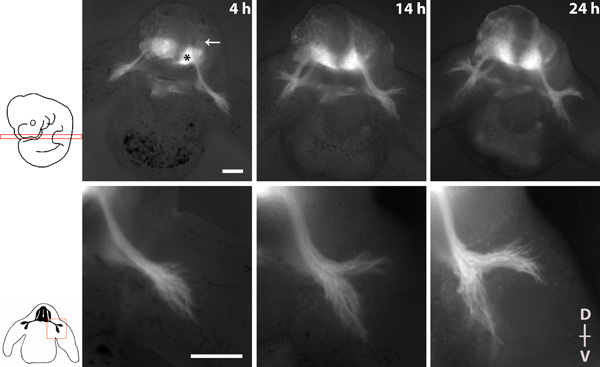
Рисунок 1 изображений серии спинного нерва в результате поперечного кусочек гомозиготных эмбрионов tauGPF. * = Двигательные нейроны спинного мозга вентральной, стрелка = DRG. Спинные (D)-вентральной (V) оси срез указано. Scalebars: 200 мкм.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В обширной сравнения методов для подготовки эмбриональных культур кусочек середине беременности эмбрионов мыши (E10 - E12), мы заметили, что vibratome производит без сомнения, наиболее надежные результаты в отношении как общей жизнеспособности культур и воспроизводимость шаблоны нерва резул...
Access restricted. Please log in or start a trial to view this content.
Благодарности
Авторы выражают благодарность первоисточник для идеей является выполнять срез культуры от эмбрионов мыши 5. Мы хотели бы выразить признательность Йоахим Кирш за щедрую поддержку научных и Анна Деген за работу в качестве наших мальчиком на побегушках во время съемок. Эта работа финансировалась Немецкого исследовательского фонда (Deutsche Forschungsgemeinschaft: Sonderforschungsbereich 488, Teilprojekt B7/B9) и Гейдельбергском университете (Совершенство кластер сотовой сети).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| HBSS 10x | GIBCO, by Life Technologies | 14180 | |
| Dissection tools | Fine Science Tools | various | |
| L.M.P. agarose | Invitrogen | 15517-022 | |
| Whatmann paper | Whatman, GE Healthcare | 3030917 | |
| Shortened firepolished pipettes | |||
| DMEM | GIBCO, by Life Technologies | 41966 | |
| FBS | GIBCO, by Life Technologies | 10270-106 | |
| Pen Strep | GIBCO, by Life Technologies | 15140 | |
| L-glutamine 100x | GIBCO, by Life Technologies | 25030 | |
| Vibratome | Microm International | HM 650 V | |
| Fluorescent microscope | Olympus Corporation | BX61WI | |
| analySIS | Soft Imaging System | ||
| Millicell-CM inserts | EMD Millipore | PICMORG 50 | |
| 10 cm culture plates | Greiner Bio-One | 633171 | |
| LOCTITE 406 | Henkel Corp | 142580 | |
| Razor blades | Thermo Fisher Scientific, Inc. | none | |
| Dissecting microscope | Nikon Instruments | SMZ800 | |
| HEPES | Carl Roth Gmbh | 9105.2 | |
| Glucose | Sigma-Aldrich | G7021 | |
| x4 objective | Olympus Corporation | PL series | |
| x10 objective | Olympus Corporation | UPLFL –PH series | |
| Filter | Olympus Corporation | U-MNIBA2 | |
| CCD camera | Soft Imaging System | SIS F-View II | |
| Equipment for heated chamber | Leica Microsystems | CTI-Controller 3700 and incubator S #11531171 |
Ссылки
- Tucker, K. L., Meyer, M., Barde, Y. A. Neurotrophins are required for nerve growth during development. Nat Neurosci. 4, 29-37 (2001).
- Brachmann, I., Jakubick, V. C., Shaked, M., Unsicker, K., Tucker, K. L. A simple slice culture system for the imaging of nerve development in embryonic mouse. Dev Dyn. 236, 3514-3523 (2007).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. Journal of neuroscience methods. 59, 5-9 (1995).
- Katz, L. C. Local circuitry of identified projection neurons in cat visual cortex brain slices. J Neurosci. 7, 1223-1249 (1987).
- Hotary, K. B., Landmesser, L. T., Tosney, K. W. Embryo slices. Methods Cell Biol. 51, 109-124 (1996).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены