Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Определение ДНК Метилирование запечатлены в генах Arabidopsis Эндосперм
В этой статье
Резюме
Импринтинг это явление в растительном и млекопитающих воспроизводства. Метилирование ДНК играет важную роль в механизмах импринтинга. Изоляция эндосперма и определения статуса метилирования генов в запечатлены Arabidopsis Может быть затруднено. В этом протоколе, мы описываем, как изолировать эндосперма и определять метилирование по бисульфит секвенирования.
Аннотация
Arabidopsis thaliana является отличным организма модель для изучения эпигенетических механизмов. Одной из причин является потерей функции нулевой мутанта ДНК метилтрансферазы является жизнеспособным, обеспечивая тем самым система изучить, как потерю метилирования ДНК в геноме влияет на рост и развитие. Импринтинг означает дифференциальное выражение материнских и отцовских аллелей и играет важную роль в воспроизводстве развития как млекопитающих и растений. Метилирования ДНК имеет решающее значение для определения того, материнской или отцовской аллелей запечатлены ген экспрессируется или замолчать. В цветущих растений, есть двойное событие оплодотворение в воспроизводстве: один сперматозоид оплодотворяет яйцеклетку для формирования эмбриона и второго предохранители сперматозоидов с центральной ячейки вызвать эндосперма. Эндосперм ткани, где происходит печать в растениях. Медея, SET домена Polycomb группы генов, а FWA, транскрипционный фактор регулирующих цветение, это первые два гена, показано, что запечатлелось в эндосперма и их выражения контролируется метилирования ДНК и деметилирования растений. Для того чтобы определить статус импринтинга генов и метилирования в эндосперм, мы должны быть в состоянии изолировать эндосперма в первую очередь. Так как семена в крошечных Arabidopsis, она остается сложной, чтобы изолировать Arabidopsis эндосперма и изучить его метилирования. В этом видео-протокол, мы сообщаем о том, как проводить генетические крест, чтобы изолировать эндосперма ткани из семян, и для определения статуса метилирования путем секвенирования бисульфит.
протокол
И. Генетическая Пересечение
1. Ослабление женский родитель
Для того чтобы отличить материнских и отцовских аллелей с помощью последовательности ДНК, полиморфизм, два разных экотипов, например, Columbia-0 (Col-0) и Лера, будет выбран как женские и мужские родителей. Растения должны быть молодыми и здоровыми. Можно кастрировать женский родитель с помощью рассекает микроскоп, увеличительное козырек, или невооруженным глазом. Найдите этап-12 цветов (Смит и соавт., 1990) и удалите все цветки или siliques выше и ниже их, закрепляя базе ножка с ножницами. Стерилизуйте пинцеты, опуская базе кончик аккуратно в стакан 95% этанола, который удалит все пыльцевые зерна от щипцов и убить пыльцы, а также. Слегка приподнимите кроме цветочных почек использованием щипцов и аккуратно удалить 4 чашелистиков, 4 лепестков, и 6 тычинок, оставляя голый пестик и сохранности. Постарайтесь, чтобы избежать повреждения плодолистиков во время этого процесса.
2. Сбор пыльцы донора и проведения опыления
Лучших доноров пыльцы anthesed распускающиеся цветы на стадии 14 с лепестками на расширение углом 90 ° к пестика (Смит и соавт., 1990), в котором много пыльцы потерю. Возьмите цветок у основания и чуть выше ножках, которая будет вызывать цветок распространять открыто. Пыль клеймо подготовлены пестик с пыльников. После опыления, стигма будет покрыта желтой пыльцой, которую легко можно наблюдать под микроскопом.
3. Маркировка крест
После опыления все выхолощена пестики на заводе, мы обозначаем крест с тегом ювелирные изделия и информации женщин и мужчин среди родителей и дату. Место долю в почву рядом с завода, использовать строку, чтобы связать стебля соцветия на костер, и охватывают опыляются пестики с полиэтиленовом пакете.
II. Выделение Эндосперм ткани в Arabidopsis
1. Подготовка материалов
Мы обычно получают необходимые материалы готовы до сбора урожая эндосперма и зародыша тканей: резервуар жидкого азота, жидкого азота, рассекающих микроскоп, две новые пары тонкой кончик щипцов (5 INOX ФСТ по Дюмон биологии, Швейцария.), Слайды микроскопом стекла ( 3 "X 1" Х 1,0 мм), рН 5,7 решением 0,3 М сорбит и 5 мМ MES.
2. Сбор siliques
В 7 - или 8-дневного после опыления (DAP), семена готовы к собирают в середине-конце торпедных стадии эмбриогенеза и расчлененный для эндосперма и зародыша. Иногда это может занять 9-10 DAP, если выхолощена цветы слишком молод.
3. Изоляция эндосперма и зародыша
Так как семена арабидопсиса представляют собой крошечные, мы используем рассекает микроскопом, чтобы изолировать эндосперма и зародыша. Положите 8-DAP silique под микроскопом, используйте пару щипцов провести silique ножки и использовать кончик другая пара щипцов, чтобы раздвинуть silique на полях, где два плодолистиков предохранитель. Используйте пару щипцов, чтобы забрать одно семя на рН 5,7 растворов 0,3 М сорбит и 5 мМ MES, сделайте небольшой надрез на микропиле конец выдвигающимся эмбриона, выжать режиссерский конец вытолкнуть эндосперма и отдельных эндоспермом от семенной кожуры (Киносита и соавт., 2004). Положите зародыша и эндосперма на отдельные микротрубочки в жидком азоте. Продолжайте, пока мы накапливаем эмбриона или эндосперма от 10-15 siliques и затем сохранить трубу в морозильной камере -80 ° C. В некоторых случаях, эндосперм не должны быть отделены от семенной оболочки, то есть, можно выделить общую РНК из эндосперма и смесь семян пальто для анализа генов импринтинга.
III. Бисульфит Секвенирование
1. Обязательные реагентов
Cetyltrimethyl бромида аммония (СТАВ) для подготовки геномной ДНК, ферментов рестрикции, 3 М NaOH (свежеприготовленный), 6,42 М мочевиной / 4 M бисульфита натрия (2 М натрий метабисульфит, Sigma-Aldrich, S9000, Na2S2O5, Молекулярный вес: 190), 10 мМ гидрохинон, комплект очистки ДНК (Promega Мастер ДНК очистки системы, Кат. # A7280), TE буфера, 6,3 М NaOH (свежеприготовленный), 10 М NH 4 OAc, 20 мкг / мкл тРНК, и 100% этанола .
2. Информация о протоколе лечения бисульфит
- Изолировать геномной эндосперма или эмбриона ДНК с использованием процедуры ЦТАБ (Роджерс и Bendich, 1988).
- Дайджест 100 нг - 2 мкг геномной ДНК в 20 мкл до 100 мкл общего объема ферментами рестрикции, что сокращение за пределами региона, которые будут проанализированы. Для промоутера MEA, мы используем XhoI, NdeI и PstI или HindIII.
- Денатурации ферментов рестрикции путем кипячения ДНК в течение пяти минут, а затем погасить на льду.
- Добавить 1 / 9 объемов (2,2 мкл на 20 мкл ДНК переваривается) от 3 М NaOH и инкубировать при температуре 37 ° С в течение 15 минут.
- Передача решение 250 мкл ПЦР-пробирку.
- Растворите 7,5 г мочевины в 10 мл стерильной дистиллированной воды; Медленно добавьте 7,6 г натрия метабисульфит в течение 1-2 часов и отопления обычно помогает растворению; Отрегулируйте рН до 5 от свежеприготовленных 10 М NaOH; Добавить стерильной дистиллированной водой до конечного объем до 20 мл. Это 6,24 М мочевиной / 4 М раствор бисульфита натрия.
- Добавить 6,24 М мочевиной / 4 M бисульфита натрия решение конечной концентрации 5,36 М и 3,44 М, соответственно (Паулин и соавт., 1998). Например, добавьте 208 мкл 6,42 М мочевиной / 4 M бисульфита натрия решение выше 22,2 мкл денатурированного геномной ДНК (Xiao и соавт., 2003).
- Добавьте 10 мМ гидрохинон, чтобы ДНК в конечной концентрации 0,5 мм (12 мкл на 20 мкл пищеварение).
- Поведение бисульфит лечение в машине ПЦР: 30 циклов 55 ° С в течение 15 минут и 95 ° С в течение 30 секунд.
- Опреснения бисульфит лечение ДНК с использованием ДНК-Мастер очистку системы от Promega и последующих протоколов (Jacobsen и соавт., 2000).
- Измерить точный объем TE оправился от столбец после обессоливания и добавить 6,3 М NaOH до конечной концентрации 0,3 М. Инкубировать при 37 ° С в течение 15 минут.
- Добавьте 10 М NH 4 OAc (рН 7,0) до конечной концентрации 3 М, 2 мкл 20 мкг / мкл тРНК, а 3-х томах 100% этанола, а затем перемешать. Центрифуга в течение 15 минут при 14000 оборотах в минуту.
- Вымойте гранулы сразу с 70% этанола, сделать короткий центрифугу, и удалить лишние этанола.
- Сухой осадок в speedvac в течение 5-10 минут и ресуспендируют в 25 - 100 мкл буфера TE в зависимости от суммы, начиная ДНК. Бисульфита натрия обработанной ДНК готов для анализа ПЦР.
3. ПЦР-амплификации
- С неметилированный цитозина превращаются в урацил, трудно для усиления большой фрагмент использованием бисульфита обработанной ДНК в качестве матрицы. Таким образом, мы, как правило дизайна праймеров для амплификации продукта не более чем на 500 бп. Для последовательности 4-кб МЭС промоутер, мы разработали много наборов праймеров и усиливаются 14 перекрывающихся фрагментов, чтобы покрыть весь регион (Xiao и соавт., 2003).
- Для последовательности верхней нити, в разработке прямого праймера, I) выбрать G (гуанин)-богатый регион, с тем чтобы иметь более высокую температуру отжига без дополнительных долго нуклеотидов праймеров; II) изменение С (цитозин) в Y ( пиримидин) в КГ и СПГ контекстах и изменить оставшиеся С до Т (тимин). При разработке обратного праймера, I) выбрать C-богатый регион, II) изменение G с R (пуриновые) в КГ и СПГ контекстах и изменить оставшиеся G А (аденин).
- Для последовательности нижней нитей, в разработке прямого праймера, I) выбрать C-богатый регион, II) изменение G с R КГ, и СПГ контекстах и изменить оставшиеся G А. При проектировании обратного праймера, I) выбрать G-богатой области; II) изменение С до Y (пиримидин) в КГ и СПГ контекстах и изменить оставшиеся С Т.
- Мы обычно используем 1-2 мкл бисульфита натрия обработанной ДНК в качестве шаблона для каждого ПЦР-амплификации (Xiao и соавт., 2003). Продукт ПЦР необходимо проанализировать помощью гель-электрофореза для подтверждения правильного размера фрагмента, то должны быть гель очищенный и клонировали в ТОПО Т. А. клонирования вектор pCR2.1 (Invitrogen) в качестве вставки. Одну колонию подобран и культурной; плазмиды ДНК, извлеченной и отправили для секвенирования.
4. Анализ последовательности
Принцип бисульфит последовательности является то, что неметилированный цитозина будут преобразованы в урацил в связи с гидролитического дезаминирования высокой концентрации натрия бисульфит на pH5.0 которая будет усиливаться, как тимина в ПЦР-продукт, в то время 5-метил цитозина не будут изменены бисульфит натрия и продолжают оставаться цитозин после ПЦР-амплификации (Кларк и др., 1994;. Фроммер и др., 1992.). После получения последовательности результате, мы сравним его с прядь конкретного шаблона, который используется для ПЦР-амплификации. Если остаток цитозина в шаблоне гласит тимина в последовательности результат, это означает, что цитозин не метилированию. Если остаток цитозина в шаблон остается цитозина в последовательности, это означает, что цитозин метилированию.
IV. Представитель Результаты
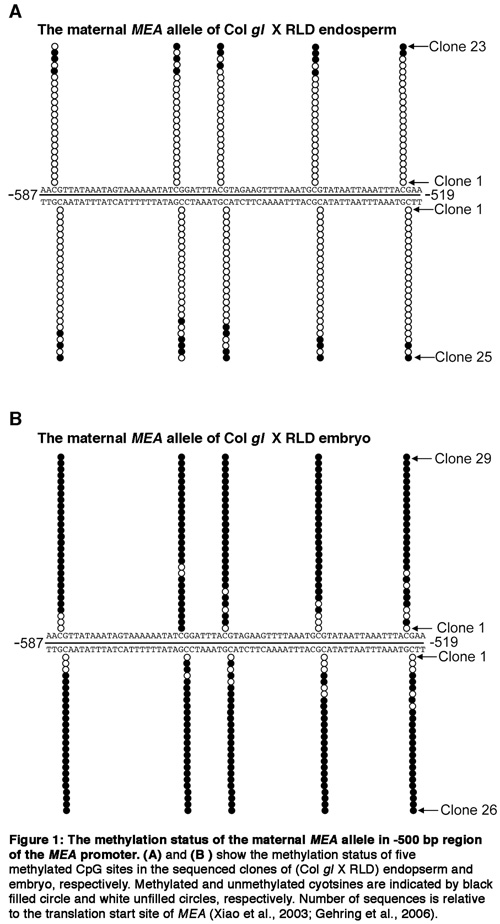 Рисунок 1.
Рисунок 1.
Обсуждение
Это сравнительно легко отделить зародыш от эндосперма и кожуры, но это утомительно отдельных эндоспермом от кожуры, особенно для семян в начале или в середине торпедо стадии эмбриогенеза. Так как семенная оболочка только способствует очень небольшое количество ткани, для некоторых ге...
Раскрытие информации
Благодарности
Авторы выражают благодарность г-жа Дженнифер М. Ломмеля и Тары Н. Rognan для поддержания Arabidopsis растений. Эта работа была поддержана запуска средства из Сент-Луиса университета и Национального института здоровья гранты 1R15GM086846-01 и 3R15GM086846-01S1 к В. Сяо.
Материалы
Запас
- Препаровальная лупа
- Ножницы
- Изобразительное Пинцет Совет
- Ювелирные изделия тегов
- Завод ставки
- Строка или Twist-связей
- 4 "x 2" x 8 "Мешки полиэтиленовые
- 3 "X 1" Х 1,0 мм слайды микроскоп
- Жидкий азот
- Жидкий азот Контейнеры
- Тепло Блок
- ПЦР трубы
- Термоциклер
- Микроцентрифуга трубы
- Микроцентрифуга
- Объекта гель-электрофореза
- Arabidopsis thaliana Columbia-0 Растения
- Arabidopsis thaliana Ландсберг erecta Растения
Реагенты
- 70% этанола
- 95% этанола
- 100% этанола
- 0,3 М сорбит и 5 мМ MES-рН 5,7
- Cetyltrimethyl бромид (СТАВ)
- 100% этанола
- Cholorform
- Рестриктаз
- 3 М NaOH
- 6,3 М NaOH
- 6,24 м карбамид / 4 M бисульфит натрия
- Стерильной дистиллированной H 2 O
- 10 мМ Гидрохинон
- Мастер ДНК Clean-Up системы (Promega)
- 10 М NH 4 OAc
- 20 мкг / мкл тРНК
- ТЕ-буфера
- ТОПО Т. А. Клонирование Kit (Invitrogen)
Ссылки
- Clark, S. J., Harrison, J., Paul, C. L., Frommer, M. High sensitivity mapping of methylated cytosines. Nucleic Acids Res. 22, 2990-2997 (1994).
- Cokus, S. J., Feng, S., Zhang, X., Chen, Z., Merriman, B., Haudenschild, C. D., Sriharsa Pradhan, S., Nelson, S. F., Pellegrini, M., Jacobsen, S. E. Shotgun bisulphite sequencing of the Arabidopsis genome reveals DNA methylation patterning. Nature. 452, 215-219 (2008).
- Frommer, M., McDonald, L. E., Millar, D. S., Collis, C. M., Watt, F., Grigg, G. W. A genomic sequencing protocol that yields a positive display of 5-methylcytosine residues in individual DNA strands. Proc Natl Acad Sci USA. 89, 1827-1831 (1992).
- Gehring, M., Huh, J. H., Hsieh, T. F., Penterman, J., Choi, Y., Harada, J. J., Goldberg, R. B., Fischer, R. L. D. E. M. E. T. E. R. DNA glycosylase establishes MEDEA polycomb gene self-imprinting by allele-specific demethylation. Cell. 124, 495-506 (2006).
- Henderson, I. R., Chan, S. R., Cao, X., Johnson, L., Jacobsen, S. E. Accurate sodium bisulfite sequencing in plants. Epigenetics. 5, 47-49 (2010).
- Hsieh, T. F., Ibarra, C. A., Silva, P., Zemach, A., Eshed-Williams, L., Fischer, R. L., Zilberman, D. Genome-wide demethylation of Arabidopsis endosperm. Science. 324, 1451-1454 (2009).
- Jacobsen, S. E., Sakai, H., Finnegan, E. J., Cao, X., Meyerowitz, E. M. Ectopic hypermethylation of flower-specific genes in Arabidopsis. Curr. Biol. 10, 179-186 (2000).
- Kinoshita, T., Miura, A., Choi, Y., Kinoshita, Y., Cao, X., Jacobsen, S. E., Fischer, R. L., Kakutani, T. One-way control of FWA imprinting in Arabidopsis endosperm by DNA methylation. Science. 303, 521-523 (2004).
- Lister, R., O'Malley, R. C., Tonti-Filippini, J., Gregory, B. D., Berry, C. C., Millar, A. H., Ecker, J. R. Highly integrated single-base resolution maps of the epigenome in Arabidopsis. Cell. 133, 523-536 (2008).
- Lister, R., Pelizzola, M., Dowen, R. H., Hawkins, R. D., Hon, G., Tonti-Filippini, J., Nery, J. R., Lee, L., Ye, Z., Ngo, Q. -. M. Human DNA methylomes at base resolution show widespread epigenomic differences. Nature. 462, 315-322 (2009).
- Paulin, R., Grigg, G. W., Davey, M. W., Piper, A. A. Urea improves efficiency of bisulfite-mediated sequencing of 5'- methylcytosine in genomic DNA. Nucl. Acids Res. 26, 5009-5010 (1998).
- Rogers, S. O., &, B. e. n. d. i. c. h., J, A. Extraction of DNA from plant tissues. Plant Molecular Biology Manual. A6, 1-10 (1988).
- Smyth, D. R., Bowman, J. L., Elliot, M., Meyerowitz, E. M. Early Flower Development in Arabídopsis. Plant Cell. 2, 755-767 (1990).
- Xiao, W., Gehring, M., Choi, Y., Margossian, L., Pu, H., Harada, J. J., Goldberg, R. B., Pennell, R. I., Fischer, R. L. Imprinting of the MEA Polycomb gene is controlled by antagonism between MET1 methyltransferase and DME glycosylase. Dev. Cell. 5, 891-901 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены