Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
В естественных условиях и в пробирке исследования Адаптер-клатрин Взаимодействие
В этой статье
Резюме
Клатрин эндоцитоза зависит от адаптера белков, которые координируют отбор грузов и клатрин сборки пальто. Здесь мы описываем процедуры для изучения адаптера клатрин физического взаимодействия и живые изображения ячейки подходов, используя в качестве модели дрожжей endocytic Sla1p белка адаптера.
Аннотация
Основные endocytic пути инициирует с образованием клатриновых везикулы (CCVS), которые перевозят грузы из клеточной поверхности, чтобы эндосомы 1-6. CCVS отличаются многогранным решетки клатрин, что пальто пузырьков мембраны и служит в качестве механического эшафот. Клатрин пальто собраны во время образования пузырьков из отдельных клатрин triskelia, растворимой формы клатрин состоит из трех тяжелых и три легких цепей субъединиц 7,8. Потому что трискелион не обладают способностью связываться с мембранной напрямую, клатрин-связывающий адаптеры имеют решающее значение для формирования ссылки клатрин решетки мембраны через ассоциацию с липидами и / или мембранных белков 9. Адаптеры также пакет трансмембранный белок грузов, таких как рецепторы, и могут взаимодействовать друг с другом и с другими компонентами образование ССГ техники 9.
Более двадцати клатрин адаптеры были описаны, некоторые из них участвуют в клатрин эндоцитоза и другие локализации в транс Гольджи сеть или эндосомы 9. За исключением HIP1R (дрожжи Sla2p), все известные клатрин адаптеры связываются с N-терминал-рулевых области клатрин тяжелой цепи 9. Клатрин адаптеры являются модульными белки, состоящие из сложенных области, связанные по неструктурированной гибкие линкеры. В рамках этих компоновщик регионах, короткие связывающие мотивы посредником взаимодействий с клатрин N-концевого домена или других компонентов везикул формирование техники 9. Два различных клатрин-связывающие мотивы были определены: клатрин ящик и W-поле 9. Консенсус клатрин коробки последовательность была первоначально определена как L [L / I] [D / E / N] [L / F] [D / E] 10, но варианты были впоследствии обнаружены 11. W-поле соответствует последовательности PWxxW (где х означает каких-либо остатков).
Sla1p (Синтетический Смертельное с актином связывающий белок-1) был первоначально идентифицирован как актин связанных белков и необходим для нормальной структуры цитоскелета актина и динамика на endocytic сайтов в клетках дрожжей 12. Sla1p также связывает NPFxD endocytic сигнал сортировки и имеет решающее значение для эндоцитоза грузов подшипников NPFxD сигнал 13,14. Совсем недавно была продемонстрирована Sla1p связывать клатрин через мотив похож на клатрин окна LLDLQ, называемый вариант клатрин-бокс (VCB), и функционировать как endocytic клатрин адаптера 15. Кроме того, Sla1p стало широко используется маркер endocytic пальто в живой клетки флуоресцентной микроскопии исследования 16. Здесь мы используем Sla1p как модель для описания подходов для адаптера клатрин исследования взаимодействия. Мы ориентируемся на живой микроскопии флуоресценции клетки, GST-кадра, и ко-иммунопреципитации методами.
протокол
1. Включение теги GFP и селективного маркера в SLA1 гена
Применение метода Longtine 17, чтобы предохранитель GFP теги непосредственно на конец 3 'SLA1 гена открытой рамки считывания (Sla1p С-конца) и одновременно знак ген с E. кишечной кан т ген, который обеспечивает выбор G418.
- Создание фрагмента ДНК с помощью ПЦР, используя в качестве шаблона плазмиды pFA6a-GFP (S65T)-kanMX6 18 и следующие грунты: вперед, 5'-CA AGG CAA GCC AAC ATA TTC ААТ GCT ACT GCA TCA ААТ CCG ТТТ GGA TTC CGG ATC CCC GGG TTA ATT АА-3 ', а наоборот, 5'-CA ТАТ AGC ТТГ ТТТ TAG TTA TTA TCC TAT AAA УВД, TTA AAA TAC ATT ААТ GAA TTC GAG СТС GTT ТАА AC-3'. Подчеркнул последовательность соответствует SLA1 генов конкретного сегмента, непосредственно предшествующих (прямого праймера) и после стоп-кодона (обратного праймера). Изолировать продукта ПЦР методом электрофореза в агарозном геле последующей очистки ДНК.
- Подготовка 50 мл культуры С. CEREVISIAE SEY6210 деформации (MAΤα URA3-52, leu2-3, 112 his3-Δ200, TRP1-Δ901, lys2-801, suc2-Δ9 GAL-MEL) 19 в YPD, растущие на ранней логарифмической фазы (OD 600 = 0,2-0,6). Спиновые при комнатной температуре в течение 3 мин при 2000 мкг, мыть два раза стерильной водой.
- Преобразование ПЦР фрагмент, полученный на шаге 1 в клетки с помощью процедуры ацетат лития 20. Вымойте клеток с 1 мл стерильной воды, добавить 1 мл YPD и инкубировать в течение 4 часов при температуре 30 ° С в шейкере.
- Распространение клеток на YPD-G418 пластины, чтобы выбрать для G418-устойчивых трансформантов, инкубировать при температуре 30 ° С в течение 2-3 дней. Выберите колоний и полоса их на YPD-G418 пластин.
- Использование колонии-ПЦР, выявление трансформантов, в которых GFP-кан модуль был надлежащим образом интегрированы в SLA1 последовательностей генов путем гомологичной рекомбинации. Использование прямого праймера, что отжигов в SLA1 открытые рамки считывания и обратного праймера, что отжигов внутри GFP-кан модуля. Определить колонии, которые ПЦР продукты ожидаемого размера и проверки путем секвенирования.
- Экран колоний флуоресцентной микроскопии для подтверждения они GFP флуоресценции.
2. Мутация вариант клатрин окне (VCB) в SLA1 гена
- Ввести LLDLQ к AAALQ мутации в гене SLA1 (нуклеотиды 2407-2415) после двухэтапный подход 15.
- Во-первых, усилить SLA1 нуклеотиды 1207-1410 и 2427-2589 с помощью ПЦР и клонирование фрагментов в NotI / BamHI и EcoRI / SalI сайтах pBluescriptKS, соответственно.
- Субклон в BamHI / EcoRI сайтах фрагмента ПЦР содержащие URA3.
- Клив результате плазмида с NotI / SalI, изолировать URA3 фрагмента геля очистки, и ввести его ацетат лития превращение в Sla1-GFP напряжение генерируется в части 1, или в TVY614 (МАТА URA3-52-3112 leu2 his3-Δ200 TRP1 -Δ901 lys2-801 suc2-Δ9 pep4:: LEU2 prb1:: HISG prc1:: HIS3) 21.
- Распространение клеток на дополнена SD пластин хватает урацил. Подтвердите колонии-ПЦР и секвенирования, что Ura + колониях содержатся должным образом интегрированы URA3 замену VCB фрагмента.
- На втором этапе, субклон SLA1 нуклеотидов в 1207-2589 NotI / SalI сайтах pBluescriptKS. Использование QuickChange-XL сайт-направленного мутагенеза комплект (Stratagene), мутировать VCB остатков LLDLQ к AAALQ. Проверка с помощью секвенирования.
- Клив в результате построить с BsgI / AgeI и изолировать мутантов VCB содержащие фрагмента геля очистки. Cotransform BsgI / AgeI фрагмент с pRS313 (HIS3) 22 в штамм получен в части 2.3.
- Распространение клеток на дополнена SD пластин хватает гистидина. Реплика пластины Его + колоний на агар, содержащий 5-fluorotic кислоты для идентификации клеток, в которых мутантных последовательностей заменено URA3, таким образом, регенерирующим sla1 генов содержащих LLDLQ к AAALQ мутации (sla1 ААА). Подтвердите колонии-ПЦР и секвенирования.
3. Люминесцентной микроскопии
- Рост штаммов дрожжей Sla1-GFP и sla1 AAA-GFP генерируется в частях 1 и 2 в 4 мл дополнена SD средах при 30 ° С в ротатор в темноте до достижения OD 600 = 0,1-0,4. Спиновые 1 мл культуры в микроцентрифужных при 4000 мкг в течение 1 мин при комнатной температуре. Отменить ~ 950 мкл надосадочной жидкости. Ресуспендируют клеток в оставшейся жидкости (~ 50 мкл).
- Депозит 3 мкл суспензии клеток на микроскопию слайдов и накройте покровным стеклом. Защита образца от света месте.
- Горы скользить по 100x нефтью погружения цель прядильно-диск конфокальной микроскопии.
- Найдите правильный фокальной плоскости клетки с использованием светлого освещения или 488 нм лазер с соответствующими фильтрами для возбуждения и обнаружения флуоресценции GFP.
- Захват покадровой образы Sla1-GFP и sla1 AAA-GFP в клетках с временем экспозиции 500 мс (или соответствующее значение) прин интервалом в один образ в секунду в течение 150 секунд. Ожидаемый результат: GFP помечены punctae появится на внутренней поверхности пограничная мембрана клетки, сохраняться в течение нескольких секунд, и двигаться по направлению к центру клетки как сигнал быстро исчезает (с указанием пальто разборки).
- Выберите часть изображения, в котором видны пятна появляются, оставаться в течение нескольких секунд, и исчезают. Crop этот раздел на изображение для каждого кадра покадровой изображений.
- Создание кимограф представляющих этот раздел изображения в каждом кадре 150 второй покадровой изображение, выравнивая кадры вдоль оси, соответствующей времени прошло.
- Рассчитать продолжительность каждого пятна в зависимости от количества секунд (покадровой кадров) пятна присутствует в кимографе. Обратите внимание, что каждое пятно должно "кривой" вглубь клетки как она исчезает, отражающие эндоцитоза и разборки покрытия.
- Сравните дикого типа Sla1-GFP с sla1 AAA-GFP. Повторите, чтобы определить, статистически значимые результаты. Ожидаемый результат: sla1 AAA-GFP пятна сохраняться значительно дольше (~ 80 сек), чем дикого типа (~ 30 сек) с указанием дефекта в пальто образование 15.
4. Подготовка дрожжей цитозольного экстракта и общего экстракта ячейки
- Привить 3 литра YPD с соответствующим штамм дрожжей, таких как TVY614 21, и расти при температуре 30 ° С в шейкере инкубаторе до достижения OD 600 = 1-2.
- Центрифуга культуры дрожжей при комнатной температуре в течение 20 мин при 3700 х г. Удалите надосадочную, добавить 3-5 мл стерильной воды и пипеткой вверх и вниз, пока осадок полностью ресуспендировали.
- Налейте ~ 150 мл жидкого азота в 250 мл стакан пластиковый. Flash-замораживания дрожжей, добавляя по каплям в жидком азоте в круговой схеме, чтобы избежать склеивания замороженных гранул. Не позволяйте гранулы оттепели, добавьте еще жидкий азот, если необходимо.
- Холод нержавеющей стали блендер контейнер при заливке жидкого азота в ней. Разрешить жидкий азот, чтобы почти полностью испариться. Добавить замороженных гранул дрожжей холодном контейнере блендера. Закрыть контейнер блендере с холодной резиновой пробкой и растереть дрожжи гранул в течение 10 секунд. Обратить контейнер в 3-4 раза, чтобы перемешать содержимое и повторите шаг шлифовальные дважды. Земли замороженных дрожжей придется порошок вид.
- Холод воронку и 50 мл коническую трубку с жидким азотом. Использование холодной воронки, передача земли дрожжей до трубы. Замороженных дрожжей землю можно хранить при температуре -80 ° С или использовать немедленно.
- Для получения цитозольного экстракт для GST-синтез белка сродством анализа (Часть 5), весом 3 г мерзлота TVY614 дрожжи в 15 мл коническую трубку и ресуспендируют в 3 мл буфера комнате температура (10 мМ HEPES, рН 7,0, 150 мМ NaCl, 1 мМ ЭДТА, 1 мМ DTT), содержащий ингибитор протеазы коктейль (Sigma).
- Кап, и инвертировать трубку несколько раз, пока полностью оттаять, а затем положить на лед.
- Ультрацентрифуге экстракта при температуре 4 ° С в течение 20 мин при 300 000 х г. Тщательно передачи супернатант (цитозольного экстракта) для конической трубе с помощью пипетки, не нарушая гранул. Держите цитозольного экстракта на льду.
- Добавить 100 мкл 50% (объем / объем) глутатион-сефарозой суспензии в буфере А. Это удобно резать конце наконечник для облегчения pipeting бисером. Поворот при 4 ° С в течение 15 мин, спин-вниз бисером центрифугированием при 4 ° С в течение 2 мин при 1000 мкг, а также передачу супернатант (цитозольного экстракта) в новую пробирку. Резервный 50 мкл экстракта для управления вводом.
- Для получения общего экстракты ячейки для совместной иммунопреципитации эксперименты (часть 6), используйте напряжение TVY614 (WT SLA1), sla1 AAA штамм, несущий LLDLQ к AAALQ мутации генерируется в части 2 в TVY614 фон, и sla1 штамм, несущий удаление SLA1 генов, таких как GPY3130 23. Вес 2 г соответствующего замороженных дрожжей землю в конических труб и ресуспендирования них в 2 мл буфера комнате температуру, содержащий ингибитор протеазы коктейль (Sigma) и 2% Тритон Х-100.
- Кап, и инвертировать трубку несколько раз, пока полностью оттаять, а затем инкубируют на льду в течение 10 мин, периодически перемешивания инверсии.
- Передача материала микроцентрифужных труб и спина при температуре 4 ° С в течение 15 мин при 16 000 мкг (максимальная скорость в микроцентрифужных). Тщательно передачи супернатант (всего извлекать ячейки) для конической трубе на льду с помощью пипетки, не нарушая гранул.
- Добавить 100 мкл 50% (объем / объем) белка-сефарозой суспензии в буфере А. Поворот при 4 ° С в течение 15 мин, спин-вниз бисером центрифугированием при 4 ° С в течение 2 мин при 1000 мкг, а также передачу супернатант (всего экстракт), чтобы свежие трубки. Резервный 50 мкл экстракта для управления вводом.
5. GST-синтез белка сродством анализа
- Amplify методом ПЦР фрагмент containiнг вариант Sla1p клатрин-бокс (VCB) (остатки 803-807), клонировать ее в pGEX-5X для получения pGEX-5X-VCB. Проверка с помощью секвенирования.
- Использование pGEX-5X-VCB в качестве шаблона и QuickChange-XL сайт-направленного мутагенеза комплект (Stratagene), мутировать VCB остатков LLDLQ к AAALQ получить pGEX-5X-vCBmut. Проверка с помощью секвенирования.
- Экспресс GST и слитых белков GST-VCB и GST-vCBmut в E. палочка (BL21 DE3), очищают использованием глутатион-сефарозой, вымывается из бисера с восстановленный глутатион, диализировать против PBS, и определить концентрации белка.
- Этикетка 3 микроцентрифужных труб: GST, GST-VCB и GST-vCBmut, и добавьте 1 мл PBS, 30 мкл 50% (объем / объем) глутатион-сефарозой суспензии в буфер, и 50 мкг dialized GST, GST -VCB или GST-vCBmut слитых белков.
- Поворот при комнатной температуре в течение 30 мин, чтобы обеспечить обязательную силу.
- Вымойте бисером 2 раза PBS и 1 раз с буфером А. Добавьте 1 мл экстракта дрожжей цитозольного - получают, как описано в Части 4 - в каждую пробирку.
- Поворот трубы 1 ч при 4 ° С, спин 10 сек при 5000 мкг в гранулах бусы, отбросить супернатант, и быстро вымыть бисером 3 раза буфером, содержащим 0,1% Тритон Х-100, и 1 раз в буфере А.
- Спином вниз бисером еще раз и с помощью кончика гель загрузки удалить как можно больше жидкости, как это возможно. На этом этапе образцы могут храниться при температуре -20 ° C продолжить на более позднее время.
- Добавить 15 мкл 2х буфера образца Laemmli в каждую пробирку, инкубировать при 96 ° С в течение 5 мин, а спина 10 сек при 5000 х г.
- Анализ образцов иммуноблоттинга использованием антител к клатрин тяжелой цепи. Ожидаемые результаты: клатрин связывается с GST-VCB но не GST или GST-vCBmut. Кроме того, анализ образцов SDS-PAGE, чтобы подтвердить подобный загрузки белков GST синтеза.
6. Сотрудничество иммунопреципитации анализа
- Этикетка 3 микроцентрифужных труб: WT (дикого типа SLA1), sla1 AAA, и sla1Δ, и добавьте 1 мл PBS, 30 мкл 50% (объем / объем) белка-сефарозой суспензии в буфер, и 2 мкг кролика против Sla1p антител.
- Поворот при комнатной температуре в течение 30 мин.
- Вымойте бисером два раза PBS и 1 раз с буфером, содержащим 1% Тритон Х-100.
- Добавить 1 мл соответствующего общего экстракта дрожжей, подготовленный в Часть 4: SLA1, sla1 AAA, и sla1Δ. Поворот 1 ч при 4 ° C.
- Спиновые 10 сек при 5000 мкг в гранулах бусы, отбросить супернатант, и быстро вымыть бисером 3 раза буфером, содержащим 0,1% Тритон Х-100, и 1 раз в буфере А.
- Спином вниз бисером еще раз и с помощью кончика гель загрузки удалить как можно больше жидкости, как это возможно. На этом этапе образцы могут храниться при температуре -20 ° C продолжить на более позднее время.
- Добавить 15 мкл 2х буфера образца Laemmli в каждую пробирку, инкубировать при 96 ° С в течение 5 мин, а спина 10 сек при 5000 х г.
- Анализ образцов иммуноблоттинга использованием антител к клатрин тяжелой цепи. Ожидаемые результаты: клатрин совместно иммунопреципитатах с дикими Sla1p типа, но не с sla1 ААА, или в образце sla1Δ.
7. Представитель Результаты
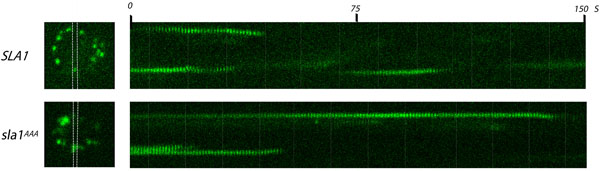
Рисунок 1. Анализ Sla1p клатрин адаптера endocytic сайтов жить микроскопии флуоресценции клеток. Один кадр (слева) из видео и соответствующие kymographs (справа) дрожжевых клеток, экспрессирующих Sla1-GFP или sla1 AAA-GFP проведения LLDLQ к мутации AAALQ. Оба дикого типа и мутантных Sla1-GFP были выражены с эндогенными SLA1 локуса. Endocytic сайтов наблюдаются как яркие пятна распространяются в периферии клетки (слева изображений). Область между белыми линиями соответствует области, из которой kymographs были получены. Фильмы были приняты на частоту кадров 1 кадр / сек. Обратите внимание, больше жизни Sla1-GFP в LLDLQ к AAALQ мутант (sla1 ААА) по сравнению с диким типом (SLA1).
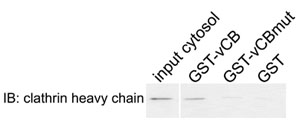
Рисунок 2. Физические взаимодействия между клатрин и Sla1p-вариант клатрин коробки. GST слит с Sla1p фрагмент aa798-813, содержащий последовательность LLDLQ (GST-VCB), соответствующие AAALQ мутант (GST-vCBmut), или только GST (GST) были связаны с глутатион-сефарозой бисером и инкубировали с цитозольного выписка из дикого клетки типа дрожжей. Белков, связанных с элюировали и проанализированы с помощью метода иммуноблоттинга (ИБ) для клатрин тяжелой цепи.
Обсуждение
Клатриновых везикулы (ССГ) участвовать в эндоцитоза и транспорта из транс-Гольджи сеть и эндосомы, сохраняется путей, которые являются основополагающими для эукариотических клеточной биологии. Подходов, описанных в этой статье методы полезны для изучения молекулярных механизмо?...
Раскрытие информации
Благодарности
DF поддерживается NSF Мосты в доктора общения. Микроскоп используется в этой работе при частичной поддержке микроскоп изображений сети основной инфраструктуры грант Университета штата Колорадо. Работа над клатрин адаптеров в лаборатории автора с поддерживается ХСС стартовый капитал и американские награды ассоциации сердца 09SDG2280525 для SD
Материалы
| Материал | Компания | ||
|---|---|---|---|
| Name | Company | Catalog Number | Comments |
| QuickChange-XL сайт-направленного мутагенеза комплект | Stratagene | ||
| ингибитор протеазы коктейль | Сигма |
Ссылки
- Mellman, I., Warren, G. The road taken: past and future foundations of membrane traffic. Cell. 100, 99-112 (2000).
- Engqvist-Goldstein, A. E., Drubin, D. G. Actin assembly and endocytosis: from yeast to mammals. Annu Rev Cell Dev Biol. 19, 287-332 (2003).
- Conner, S. D., Schmid, S. L. Regulated portals of entry into the cell. Nature. 422, 37-44 (2003).
- Bonifacino, J. S., Traub, L. M. Signals for sorting of transmembrane proteins to endosomes and lysosomes. Annu Rev Biochem. 72, 395-447 (2003).
- Ungewickell, E. J., Hinrichsen, L. Endocytosis: clathrin-mediated membrane budding. Curr Opin Cell Biol. 19, 417-425 (2007).
- Doherty, G. J., McMahon, H. T. Mechanisms of endocytosis. Annu Rev Biochem. 78, 857-902 (2009).
- Kirchhausen, T. Clathrin. Annu Rev Biochem. 69, 699-727 (2000).
- Brodsky, F. M., Chen, C. Y., Knuehl, C., Towler, M. C., Wakeham, D. E. Biological basket weaving: formation and function of clathrin-coated vesicles. Annu Rev Cell Dev Biol. 17, 517-568 (2001).
- Owen, D. J., Collins, B. M., Evans, P. R. Adaptors for clathrin coats: structure and function. Annu Rev Cell Dev Biol. 20, 153-191 (2004).
- Dell'Angelica, E. C., Klumperman, J., Stoorvogel, W., Bonifacino, J. S. Association of the AP-3 adaptor complex with clathrin. Science. 280, 431-434 (1998).
- Dell'Angelica, E. C. Clathrin-binding proteins: got a motif? Join the network!. Trends Cell Biol. 11, 315-318 (2001).
- Holtzman, D. A., Yang, S., Drubin, D. G. Synthetic-lethal interactions identify two novel genes, SLA1 and SLA2, that control membrane cytoskeleton assembly in Saccharomyces cerevisiae. J Cell Biol. 122, 635-644 (1993).
- Howard, J. P., Hutton, J. L., Olson, J. M., Payne, G. S. Sla1p serves as the targeting signal recognition factor for NPFX(1,2)D-mediated endocytosis. J. Cell. Biol. 157, 315-326 (2002).
- Mahadev, R. K., Pietro, S. M. D. i., Olson, J. M., Piao, H. L., Payne, G. S., Overduin, M. Structure of Sla1p homology domain 1 and interaction with the NPFxD endocytic internalization motif. EMBO J. 26, 1963-1971 (2007).
- Pietro, S. M. D. i., Cascio, D., Feliciano, D., Bowie, J. U., Payne, G. S. Regulation of clathrin adaptor function in endocytosis: A novel role for the SAM domain. EMBO J. 29, 1033-1044 (2010).
- Kaksonen, M., Toret, C. P., Drubin, D. G. A modular design for the clathrin- and actin-mediated endocytosis machinery. Cell. 123, 305-320 (2005).
- Longtine, M. S., McKenzie, A., Demarini, D. J., Shah, N. G., Wach, A., Brachat, A., Philippsen, P., Pringle, J. R. Additional modules for versatile and economical PCR-based gene deletion and modification in Saccharomyces cerevisiae. Yeast. 14, 953-9561 (1998).
- Wach, A., Brachat, A., Alberti-Segui, C., Rebischung, C., Philippsen, P. Heterologous HIS3 marker and GFP reporter modules for PCR-targeting in Saccharomyces cerevisiae. Yeast. 13, 1065-1075 (1997).
- Robinson, J. S., Klionsky, D. J., Banta, L. M., Emr, S. D. Protein sorting in Saccharomyces cerevisiae: isolation of mutants defective in the delivery and processing of multiple vacuolar hydrolases. Mol Cell Biol. 8, 4936-4948 (1988).
- Ito, H., Fukuda, Y., Murata, K., Kimura, A. Transformation of intact yeast cells treated with alkali cations. J. Bacteriology. 153, 163-168 (1983).
- Vida, T. A., Emr, S. D. A new vital stain for visualizing vacuolar membrane dynamics and endocytosis in yeast. J Cell Biol. 128, 779-792 (1995).
- Sikorski, R. S., Hieter, P. A system of shuttle vectors and yeast host strains designed for efficient manipulation of DNA in Saccharomyces cerevisiae. Genetics. 122, 19-27 (1989).
- Piao, H. L., Machado, I. M., Payne, G. S. NPFXD-mediated endocytosis is required for polarity and function of a yeast cell wall stress sensor. Mol Biol Cell. 18, 57-65 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены