Method Article
Nucleofection и первичной культуры эмбриональных Мышь гиппокампа и корковых нейронов
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает шаги, необходимые для расчленения, трансфекции с помощью электропорации и культуры гиппокампа мышей и корковые нейроны. Краткосрочные культуры могут быть использованы для изучения результатом аксонов и руководства, в то время как долгосрочные культуры могут быть использованы для изучения синаптогенез и дендритные анализ позвоночника.
Аннотация
Гиппокампа и коры нейроны широко используются для изучения центральной нервной системы (ЦНС) нейронов поляризации, аксон / дендритов результат, формирования синапсов и функции. Преимущество культивирования этих нейронов является то, что они с готовностью поляризации, формируя отличительные аксонов и дендритов, на двумерной подложке при очень низкой плотности. Это свойство делает их чрезвычайно полезными для определения многих аспектов развития нейронов. Кроме того, путем предоставления глиальных кондиционирования для этих нейронов они будут продолжать развиваться, образуя функциональные синаптических связей и выжить в течение нескольких месяцев в культуре. В этом протоколе мы опишем технику до расчленения, культуры и трансфекции эмбриональных мыши гиппокампа и коры нейроны. Трансфекция осуществляется electroporating ДНК в нейронах перед покрытием через nucleofection. Этот протокол имеет то преимущество, выразив флуоресцентно с метками слитые белки на ранних стадиях развития (~ 4-8 часов после покрытия) для изучения динамики и функции белков в процессе поляризации, результатом аксонов и ветвления. Мы также обнаружили, что этот единственный трансфекции до покрытие сохраняет флуоресцентно-выражение-метку гибридный белок на уровнях, соответствующих для работы с изображениями в течение всей жизни нейрона (> 2-х месяцев в культуре). Таким образом, данная методика полезна для изучения локализации белка и функции на протяжении развития ЦНС практически без нарушения функции нейронов.
протокол
1. Подготовка Покровные и палат
- Подготовка чистых покровных и камер имеет важное значение для здорового культур. Ярлыки не должно быть принято в любой из этих шагов.
- Вымойте покровные (12 мм или 22 мм круглые, немецкий стекла - Каролина помощника Марка) в течение ночи в концентрированной азотной кислоты (HNO3) в специальном стеклянную банку или стакан.
- Удалить покровные из азотной кислоты и вымыть широко (5-7x) в деионизированной воде.
- Отдельные покровные и сухой в ламинарном потоке или биобезопасности кабинета. При сухой, стерилизовать их УФ-светом в течение 30 минут. Место стерилизовать покровных в стерильные чашки Петри для хранения. Если покрытие нейронов на 12 мм покровные непосредственно место покровных в стерильные 35 мм блюдо и перейти к разделу 2.
- Изображения камеры построены по бурению 15 мм отверстие в нижней части 35 мм чашки Петри (удалить все заусенцы) и присоединение очищены покровные с 3:01 смесь парафина и вазелина.
- Растопите парафин / вазелин смеси в конической трубе в кипящей водяной бане. Используйте маленькую кисть и пальто нижней блюдо около 15 мм отверстие. Удостоверьтесь, чтобы держать помешивая парафин / вазелин смесь как это будет отдельный. Это обычно приводит к камер склеиваются с более высокой концентрации вазелин, который станет вязкой, когда блюда помещаются в инкубатор, в результате чего покровное отряда. Остальные парафин / вазелин можно хранить при комнатной температуре.
- Место блюдо, положите его на плоскую лоток и место покровное над отверстием. Жара в 80 ° C духовке до парафина смесью плавится (~ 10 минут). Удалить блюда на плоскую поверхность и множество парафина смесью.
- Включите блюда снова и стерилизовать как внутренности крышки и днища камеры с ультрафиолетовым светом.
- Пальто покровные стекла или регионах камеры с 1.0mg/mL поли-D-лизина (30kDa) в боратном буфере (0,1 М бората натрия, рН 8,5) в течение одного часа. Промыть 3-5 раза большим количеством культуры ткани класса деионизированной водой. Убедитесь в том, чтобы удалить все следы боратный буфер. Сухие и использовать сразу или хранить камер / покровные для дальнейшего использования. Мы обычно используем очищены покровных в течение одного месяца подготовки.
2. Подготовка нейронов Разбор и культуральной среды
- Подготовка рассечение среды (DM) путем добавления соответствующих количеств 10x HBSS и 100X HEPES в ткани воды сорт культуры. Хранить при температуре 4 ° С. Держите на льду во время вскрытия.
- За день до вскрытия подготовить покрытие среды (PM) и свободной от сыворотки среде (SFM). PM состоит из Neurobasal Средний, B27 добавки, 2 мМ глутамина, 0,3% глюкозы, 37,5 мМ NaCl и 5% эмбриональной телячьей сыворотки (FBS). SFM состоит из Neurobasal Средний, B27 добавки, 2 мМ глутамина, 0,3% глюкозы и 37,5 мМ NaCl.
- Делайте только достаточно для вскрытия и хранить в культуре ткани инкубаторе в течение ночи с приоткрытой крышкой, так что температура и содержание СО 2 среды уравновешивает. Мы добавляем дополнительные глюкозы и увеличение осмоляльности примерно 310mOsm с NaCl. Мы находим культур лучше на более физиологических осмоляльности (Neurobasal осмоляльности, как правило, 205-245mOsm).
3. Корковая Глиальные Подготовка слоя питатель для долгосрочного культур
- Если долгосрочные культур должны быть подготовлены, выполнить эту часть протокола две-три недели, прежде чем продолжить корковых или гиппокампа вскрытия.
- Подготовка глиальных среды (GM) с MEM, 0,3% глюкозы, пенициллина / стрептомицина и 10% лошадиной сыворотки.
- Эвтаназии P1-P3 щенков мыши при охлаждении на льду в течение 5 минут. Удалить каждого щенка от льда и спрей с 70% этанола. Быстро обезглавить ножницами. Удалите весь мозг, чтобы блюдо с холодной DM (шаг 2.1).
- Удалите два полушария головного мозга и мозговых оболочек. Акцизный неокортекса и удалить его в новое блюдо, не содержащих информации. Подготовка коры мозга в возрасте от 4 общего количества.
- Фарш коры с чистой, стерильной лезвие так хорошо, как можно и удалить нарезанной ткани с пластиковой пипеткой 50 мл коническую трубку, содержащую 12 мл холодной DM. Добавить трипсина и ДНКазы до конечных концентраций 0,25% (1,5 мл) и 0,1% (1,5 мл) соответственно. Инкубируйте в 37 ° С водяной бане в течение 10 минут с прерывистым закрученной.
- Снимите трубку с корковой ткани и чистой водой с 70% этанолом до введения в капот культуры ткани. Внесите корковой ткани вверх и вниз с 10 мл пипетки примерно в 10-15 раз, или до самых куски исчезают.
- Возвращение трубки до 37 ° С на водяной бане в течение 10 минут с прерывистым закрученной.
- Тщательно очистить трубу с 70% этанола и вернуть его к капоту культуры ткани. Внесите корковой ткани вверх и вниз с 5 мL пипеткой примерно в 10-15 раз, или пока куски исчезают.
- Добавьте 15 мл теплой GM и центрифуге при 200xg (1000rpm) в течение 10 минут.
- Удалите надосадочную, ресуспендируют гранулированный клеток в 20 мл свежего GM и считаться с гемоцитометра. Пластина 5-7.5x10 6 клеток в 15 мл GM на 75 см 2 колбы.
- После одного дня и каждые 2-3 последующих дней в культуре, вытеснить свободные клетки, нокаутировав колбу с вашей руки. Удалить среду вместе со всеми выбили клетки и замените 15 мл свежего GM.
- Глия можно собирать через 1-2 недели роста в пороховницах, когда они собираются 70-100% вырожденная. Для подготовки отдельных покровные покрытые глии, место 6 азотной кислотой чистить и стерилизовать 25 мм круглые покровные в 10 см блюдо, и место 3 точками 3:01 смесь парафина / вазелин на каждый покровное в треугольная картина с маленькой кистью . Лечить открытых блюда с ультрафиолетовым светом в течение 30 минут. Пальто покровные с 0,1 мг / мл Poly-D-лизина (30kDa) в боратном буфере в течение одного часа, затем промыть широко (3-5x) стерильной культуре ткани класса деионизированной водой и дайте высохнуть.
- Удалить глиальных содержащих колбу из инкубатора, отбросить средних и промыть 5 мл подогретого трипсин / ЭДТА раствором. Удалить трипсин / ЭДТА раствор из колбы и пипетки 3 мл свежего подогретого трипсин / ЭДТА в колбу. Инкубируйте колбы в течение 1 минуты при температуре 37 ° C перед добавлением 5 мл GM прекратить трипсинизации.
- Удалить глии из колбы повторными пипетирования 10-15 раз, а затем передать средствам массовой информации 15 мл коническую трубку. Центрифуга на 200xg (1000rpm) в течение 8 минут. Удалить супернатант и добавить 10 мл GM, граф клеток, и пластина 5х10 5 клеток в 12,5 мл GM на 10 см блюдо с покровные.
- Биржа среде с свежим подогретого GM каждые 2-3 дня. За день до вскрытия нейрона, удалять GM и заменить SFM (раздел 2.2). Используйте этот глиальных кондиционированным УЛП в шаг 4,12, когда наводнение коры или гиппокампа культур.
4. Корковых и / или гиппокампа Разбор и Электропорация
- Удалить соответствующее количество nucleofection решений (Lonza), комбинировать и нагреться до комнатной температуры перед началом вскрытия. С Nucleofection решение имеет ограниченный срок службы, в сочетании, мы только объединить необходимое количество для каждого препарата (100 мкл на трансфекции).
- Эвтаназии беременной мыши на E15.5 с CO 2 (день вилка E0.5) и удалить матку к чашке Петри 10см. Удалить плодов и обезглавить в холодную DM (раздел 2.1).
- Удалите весь мозг в отдельное блюдо холодным DM и изогнутых иглы вольфрама, удалить оба neocortices. Удалить мозговых оболочек с microforceps и место коры в новые блюда из холодного DM. С маленькие ножницы радужной оболочки или Векер, удалить коры или гиппокампа и место в 1,5 мл Eppendorf трубки, заполненной 1,0 мл холодной DM. Держите эту трубку на льду.
- После вскрытия всех коре или гиппокампе, добавьте 110 мкл 2,5% трипсина в пробирку Эппендорфа содержащие ткани и поместить трубку в 37 ° C инкубаторе в течение 20 минут.
- Удалить супернатант и мыть коры или гиппокампе 1,0 мл вечера (раздел 2.2), осторожно обращения трубки Эппендорф. Повторите мыть два раза, в результате чего 1 мл ТЧ в трубке.
- Измельченного в порошок куски в 15 раз с P1000 пипетки, и удалить супернатант / клеткам новых 15 мл коническую трубку с 4 мл PM, оставляя куски, которые остаются в трубке Эппендорф.
- Спиновые 15 мл трубки на 20xg (350rpm) в течение 7 минут вынул. Удалите супернатант и добавить 100 мкл предварительно смешанные, комнатная температура nucleofection решение (Lonza) для каждого трансфекции. Измельченного в порошок 5 раз с нежным вверх и вниз, движение P1000 пипетки.
- Удалить 100 мкл nucleofection решения / Смесь клеток к каждой новой трубки Эппендорфа и добавить соответствующее количество ДНК. Для длительного культур мы обычно используем 1-2μg ДНК на трансфекции. Однако, это только этикетки небольшие <10% доли нейронов в культуре. Мы обычно используем 5-10 мкг ДНК на трансфекции, если хотите, выше эффективность трансфекции для краткосрочного культуры. Мы израсходовали в общей сложности 40μg ДНК при трансфекции с двумя разными плазмид. Плазмиды хранятся в буфере TE на 1 мкг / мкл.
- Добавить суспензии клеток / ДНК в кювете (Lonza) и electroporate клеток в Nucleofector (Lonza), используя программу O-005 (Мышь ЦНС нейронов).
- Рабочие быстро, добавьте 500 мкл предварительно нагревается и уравновешенной вечера до кювет и удалить решения / клеткам новые трубки 1,5 мл Eppendorf. Добавьте достаточно PM довести объем каждой трансфекции до 1,0 мл. Граф клеток с гемоцитометра и пластины на 3-5x10 3 клеток / см 2 для молодых культур, или 5-10х10 3 клеток / см 2 для долгосрочных культурах.
- Для краткосрочных культур, наводнение 35 блюд культуры с 2,0 мл подогретой, CO 2-уравновешенной УЛ после часа обшивки. При использовании покровных, мы удаляем половину вечера и заменить его на SFM, а затем повторите еще два раза. Либо наводнения изображения камер или стиральных покровные приводит к очень низким содержанием сыворотки (<0,5%). Краткосрочные культуры не должны быть культивировали с глиальных слой фидера и не нужно быть повторно кормили.
- Для долгосрочных культурах, мы удаляем глии покрыта покровным содержащие три точки парафина / вазелин и инвертировать его на 15 мм отверстие в 35 мм блюдо, через час после начальной металлизации. Два миллилитров условного SFM из глиальных блюдо добавляется к изображений камеры. Кормить долгосрочных культурах, мы убираем одну треть УЛ каждые 2-3 дня, и заменить его свежим, предварительно нагревается и CO 2-уравновешенной УЛ.
5. Представитель Результаты:
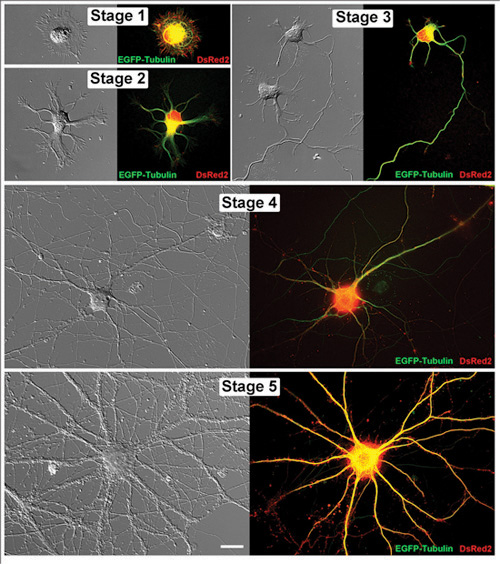
Рисунок 1. Жизнь нейронов гиппокампа в последовательных стадиях развития. Парные образы представителей живой нейронов гиппокампа показаны как и контрастность изображения дифференциальных помех и соответствующие флуоресцентные микрофотографии. Каждая из этих клеток были трансфицированных EGFP-тубулина и DsRed2 в pCAX векторов. Нейронов были обследованы в последующие дни в пробирке (DIV): Этап 1 (1DIV), Stage 2 (1DIV), Stage 3 (2DIV), этап 4 (11DIV) и Этап 5 (32DIV). Шкала бар 20 мкм.
Обсуждение
Этот протокол для культивирования эмбриональных гиппокампа и коры нейроны мыши был разработан как модификация Banker протокол, который использует 1,2 крысы нейроны. Мы использовали этот протокол для мыши культивирования и хомяк нейронах, а 3,4,5,6,7. Этот протокол работает одинаково хорошо как для гиппокампа и неокортекса нейронов и похож на протокол опубликован Meberg и Миллер 8. Как правило, мы используем нейронов гиппокампа для долгосрочного культуры, потому что они хорошо описаны и более устоявшиеся модели системы. Кроме того, они, вероятно, содержат более однородным населением нейронов, чем неокортекса. Тем не менее, нейроны неокортекса культурный используя этот протокол также выжить и дифференцировать аналогично (неопубликованные данные). Мы регулярно использовать гиппокампа и неокортекса нейронов за короткий срок культуры. Препарирование коры головного мозга также приводит к существенно более нейронов (нейронов 1.5x10 6 на каждую пару коры), чем гиппокампа рассечение (2.5x10 5 нейронов в гиппокампе пара), что делает его лучшим выбором материала для западных промокательной, например.
Как и с любой первичной культуре, важно, чтобы свести к минимуму время, которое требуется от смерти животного покрытие клеток. Это обычно занимает 10-20 вскрытия стать последовательно быстро на вскрытие и обшивки. Кроме того, при работе с Lonza Nucleofector, очень важно работать быстро при электропорации процедуры, как жизнеспособность нейронов быстро уменьшается, если они остаются в nucleofection буфера.
Большая часть наших изображений ведется с микроскопии полного внутреннего отражения флуоресценции (TIRFM). Этот тип микроскопа способна только изображения нескольких сотен нанометров за пределы покровного стекла. Таким образом, области нейроны, которые мы часто изображения, аксонального конуса роста и дендритных шипиков, должны быть соблюдены прямо на покровное. Таким образом, мы используем низкой плотности культур, которые требуют глиальных питания для долгосрочных культуры. Мы использовали выше плотность культур (> 2х10 4 клеток / см 2), без глиальных слоев подачи, для долгосрочных культур и обнаружил, что они выживают очень хорошо с маленькой грудью. Тем не менее, дендритных шипиков этих нейронов являются зачастую слишком далеко от подложки к изображению в TIRFM, хотя они могут быть легко обнаружены с широким полем зрения микроскопа или конфокальной микроскопии.
В большинстве наших исследований мы трансфекции нейронов до обшивки, и отображаемого флуоресцентно-меченых белков на срок до трех месяцев в культуре. Этот долгосрочный выражение флуоресцентно-меченых белков дает нам уверенность, что при использовании низких концентраций ДНК (1-2μg), мы не производим гиперэкспрессия артефакты в нейронах. Однако, эта процедура также может быть использован для изучения экспрессии белков, если большое количество ДНК используются (10-20 мкг). Плазмиды, которые мы используем для трансфекции нейроны обычно содержат белки EGFP или mCherry фьюжн, хотя мы также этикетки с цитоплазме нейронов DsRed2 или EGFP в одиночку. Это электропорации техника хорошо работает с рядом векторов. Мы предпочитаем плазмиды, которые содержат β-актин промотора CMV усилитель и β-глобина поли-хвост (или pCAGGs pCAX плазмид) 9, в связи с относительно высоким уровнем экспрессии, а также тот факт, что они хорошо переносятся нейронов как в кратко-и долгосрочных культуры. Как правило, белки начинают выражать в течение примерно 4 часов покрытия и достичь уровня достаточного для работы с изображениями в 10-24 часа 10. Мы успешно использовали CMV-промотор-приводом плазмид в короткий срок культур, но обнаружили, что они могут привести к высокому уровню гиперэкспрессия, которые убивают нейроны в долгосрочной культуры. Тем не менее, мы обнаружили, что глиальные кондиционирования низкой плотности культур помогает выживанию нейронов трансфицированных CMV-промотора приводом плазмиды, по сравнению с более высокой плотностью (не глиальных кормили) культур.
Раскрытие информации
Благодарности
Все процедуры были одобрены Университета Висконсина комитета по уходу за животными и были в соответствии с руководящими принципами NIH. Мы благодарим доктора Кэтрин Калил за щедрое использование ее Nucleofector устройства. Мы также благодарим членов Дент лабораторию для комментариев по протоколу. Эта работа была поддержана грантами NIH R01-NS064014, Дана фонд и Фонд Уайтхолл EWD
Кристофер Viesselmann, Джейсон Ballweg и Дерек Lumbard способствовали в равной степени к этой статье.
Материалы
* Большинство реагенты, которые мы храним при температуре -80 ° С можно хранить при температуре от -20 ° C, а также. При хранении при температуре -80 ° C удлиняет их срок хранения и дает несколько более последовательным культур.
Ссылки
- Goslin, K., Asmussen, H., Banker, G., Goslin, K., Banker, G. Chapter 13. Culturing Nerve Cells. , 339-370 (1998).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat Protoc. 1, 2406-2415 (2006).
- Dent, E. W., Callaway, J. L., Szebenyi, G., Baas, P. W., Kalil, K. Reorganization and movement of microtubules in axonal growth cones and developing interstitial branches. J Neurosci. 19, 8894-8908 (1999).
- Dent, E. W., Kalil, K. Dynamic imaging of neuronal cytoskeleton. Methods Enzymol. 361, 390-407 (2003).
- Dent, E. W. Filopodia are required for cortical neurite initiation. Nat Cell Biol. 9, 1347-1359 (2007).
- Hu, X., Viesselmann, C., Nam, S., Merriam, E., Dent, E. W. Activity-dependent dynamic microtubule invasion of dendritic spines. J Neurosci. 28, 13094-13105 (2008).
- Lebrand, C. Critical role of Ena/VASP proteins for filopodia formation in neurons and in function downstream of netrin-1. Neuron. 42, 37-49 (2004).
- Meberg, P. J., Miller, M. W., Hollenbeck, P. J., Bamburg, J. R. Chapter 7. Neurons: Methods and Applications for the Cell Biologist. , 112-129 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Zeitelhofer, M. High-efficiency transfection of mammalian neurons via nucleofection. Nat Protoc. 2, 1692-1704 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены