Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Микродиссекции Черная вдова из паутины производству вводы
В этой статье
Резюме
Здесь мы опишем эффективные стратегии для удаления шелкового желез из живота женщины черные вдовы. Эта процедура позволяет быстрое изоляции семь различных шелковых желез в высокой степени очистки моды, важный процесс для следователей изучения паук производства шелка и волокон сборки.
Аннотация
Modern spiders spin high-performance silk fibers with a broad range of biological functions, including locomotion, prey capture and protection of developing offspring 1,2. Spiders accomplish these tasks by spinning several distinct fiber types that have diverse mechanical properties. Such specialization of fiber types has occurred through the evolution of different silk-producing glands, which function as small biofactories. These biofactories manufacture and store large quantities of silk proteins for fiber production. Through a complex series of biochemical events, these silk proteins are converted from a liquid into a solid material upon extrusion.
Mechanical studies have demonstrated that spider silks are stronger than high-tensile steel 3. Analyses to understand the relationship between the structure and function of spider silk threads have revealed that spider silk consists largely of proteins, or fibroins, that have block repeats within their protein sequences 4. Common molecular signatures that contribute to the incredible tensile strength and extensibility of spider silks are being unraveled through the analyses of translated silk cDNAs. Given the extraordinary material properties of spider silks, research labs across the globe are racing to understand and mimic the spinning process to produce synthetic silk fibers for commercial, military and industrial applications. One of the main challenges to spinning artificial spider silk in the research lab involves a complete understanding of the biochemical processes that occur during extrusion of the fibers from the silk-producing glands.
Here we present a method for the isolation of the seven different silk-producing glands from the cobweaving black widow spider, which includes the major and minor ampullate glands [manufactures dragline and scaffolding silk] 5,6, tubuliform [synthesizes egg case silk] 7,8, flagelliform [unknown function in cob-weavers], aggregate [makes glue silk], aciniform [synthesizes prey wrapping and egg case threads] 9 and pyriform [produces attachment disc silk] 10. This approach is based upon anesthetizing the spider with carbon dioxide gas, subsequent separation of the cephalothorax from the abdomen, and microdissection of the abdomen to obtain the silk-producing glands. Following the separation of the different silk-producing glands, these tissues can be used to retrieve different macromolecules for distinct biochemical analyses, including quantitative real-time PCR, northern- and western blotting, mass spectrometry (MS or MS/MS) analyses to identify new silk protein sequences, search for proteins that participate in the silk assembly pathway, or use the intact tissue for cell culture or histological experiments.
протокол
1. Обезболивающий паука и изоляции брюшной полости
- Передача паука из стеклянной банке в картонной коробке с пластиковой подкладке (рис. 1А). Как правило, мы собираем пауков от woodpiles, гаражи или кустарников и их размещение в лаборатории в стеклянных банках. Потому что робот не может подняться вверх пластиковые подкладки, он обеспечивает эффективный способ передачи паука из стеклянную банку или кофе можно в меньший флакон для обезболивающих целях. При обработке паук в этой точке, вы должны носить две пары латексных перчаток или в саду перчатки для целей безопасности.
- В то время как паук в поле выстроились с пластиковыми, подход паука из его задней стенке и пусть паук слайд в пластиковый флакон культуры. После паук входит флакон, сразу же месте плагин поверх (рис. 1В). Мы рекомендуем использовать флакон, что составляет примерно 101,6 мм х 31,75 мм (Д х Г). Это сводит к минимуму количество углекислого газа, необходимого для обезболивающим шаг.
- Обезболить паук путем введения углекислого газа на 5-10 фунтов на квадратный дюйм в течение 10 мин (рис. 1в). Этот объем газа будет только стук паука из примерно 5 минут, так что после обезболивания вы должны немедленно приступить к шагам 1,4-1,5.
- Место под наркозом паука в небольшое блюдо рассечение и использовать щипцы для позиционирования паук спинной стороной вверх (красный песочные часы вниз).
- Клип ножка (узкая ножка соединения головогруди и живота), чтобы освободить живот от остальной части паука (рис. 1D). Магазин головогруди в морозилку на ночь в чашке Петри и отказаться после того, замороженные на следующий день. Будьте осторожны при переходе головогруди, как клыки паук присутствуют в этом сегменте.
- Закрепите живота, чтобы Sylgard материала в небольшое блюдо вскрытия с помощью одного контактный насекомое. Вставьте насекомых штифт через отверстие, сделанное от отсечения ножки (рис. 1E). Это может быть легко определены как места, где жидкость выходит из отсечение ножки. Убедитесь в том, фильеры (противоположный конец ножки) ориентирован на нижний (ближайшее к вам).
2. Удаление экзоскелет
- Сделайте первый разрез через экзоскелет с помощью пары microscissors, начиная с отверстием от ножки отсечения. Вырезать сбоку до спинной стороны достигается с обеих сторон (рис. 1F). Используя пару щипцов, отогните переднего сегмента экзоскелет и вставьте второй штифт в этом месте. После вставки второй вывод, поверните рассекает лоток каудально (90 градусов) с первоначального боковых порезов и продолжать резки до фильеры достигается (рис. 1G). Этот разрез будет перпендикулярно или вертикального на начальном боковой разрез. Ничего не вырезано через фильеры, когда вертикальный разрез производится (задняя относительно песочных часов и имеет круговой внешний вид). Невыполнение вставить второй контактный приведет к животу вращаться после вертикального разреза выполняются.
- Погрузитесь в животе рассекает буферного раствора (0,1 М хлорида натрия, 0,015 М цитрата натрия, 0,1% диэтиловый Pyrocarbonate).
- Пил оставшиеся экзоскелет назад, начиная с начального, боковой разрез. Когда это будет завершено, жировой ткани должен быть отчетливо виден (рис. 1 полугодие).
3. Выделение шелковой желез
- Использование щипцов начинают дразнить от жировой слой (рис. 1 полугодие). Жир будет беловато-желтоватый вид. Продолжайте, пока большая часть жира удаляется и шелка желез отчетливо видны. Tubuliform железы состоит из трех пар очень длинные, цилиндрические трубы, которые имеются в изобилии в брюшной полости. Основные ampullate, который находится в паре, это большая, в форме полумесяца ампула с длинной запутанной дистальных хвост и проксимальных протоков, что уменьшение ширины по мере приближения фильеры паука. Незначительных ampullate очень похож по морфологии основных ampullate, но она значительно меньше. Железы жгутовидные, происходит и в парах, круглая и multilobular с небольшой цилиндрический зигзагообразный канал, который простирается вниз к фильер. Совокупный железы (находится в пар) очень большой, multilobular железы, которая имеет очень большой выводной проток которая имеет большие, неправильной формы доли на нем. Гроздевидный железах происходят в больших количествах и напоминают короткие, небольшие прогнозы пальцевидные. Грушевидные железы является самой маленькой железе в брюшной полости и имеет много уплотняется, цилиндрические каналы, которые похожи на вентилятор с большим количеством маленьких выводные протоки, которые простираются до фильер.
- Мы рекомендуем удалить желез в следующем порядке: tubuliform, основные ampullate, жгутовидные, незначительные ampullate, агрегат, гроздевидный, а затем грушевидные (рис. 2А-B).
- Начиная с tubuliform, дразнить этих желез от остального йэлектронной желез - они должны сидеть на вершине другом железе (рис. 2А). Есть три пары tubuliform желез в одной паука. Позвольте им свободно плавать, но остаются привязаны к своим фильер их протоков.
- Далее, дразнить от основных желез ampullate. Есть два главных желез ampullate настоящее время в одном паука. Во время процедуры удаления, убедитесь, что каналы остаются прикрепленными к желез (рис. 2А).
- Продолжите дразнить остальных желез друг от друга, работая тщательно, чтобы избежать проколов любой из желез, особенно в совокупности и жгутовидные желез. Каждая железа должно быть свободное плавание все пути к своей точке выхода в экзоскелет для фильер. Эти железы находятся также в парах. Удалить каждой железы, зажимая протока щипцами и осторожно потянув, пока он отрывается от точки выхода. Основные ampullate, жгутовидные, незначительные ampullate, а совокупный железы встречаются в парах. Гроздевидный и грушевидные железы происходят во многих других пар.
- Удалить каждой железы, зажимая протока щипцами и осторожно потянув, пока он отрывается от точки выхода вниз фильеры. Мы обычно хранят желез мокрой, однако мы не добавляем дополнительные буфера.
- Как железы удаляются, поместите их в стерильные предварительно помечены пробирки на 1,5 мл микроцентрифужных. Индивидуальные железы показано на рисунке 3А-G. Держите эти железы на льду, а затем вспышкой заморозить их в жидком азоте. После вспышки замораживание в жидком азоте, поместите их при температуре -80 ° C для хранения.
4. Представитель Результаты
При извлечении различных желез, крайне осторожно следует принимать при обращении жгутовидные и совокупного железы, так как эти две структуры могут быть легко проколот и поврежденных с щипцами. Кроме того, стоит отметить, что морфологически жгутовидные и совокупного железы очень похожи до их удаления, и они часто переплетаются друг с другом. Чтобы предотвратить перекрестное загрязнение этих тканей после удаления, прозектором должны тщательно дразнить этих структур друг от друга. Кроме того, по начальной экспозиции шелкового производства желез, гроздевидный и грушевидные железы будет наиболее трудно сразу визуализировать из-за их меньшего размера и анатомического расположения. Нередко бывает, что наличие многих яйца. Более того, в дополнительном уходе должно быть принято при удалении железы грушевидные, как эта ткань очень липкое и часто придерживаются ваших щипцов. Когда эта процедура все сделано правильно, то можно получить все семь шелковых желез от одного паука в высокой степени очистки образом. Как правило, можно восстановить мкг количества суммарной РНК и белка из одного вскрытия паука. Пример использования общей РНК для КПЦР изучить уровни мРНК tubuliform ограничено фиброина гена, TuSp1, показано (рис. 4). Представитель эксперименты, которые связаны с белком лизатов собраны из желез, например, в растворе триптического пищеварения следуют МС анализа (может также использоваться для MS / MS анализа) или аминокислоты анализ состава кислоты показано (рис. 5-6, соответственно).


Рисунок 1. Обработка, обезболивающее, и удаление экзоскелет из живота женщины черный паук вдовы. ) Передача паука в картонной коробке с пластиковой выстроились для облегчения перемещения паука в меньший пластиковый флакон. Б) Паук помещаются в пластиковый флакон с пробкой. С) Обезболивающий паука с углекислым газом. D) разделение головогруди из брюшной полости использованием microscissors. Е) иммобилизация брюшной полости в анатомическом театре лоток, используя насекомых булавками. F) Просмотреть после боковой надрез делается с ножницами и часть экзоскелета является очищенные обратно щипцами. G) Разрезы делаются перпендикулярно к исходной боковой разрез. H) Удаление экзоскелет и экспозиции жировом слое.

Рисунок 2. Визуализация семи различных шелковых желез в нетронутом в брюшко паука, а также окружающих тканей. ) Изображения tubuliform, основные ampullate, жгутовидные, агрегат, незначительные тканей ampullate на 12-кратное увеличение. Б) Изображение гроздевидный и грушевидные железы у 12-кратное увеличение.


Рисунок 3. Фотографии из семи шелковых желез после их удаления из брюшной полости. Все изображения были взяты в плен в 20-кратным увеличением, за исключением гроздевидный и грушевидные железы, которые были сделаны в 40х. ) Основныеampullate железы; б) мажорные и минорные ampullate (правая сторона) для сравнения размеров, C) tubuliform; D) жгутовидные; E) агрегат, F) гроздевидный G) грушевидные.

Рисунок 4. Представителю результаты волеизъявления структуре шелк гена, TuSp1, после съемки TuSp1 уровней мРНК в различных шелковых желез (без учета железы грушевидные) с помощью количественной ПЦР в реальном времени (КПЦР) После выделения общей РНК из желез.
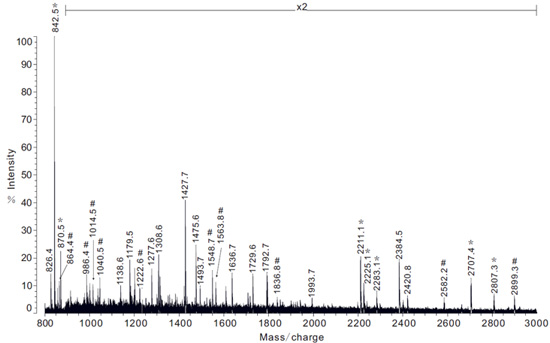
Рисунок 5. Пример МС-анализа белка экстракты, полученные из железы грушевидные следующие в растворе триптического пищеварения. Примечание: x2 представляет 2-кратным увеличением спектра интенсивности. Спектр масс ионов пептида, которые соответствуют регионов фиброина PySp1 показаны с символа #.

Рисунок 6. Типичный результат аминокислоты профиля состав кислот белки, извлеченные из железа tubuliform. Примечание: ASX = Asp и Asn; GLX = Glu и Gln. Синяя окраска отражает аминокислоты с полярными группами боковой цепи в то время как красный цвет представляет аминокислотных остатков с неполярными группами боковой цепи.
Обсуждение
Наша методология микродиссекции шелковой желез от черного паука вдовы предлагает эффективные средства для получения высокой степени очистки шелка производству желез. Вскрытия может быть завершена в 1,5 до 3 часов, что дает полный набор семь различных шелковых желез из cobweavers. Получение ...
Раскрытие информации
Благодарности
Эта работа была поддержана NSF RUI Грант MCB-0950372 озаглавленном молекулярная характеристика черного шелка паука вдовы.
Материалы
| Name | Company | Catalog Number | Comments |
| Sodium chloride | Electron Microscopy Sciences | SX0420-1 | 0.1 M in water |
| Diethyl pyrocarbonate | Sigma-Aldrich | D-5758 - 5 ml | 0.1% v/v |
| Sodium citrate | Sigma-Aldrich | S1804 - 1 kg | 0.015 M in water |
| Dissecting microscope | Leica Microsystems | Leica MZ16 | |
| Digital microscope camera | Leica Microsystems | DFC320 | Software - Leica Application Suite v2.8.1 |
| Vannas scissors | World Precision Instruments, Inc. | 500260 | |
| Stainless steel forceps | World Precision Instruments, Inc. | 501764 | Mini Dumont #M5S |
| Insect pins | Indigo Instruments | 33414-2 | Insect pins #2 |
| Small or large dissection dishes | Living Systems Instrumentation | DD-50-S or DD-90-S | 52 mm diameter x 18 mm H (Sylgard Depth ~6mm) or 93 mm x 22 mm |
| Drosophila culture vials | Carolina Biological | FR-17-3076 | Size is 31.75 mm diameter x 101.6 mm |
Ссылки
- Vollrath, F., Knight, D. P. . Int. J. Biol. Macromol. 24, 243-243 (1999).
- Gosline, J. M., Guerette, P. A., Ortlepp, C. S. . J. Exp. Biol. 202, 3295-3295 (1999).
- Gosline, J. M., DeMont, M. E., Denny, M. W. . Endeavour. 10, 31-31 (1986).
- Hinman, M. B., Jones, J. A., Lewis, R. V. . Trends Biotechnol. 18 (9), 374-374 (2000).
- Lewis, R. V., Xu, M. . Proc. Natl. Acad. Sci. 87, 7120-7120 (1990).
- Colgin, M. A., Lewis, R. V. . Protein Sci. 7 (3), 667-667 (1998).
- Tian, M., Lewis, R. V. . Appl. Phys. A-Mater. 82, 265-265 (2006).
- Hu, X., Lawrence, B., Kohler, K. . Biochemistry. 44 (30), 10020-10020 (2005).
- Vasanthavada, K., Hu, X., Falick, A. M. . J Biol Chem. 282 (48), 35088-35088 (2007).
- Hayashi, C. Y., Blackledge, T. A., Lewis, R. V. . Mol. Biol. Evol.. 21 (10), 1950-1950 (2004).
- Blasingame, E., Tuton-Blasingame, T., Larkin, L. . J Biol Chem. 284 (42), 29097-29097 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены