Method Article
Оптических изображений нейронов в Крабовидной стоматогастральных ганглия с напряжением чувствительных красителей
В этой статье
Резюме
Здесь мы представляем методологии для быстрого и высокого разрешения флуоресцентные напряжения чувствительного красителя изображения детальных активность нейронов в ганглии стоматогастральных краба.
Аннотация
Напряжение чувствительных красителей изображений нейронов является ключевой методологией для понимания того, как нейронные сети организованы и как одновременная активность участия нейронов приводит к появлению интегральных функциональность сети. Здесь мы представляем методологии применения этого метода выявленных шаблон генерации нейронов краба стоматогастральных ганглия. Мы продемонстрируем загрузку этих нейронов с люминесцентными напряжения чувствительной краситель Ди-8-ANEPPQ и мы покажем, как образ деятельности красителя загружены нейронов использованием MiCAM02 высокая скорость и высокое разрешение ПЗС-камера системы. Мы демонстрируем анализа записанных данных изображений с помощью программного обеспечения BVAna изображений связанных с MiCAM02 визуализации системы. Одновременное напряжение чувствительных красителей визуализации подробную активности нейронов в нескольких краба стоматогастральных ганглия применяться вместе с традиционными методами электрофизиологии (внутри-и внеклеточной записи) открывает радикально новые возможности для понимания того, как центральная модель генератора нейронных работы сетей.
протокол
1. Подготовка Краб стоматогастральных нервной системы
Взрослый Рак pagurus Л. были получены из местных источников (Newcastle University, Голубь морской Laboratories) и хранятся в фильтруются, газированные морской воде (10 - 12 ° С). Животные были под наркозом, упаковывая их в лед на 20 - 40 минут до вскрытия. Мы использовали изолированных стоматогастральных нервной системы (ст.) 1. Ст. была прижата в силиконового эластомера облицовка (ЭЛАСТОСИЛ РТ-601, Wacker, Мюнхен, Германия) чашку Петри и непрерывно superfused (7 - 12 мл / мин) с охлажденным раствором (10-13 ° С). Физиологический раствор состоял из (ммоль * л-1): NaCl, 440, 2 MgCl, 26, 2 CaCl, 13; KCl, 11; trisma базы, 10; малеиновой кислоты, 5. Соленая выдерживали при постоянной температуре 11 - 13 ° С и рН 7,4 - 7,6.
Подробные инструкции о вскрытии ст. и подготовки, в том числе из desheathing stomatoastric ганглии (STG), представлены в статье Юпитер Guttierez и Grashow 1. Все эксперименты были проведены в соответствии с Европейскими сообществами Директива Совета от 24 ноября 1986 года (86/609/EEC). Рисунок 1А показывает схему и рисунок ст. 1В показан типичный desheathed STG, имеющих свои нейроны организованы в виде плоского полукругом в задней части ганглия.
Чашка Петри с ст. крепится к операционной платформы визуализации микроскопа (BW51 WI; Olympus, Токио, Япония) с моделированием глины. Оба, столик микроскопа и микроскопа устанавливаются на изолированных вибрации стол (Scientifica, Акфилд, Великобритания), чтобы предотвратить движение артефакты во время оптической записи. Двигателя модели генерируется в стомато ганглии (STG) являются контролировать с помощью внеклеточных записи 2-4. Это делается с помощью следующих шагов:
- Вазелин основе цилиндрических купе построено на раздел основного двигательного нерва (ЛВН) для электрической изоляции нерва из ванны (это делается на этапе до вскрытия чашку Петри помещают на операционной платформе визуализации микроскопа ).
- Один из двух проволоки из нержавеющей стали электрод помещается в этом отделении, другой в ванне, как электрод сравнения.
- Дифференциальный сигнал записывается, фильтруется и усиливается усилителем переменного тока дифференциальным (Университет Кайзерслаутерн, Германия).
- Двигательной активности ганглия контролируется с помощью осциллографа (DL708E, Yokogawa, Токио, Япония) и дополнительно записанных с помощью платы сбора данных (КНИ Power, 1401, Кембридж конструирования электронных, Кембридж, Великобритания) и Спайк 2 v6.10 Программное обеспечение (Кембридж конструирования электронных, Кембридж, Великобритания). Файлы анализируются с помощью Спайк 2 v6.10 (Кембридж конструирования электронных, Кембридж, Великобритания).
2. Подготовка раствора красителя
Мы использовали флуоресцентный напряжения чувствительного красителя Ди-8-ANEPPQ (Cambridge Bioscience) 5, которая имеет двойной положительный заряд, что облегчает загрузку краску через микроэлектродов, используя положительные импульсы тока. Раствор красителя должны быть защищены от света как можно больше. Раствор красителя готовят следующим образом:
- 5 мг красителя смешивают с 1 мл F-127 Pluronic кислоты в ДМСО (Invitrogen) решение.
- Пластиковый флакон, содержащий растворенный краситель центрифугировали в течение 20 минут при 12000 вращения / мин в Микроцентрифуга Sigma 1-14 (Sigma, Остероде, Германия) для отделения больших частиц красителя, которые могут засорить микроэлектрода.
- Супернатант (топ-200 мкл) раствора красителя отделяется с помощью пипетки и хранится в отдельном флаконе пластика. Оба флакона завернуты в алюминиевую фольгу, чтобы предотвратить воздействие света.
- Раствор красителя замораживали при -20 ° C.
- Перед использованием раствор красителя плавится путем размещения закрыты и завернуты флакон в теплой (25 ° C) воду на 10-15 минут.
3. Dye Загрузка внутриклеточной инъекции использованием Sharp микроэлектродов
Мы использовали резкие микроэлектродов для загрузки нейронов с красителем. Чтобы проверить, краситель загрузки мы используем системы MiCAM02 томография (SciMedia, Токио, Япония) 6. Визуализации система имеет две ПЗС-камеры: камера HR имеет больший сенсорный чип (6,4 мм х 4,8 мм) обеспечение лучшего пространственного разрешения с лучшим временным разрешением быть 1,4 мс, камера HS имеет меньший (2,9 мм х 2,1 мм), но быстрее датчик чипа, позволяя быстрее изображений, имеющих 0,7 мс его лучшим временным разрешением. Шаги красителя загрузки являются следующие:
- Микроэлектродов тянутся с Р-97 Flaming - Браун (Саттер Instruments, Новато, Калифорния, США) электрод съемник с помощью 10 см длиной, 1 мм, внешний диаметр стеклянных трубок с нитью (GB100TF 8P, науки Продукты, Хофхайм, Германия). Электроды вытащил иметь сопротивление вдиапазоне 25 - 40 МОм 3M KCl (за соответствующий потянув настройки параметров следуют пипетки поваренная книга предоставляемые производителем электродов съемник).
- Замороженный раствор красителя и расплавленных очень небольшое количество его всасывается в иглу microfil (MicroFil - 34 г, инструменты Всемирного Precision, Сарасоте, штат Флорида, США) - высосан краситель заполняет около 2 / 3 от microfil иглы .
- Раствор красителя в иглу microfil вводят кончик микроэлектрода. Микроэлектрода помещается в темный ящик на 15 минут.
- Микроэлектрода является отсыпаться решение 3M KCl. Электрод помещается обратно в темный ящик для хранения электрода еще 10-20 минут, чтобы раствор красителя для достижения штраф кончик электрода всасывания капиллярные силы, действующей в микроэлектрода.
- Готовы микроэлектрода помещается в держатель электрода и крепится headstage внутриклеточного усилитель (IA-251A, Warner Instruments Corporation, Hamden, Коннектикут, США).
- Внутриклеточных усилитель подключен к плате сбора данных, который обеспечивает импульсный сигнал для управления импульсы тока в микроэлектрода.
- Микроэлектрода помещается мягко в мембране нейрона STG использованием микроэлектрода манипулятора (PatchStar, Scientifica Ltd, Акфилд, Великобритания). С рабочим расстоянием 10x цели (UMPLFL10XW, Н. А. 0.30, WD 3,3 мм; Olympus Corporation, Токио, Япония) визуализации микроскопа очень мало, микроэлектрода должны быть расположены в наклонное положение (около 30 °) и движение микроэлектрода в правильном положении требует нескольких этапов повторной фокусировки объектива микроскопа и перемещение микроэлектрода. Для начала микроэлектрода перемещается в таком положении, что его кончик находится выше СТГ. Объектива микроскопа опускается до конца электрода появляется в центре внимания. Затем она опускается и дальше, но не настолько, чтобы коснуться микроэлектрода. Микроэлектрода опускается, пока он снова появляется в фокусе объектива. Эти шаги повторяются, пока нейроны появляются четко в фокальной плоскости объектива. Затем микроэлектрода опускается до касания и нежно прокалывает оболочку выбранного нейрона STG. Это контролируется с помощью осциллографа.
- Внутриклеточного электрода используется для записи активности выбранного STG нейрона с целью выявления нейрона с учетом его профиля деятельности и отношений между его деятельностью и СТГ, зарегистрированное от внеклеточных электродов 2,3,7.
- Внутриклеточных усилитель переключается в текущем режиме инъекции и используется в течение 30 минут, чтобы придать 10 нА положительный ток шаги в микроэлектрода, что в прошлом в течение 1 секунды и разделяются на 1 секунду пробелов нет вводится в микроэлектрода. Введенного тока диски положительно заряженных молекул красителя в записанных нейрона. Если оборудование доступно несколько нейронов может быть введен одновременно.
- Десять минут в инъекции период и после окончания инъекций красителя распространяться внутри нейрона проверяется. Для этого мы используем MiCAM02 визуализации системы (SciMedia Ltd, Токио, Япония) с 10-кратным объективных и освещения ультра-низкий уровень пульсаций галогенных источников света (HL-151; Moritex, Токио, Япония) через фильтр MSWG2 куб (с 480-550 нм фильтра возбуждения; Olympus Corporation, Токио, Япония). Визуализации система настроена на использование камеры HR с 192 х 128 пикселей, 40 мс изображений времени, режим "hbin», и 10 кадров в визуализации сессии. Если краска заполнения успешно изображения должны показать окрашенных патч в нейроне вокруг расположения микроэлектрода, и это окрашенные патч должен расти между снимки, сделанные после 10 минут и через 30 минут. Если распространение красителя недостаточно через 30 минут, больше времени впрыска является само собой разумеющимся. Кроме того, новый электрод красителя может быть использован.
- Электрод вытащил из нейронов и нейронов остается, чтобы расслабиться, по крайней мере 20-30 минут. За это время следующего нейрона может быть введен с красителем.
4. Визуализация окрашенные нейроны
Активность отдельных нейронов могут быть отображены после красителя процедуру заполнения. Кроме двух или больше нейронов могут быть заполнены на изображение одновременной активности нескольких нейронов STG. В принципе многие и, возможно, все STG нейроны могут быть заполнены краской. Изображений нейронов осуществляется с MICAM 02 изображений системы с помощью камеры HR. Процедура изображения выглядит следующим образом:
- Объектива микроскопа изменяется и света высокой эффективности передачи 20x цели (XLUMPLFL20XW/0.95, Н. А. 0.95, WD 2,0 мм; Olympus Corporation, Токио, Япония) используется для сбора данных изображений. Эта цель собирает гораздо больше света, что в 10 раз цель, а также дает более высоким увеличением обеспечивает более детальное изображение нейронов. Бейн г больше света эффективной означает, что небольшое количество красителя загрузки уже виден с этой целью, а также, что мы можем использовать более низкие интенсивности света для визуализации снижения потенциального ущерба фотографию, которая может быть нанесен нейроны красителем.
- Операционной стадии микроскопа расположена так, что нейроны, которые предназначены для включения в образ находятся в поле зрения объективного и цель фокусируется на них.
- Внеклеточной записи данных также подается в MICAM 02 изображений системы через аналоговый канал ввода. Это позволяет относительно легко, касающихся оптических сигналов и соответствующие модели двигателя или внеклеточно записал всплески фазы анализа.
- Система MICAM 02 настроен на использование 96 х 64 пикселей с 2,2 мс время визуализации или 48 х 32 пикселей с 1,5 мс изображений. В обоих случаях "hbin" настройка может быть использована, если окрашивание нейроны не очень сильны.
- Уровень освещенности устанавливается как можно ниже (то есть краситель в нейроны должны генерировать еще достаточно флуоресценции для визуализации), чтобы избежать фото модуляции и фото повреждения записанных нейронов.
- Освещение помещения, а все остальные источники света выключены. Кроме того, черный занавес может быть закрыто около записи установки, чтобы предотвратить воздействие света от внешних источников.
- Визуализации сессий устанавливаются в пределах от 4 - 16 секунд.
- Спонтанной активности нейронов, окрашенных регистрируется на протяжении нескольких сессий визуализации.
5. Анализ оптических данных изображений
Для анализа изображений данных мы использовали программное обеспечение BVAna (версия 10,08; SciMedia Ltd, Токио, Япония), связанные с MICAM 02 системы визуализации. Программа поддерживает визуализацию образа данных и предоставляет ряд инструментов анализа, а также. Шагов анализа и интерпретации данных являются следующие:
- Соответствующие круговые области интереса выбирается на каждого записанного нейронов. Обычно мы используем 2 - 3 пикселя радиуса регионах, представляющих интерес для исследования нейронов на 48 х 32 пикселей, и 6 - 8 пиксельных радиус регионах, представляющих интерес для исследования нейронов в 96 х 64 разрешения.
- Временное сглаживание данных может быть необходимо, особенно если краска создает относительно небольшое количество флуоресценции (низкое значение фона в данных указывает на это, оно может быть связано с низким уровнем света, который используется или низкой загрузке красителя уровне, например, В аксонов из записанных нейрон). Обычно в таких случаях мы использовали временное сглаживание с 3 - 5 единиц времени.
- В дополнение к оптической записи мы также отображать внеклеточной записи, выбрав для отображения аналоговых ввода изображений системы.
- Параметры визуализации оптических данных и аналоговый вход должен быть установлен надлежащим, чтобы видеть все записи на экране компьютера.
- Учитывая, оптические записи нейронов, внеклеточной записи с ЛВН и классификация нейронов на основе ранее внутриклеточной регистрации, можно определить личность нейрона и связать свою деятельность с деятельностью нейронных записанные с нерва.
- Ожидается, что оптические записи ясно показывают, и без необходимости усреднения по несколько подобных мероприятий, нейронная деятельность соответствующих внеклеточно записал шипы, а также подпороговых событий, таких как тормозные постсинаптические потенциалы вызваны деятельностью других нейронов.
- Экспорт данных в функции программного обеспечения BVAna может быть использована для экспорта оптического записи рассчитанных для отдельных регионах интерес, а также аналоговый вход, который содержит записи с ЛВН. Экспортировать данные могут быть обработаны и проанализированы дальнейшего использования других видов анализа данных, программного обеспечения, а также (например, в простейшем случае Microsoft Excel (Microsoft, Редмонд, штат Вашингтон, США), могут быть использованы для дополнительного визуализации и обработки данных).
6. Представитель Результаты
На рисунке 2 показан одновременной записи двух нейронов (LP, боковые пилорического нейрона; П.Д., пилорический расширитель нейрона) в пилорического центральный генератор структуры краба STG вместе с записи с ЛВН. Оптические записи LP и ПД нейронов, выявленных на основе их внутриклеточной записи показывают, что на самом деле это хорошо сочетаются с внеклеточной записи соответствующих ЛП и ДП нейронов. Существует соответствует 12 мс задержки между оптическим и ЛВН записи пиков шип (см. вставку на рис 2) из-за задержки передачи аксонального между ганглия и внеклеточной сайтов записи. Представленные данные также показывают, что нейронная активность в соме, который соответствует шипы записанных нейронов явно обнаруживается.
s/ftp_upload/2567/2567fig1.jpg "ALT =" Рисунок 1 "/>
Рисунок 1.) Принципиальная схема стоматогастральных нервной системы (ст.). НГК, спаечный ганглия; О.Г., пищевода ганглия; STG, стомато ганглия; STN, стомато нерва; ЛВН, боковые нерва левого желудочка. Б) краба стоматогастральных ганглии (STG) - изображение показывает полукруглая задняя расположение STG нейронов.
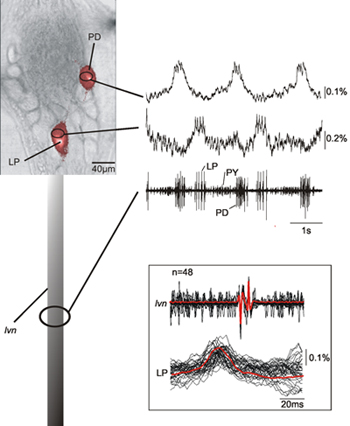
Рисунок 2. Одновременная запись одного размаха ДП и ЛП нейрона вместе с записью ЛВН. Данные показывают, что оптические и нервных записи матч очень хорошо, и что мы можем идентифицировать нейронные деятельности соответствующих шипы записанных форме нерва. Вставке показана наложения нескольких взмахов потенциалов LP действия - оптически и электрически записанные - и их средний демонстрируя матч между оптически и электрически записанные деятельности. В связи с тем, что наш оптический метод записи не отфильтровать низкочастотных компонентов данных, мы также можем записать медленные мембранный потенциал изменений, характерных для ДП и ЛП нейронов 14.
Обсуждение
Напряжения чувствительной краситель изображения 8,9 из STG нейронов в сочетании с традиционными методами электрофизиологии (внутри-и внеклеточной записи электрода) позволяет более глубокое понимание того, как этот маленький, известный и до сих пор сложные нейронные работы системы. СТГ является прототипом центрального шаблон генератора (CPG) нейронных сетей (в нее входят и желудка пилорического мельница ритм сетей) 10,, 11, таким образом лучшего понимания возникающих функциональных свойств STG также поможет понять, как в целом CPG сетей создания своей сети уровня функциональности. CPG сети играют важную роль в управление двигателем 12, а также в высших когнитивных функций 13, следовательно, лучше понимать своих возникающие свойства могут оказать существенное влияние на многие области нейронауки.
Раскрытие информации
Благодарности
Мы признаем, поддержка Школа вычислительной техники и факультет естественных наук, сельского хозяйства и инженерного из Университета Ньюкасла, в Ульме университета, а также SciMedia Ltd (Токио, Япония).
Материалы
| Name | Company | Catalog Number | Comments |
| MiCAM02 | SciMedia | Imaging system | |
| BVAna v.10.08 | SciMedia | Data analysis software for the MiCAM 02 imaging system | |
| HL-151 | Moritex, Tokyo, Japan | Ultra-low ripple halogen light source | |
| BX51 WI | Olympus Corporation | Upright microscope for epifluorescence imaging | |
| 20x imaging objective | Olympus Corporation | XLUMPLFL20XW/0.95 | NA 0.95, WD 2.0mm |
| 10x imaging objective | Olympus Corporation | UMPLFL10XW | NA 0.30, WD 3.3mm |
| Filter cube with 480-550 nm excitation filter and 590nm emission filter | Olympus Corporation | MSWG2 | |
| Antivibration table | Scientifica Ltd | 63-534 | |
| PatchStar electrode manipulator | Scientifica Ltd | PS-7000C | Micro-electrode manipulator |
| CED Power 1401 | Cambridge Electronic Design | Data acquisition board | |
| DL708E Oscilloscope | Yokogawa | Intracellular amplifier | |
| AC differential amplifier | University of Kaiserslautern, Germany | Extracellular amplifier | |
| P-97 Flaming – Brown type electrode puller | Sutter Instrument Co. | Electrode puller | |
| Sigma Microcentrifuge 1-14 | Sigma-Aldrich | Centrifuge | |
| Genex Pipettors Mline | Scientific Laboratory Supplies LTD | PIP7774 | PIP7774 |
| Glass micropipette with filament | Science Products | GB100TF 8P | Glass for micr–lectrodes |
| MicroFil – 34G | World Precision Instruments, Inc. | Microfil needle | |
| Spike 2 v6.10 | Cambridge Electronic Design | Electrophysiology software | |
| Di-8-ANEPPQ | Cambridge BioScience | BT61014 | Fluorescent voltage sensitive dye |
| F-127 Pluronic Acid, DMSO | Invitrogen | P-3000MP | Solvent |
| NaCl | Sigma-Aldrich | S9888 | Crab saline component |
| CaCl2 . 2H2O | Sigma-Aldrich | C3881 | Crab saline component |
| KCl | Sigma-Aldrich | P3911 | Crab saline component, electrolyte solution |
| MgCl2 . 6H2O | Sigma-Aldrich | M9272 | Crab saline component |
| Trizma base | Sigma-Aldrich | T1503 | Crab saline component |
| Maleic acid | Sigma-Aldrich | M0375 | Crab saline component |
| Elastosil RT-601 | Wacker, Munich, Germany | Lining of Petri dishes |
Ссылки
- Gutierrez, G. J., Grashow, R. G. Cancer borealis stomatogastric nervous system dissection. J Vis Exp. , (2009).
- Bartos, M., Nusbaum, M. P. Intercircuit control of motor pattern modulation by presynaptic inhibition. J. Neurosci. 17, 2247-2256 (1997).
- Blitz, D. M., Nusbaum, M. P. Motor pattern selection via inhibition of parallel pathways. J Neurosci. 17, 4965-4975 (1997).
- Stein, W., Smarandache, C. R., Nickmann, M., Hedrich, U. B. Functional consequences of activity-dependent synaptic enhancement at a crustacean neuromuscular junction. J Exp Biol. 209, 1285-12300 (2006).
- Loew, L. Potentiometric dyes: Imaging electrical activity of cell membranes. Pure & Appl Chem. 68, 1405-1409 (1996).
- Tominaga, T., Tominaga, Y., Yamada, H., Matsumoto, G., Ichikawa, M. Quantification of optical signals with electrophysiological signals in neural activities of Di-4-ANEPPS stained rat hippocampal slices. J Neurosci Meth. 102, 11-23 (2000).
- Heinzel, H. G., Weimann, J. M., Marder, E. The behavioral repertoire of the gastric mill in the crab, Cancer pagurus: an in situ endoscopic and electrophysiological examination. J Neurosci. 13, 1793-1803 (1993).
- Zecevic, D., Wu, J. -. Y., Cohen, L. B., London, J. A., Höpp, H. P., Falk, C. X. Hundreds of neurons in the Aplysia abdominal ganglion are active during the gill-withdrawal reflex. J Neurosci. 9, 3681-3689 (1989).
- Briggman, K. L., Kristan, W. B. Imaging dedicated and multifunctional neural circuits generating distinct behaviors. J Neurosci. 26, 10925-10933 (2006).
- Nusbaum, M. P., Beenhakker, M. P. A small-systems approach to motor pattern generation. Nature. 417, 343-350 (2002).
- Marder, E., Bucher, D. Understanding circuit dynamics using the stomatogastric nervous system of lobsters and crabs. Ann Rev Physiol. 69, 291-316 (2007).
- Grillner, S. Biological pattern generation: the cellular and computational logic of networks in motion. Neuron. 52, 751-766 (2006).
- Yuste, R., MacLean, J. N., Smith, J., Lansner, A. The cortex as a central pattern generator. Nat Rev Neurosci. 6, 477-483 (2005).
- Stein, W. Modulation of stomatogastric rhythms. J Comp Physiol A. 195, 989-1009 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены