Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Спинной мозг электрофизиологии II: внеклеточной изготовление электродов Всасывающая
В этой статье
Резюме
Демонстрация изготовления и использования внеклеточных электродов всасывания используется для измерения электрофизиологических записей новорожденных грызунов спинного мозга В пробирке
Аннотация
Развитие нейронных схемотехника и передвижения могут быть изучены с помощью новорожденных грызунов спинного мозга центральной картины генератора (CPG) поведение. Мы демонстрируем метод для изготовления электродов всасывания, которые используются для изучения CPG деятельности, или фиктивной локомоции, в расчлененное грызунов спинного мозга. Грызун спинного мозга находятся в искусственной спинномозговой жидкости и вентральных корешков втягиваются в всасывающего электрода. Электрода построен путем изменения имеющихся в продаже всасывания электрода. Тяжелее серебряной проволоки используется вместо стандартной проволоки дается коммерчески доступных электрода. Стеклянным наконечником на коммерческой электрод заменен пластмассовым наконечником для увеличения долговечности. Мы готовим рисованной электроды и электроды из конкретных размеров трубки, что позволяет согласованность и воспроизводимость. Данные собраны при помощи усилителя и программного обеспечения neurogram приобретения. Записи выполняются на стол воздуха внутри клетки Фарадея для предотвращения механических и электрических помех, соответственно.
протокол
Электрофизиологические записи изолированных спинного мозга может выявить генетические и развития изменений в нервной системы 1. Ранее мы показали метод препарировать новорожденных мышей спинной мозг 2. Здесь мы представляем метод подготовки всасывания полезных электродов в записи фиктивного передвижения в изолированных спинного мозга 3.
Кончик электрода пластиковые трубы может быть обращено на очень тонкой наконечником вручную с помощью низкотемпературной спиртовки 3-5. Пластиковые трубы (PE90, Клей Адамс Intramedic TM) проходит над пламенем, чтобы смягчить трубку в податливый форме. Как трубка начинает таять и становится более прозрачным он удаляется от источника тепла и концы аккуратно вытащил друг от друга. Сроки удаления трубки из пламени важно, чтобы застраховать пластик не свернуть или раскол в то же время выводы. Тонкая часть трубки разрезают бритвой в зависимости от желаемого внутреннего диаметра, как это диктуется возраст образца или сегментарного уровня мозга. Для удобства размещения уплотнительного кольца на трубу, 45 ° надрез на толстый конец трубки с лезвием бритвы. Наконечником и уплотнительные кольца установлены на толстый конец приложите электрод к стволу электрода.
Для того чтобы учесть в частности размера электродов и избежать трудностей, ручной потянув электрода советы, электроды могут быть построены с использованием малых трубки вставляется в толще трубки (PE90). Длины трубы являются специфическими для требований настройки записи и переменной. Мы представляем измерений, используемых в наших экспериментах 1-3,5. 1 см длины PTFE тонкая трубка (Зевс, мелкие детали) и 10 см длиной PE90 трубки разрезают бритвой. Концы небольшие трубки должны быть рассмотрены с целью убедиться, что они не задавить или закрыты. Они могут быть открыты с помощью насекомых контактный (Fine Инструменты наук). Каплю клея (JB Weld) помещается на середину трубки PTFE. Трубки из тефлона и клей втягиваются в PE90 трубки использованием рот всасывание на PE90 труб. 45 ° надрез на толстом конце трубки и наконечника и уплотнительное кольцо соединены, как и предыдущие.
Наконечником и BNC разъема отвинтил от коммерческих электрода всасывания. Разъем BNC замачивают в ксилоле в течение одного часа, чтобы удалить сургучной печати. Разъем затем промыть в воде и сушат.
Нижний угловой левого борта должны быть сделаны на стороне ствола. Металлический стержень нагревается использования горелки Бунзена и прессуют в существующие отверстия на боковой стороне ствола под небольшим углом. 15 см длиной 0,010 дюйма серебряной проволоки (AM Systems) разрезают и вымачивают в отбеливателя в течение пятнадцати минут. Это сделано, чтобы создать серебряное покрытие хлорид, который помогает в проведении сигнала 6. Проволокой промывают водой, сушат, а затем припаяны BNC разъем. BNC-разъемами и серебра вставляются в ствол всасывания электрод с достаточно места для BNC разъем оставаться в стороне от ствола. Всасывающая трубка вставляется в сторону порта 2-3см. Силиконовый герметик вводят в ствол примерно на 2-3см. BNC разъем с резьбой в ствол электрод нажатием герметик вперед.
Кончик электрода теперь вкручивается в передней части электрода. Термоусадочная трубка также может быть добавлен к укреплению линии всасывания со стороны порта.
Электроды крепятся на микроманипуляторами, которые прикреплены к магнитной стоит, и поместил рядом с записью блюдо. BNC коаксиальных кабелей крепятся к headstage, который подключен к усилителю. Усилитель подключен к адаптеру (PolyView), который подключен к аналоговой к цифровой карте (National Instruments) в компьютер с ПО для сбора данных (PolyView).
При записи электрофизиологических данных, необходимо устранить все вмешательства извне. Запись блюдо, усилитель, и глава этапе размещаются на стол воздуха внутри клетки Фарадея для предотвращения электрических и механических помех, соответственно.
Представитель Результаты:
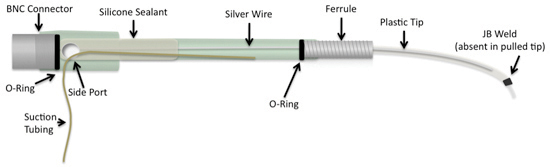
Рисунок 1. Коммерчески доступных всасывания электрода может быть изменен путем добавления тяжелее проволока серебро и пластмассовым наконечником, который стороны обращено на спиртовке, или построенных с имеющимися в продаже пластиковые трубы конкретных размеров. Кроме того, парафин герметик заменена на более долговечный герметик силиконовый конопатить.
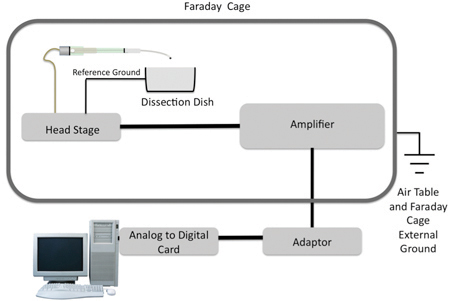
Рисунок 2. Схема всасывающего электрода по отношению к таблице воздуха (для механической изоляции), клетка Фарадея (электрически isolatiп.), усилитель и компьютер. Следует отметить, что есть основание ссылки на блюдо записи и второе основание, на которое ссылается на таблицу воздуха и клетки Фарадея.
Обсуждение
Нервная система развития могут быть изучены с помощью изолированного спинного мозга грызунов. В присутствии медиаторов, фиктивный передвижения могут быть сгенерированы из спинного мозга в виде узорной электрической активности 1,3. Эти ритмичные очередей производятся на 0,2 до 0,5 ?...
Раскрытие информации
Благодарности
Сэмюэл Л. Пфафф является профессором в лаборатории экспрессии генов в Солка института биологических исследований и следователь в Медицинского института Говарда Хьюза. Эта работа была поддержана Кристофера и Даны Рив Foundation. Джо Belcovson, Кент Schnoeker и Майк Салливан в мультимедийных ресурсов в Институте Солка оказана помощь с фотографией и редактирования.
Материалы
| Name | Company | Catalog Number | Comments |
| PTFE Sub Lite Wall Tubing (Small tubing) | Zeus | 36AWG | 0.005”ID x 0.003” Wall (Small Parts) Also available in 0.003” to 0.006” |
| Large tubing (0.86mm (0.34”)) | BD Biosciences | 427420 | 0.86mm (0.34”) O.D. 1.27mm (.050”) |
| Electrode Barrel | A-M Systems | 573000 | |
| Adhesive | JB Weld | ||
| Adhesive: Silicone caulk | |||
| Solder and soldering iron | |||
| Bleach | |||
| Xylene | |||
| Silver wire: 0.010” | A-M Systems | ||
| Insect pins: Austerlitz 0.1mm | Fine Science Tools | 26002-10 | |
| Magnetic Stand | Narishige International | GJ-8 | |
| Micromanipulator | Narishige International | MN 151 | |
| Miniboard (Headstage) | Grass Technologies | F-15EB/B1 | |
| Polyview Adaptor Unit | Grass Technologies | PVA 8 | |
| Bipolar Portable Physiodata Amplifier System | Grass Technologies | 15LT | |
| ANALOG TO DIGITAL CARD | National Instruments | 6035E | |
| Air Table; Vibraplane | Kinetic Systems |
Ссылки
- Gallarda, B. W., Sharpee, T. O., Pfaff, S. L., Alaynick, W. A. Defining rhythmic locomotor burst patterns using a continuous wavelet transform. Ann N Y Acad Sci. 1198, 133-139 (2010).
- Meyer, A., Gallarda, B. W., Pfaff, S., Alaynick, W. Spinal cord electrophysiology. J Vis Exp. , (2010).
- Gallarda, B. W. Segregation of axial motor and sensory pathways via heterotypic trans-axonal signaling. Science. 320, 233-236 (2008).
- Landmesser, L. The development of motor projection patterns in the chick hind limb. J Physiol. 284, 391-414 (1978).
- Myers, C. P. Cholinergic input is required during embryonic development to mediate proper assembly of spinal locomotor circuits. Neuron. 46, 37-49 (2005).
- Chanin, M. The determination of chloride by use of the silver-silver chloride electrode. Science. 119, 323-324 (1954).
- Goulding, M. Circuits controlling vertebrate locomotion: moving in a new direction. Nat Rev Neurosci. 10, 507-518 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены