Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Изучение сотовый Роллинг Траектории на ассиметричные паттерны рецепторов
В этой статье
Резюме
Мы опишем протокол наблюдать и анализировать подвижного траекторий на асимметричные рецепторов узором субстратов. Полученные данные являются полезными для инженерно рецептора узором субстраты для этикетки без разделения клетки и анализа.
Аннотация
Боковое смещение клеток ортогональной водотока путем прокатки на асимметричных моделей рецептор представляет возможность для разработки новых устройств для этикеток без разделения и анализа клеток 1. Такие устройства могут использовать боковое смещение для непрерывного потока разделения, или рецептор модели, которые модулируют адгезии различать различные фенотипы клеток или уровни экспрессии рецептора. Понимание природы клеточных подвижного траекторий на рецептор узором субстратов необходимо для инженерных подложек и дизайн таких устройств.
Здесь мы демонстрируем протокол для изучения ячейки подвижного траекторий на асимметричные модели рецепторов, которые поддерживают ячейки прокатки сцепление 2. Четко определенные, мкм масштаба модели P-селектина рецепторы были изготовлены с использованием микроконтактной печати на золотым покрытием слайды, которые были включены в проточную камеру. HL60 клеток, экспрессирующих PSGL-1 лиганд 3 были текла по области узорной линии и отображаются на ярком перевернутый микроскоп поле. Клетки проката и отслеживаются по наклонным краям узорами, в результате чего боковое отклонение 1. Каждая клетка обычно проката на определенное расстояние вдоль края шаблона (определяется как длина отслеживания край), отделен от края, и подключить к течению узор. Хотя этот отряд делает ее трудно отследить всей траектории клетку от входа, чтобы выйти в проточную камеру, частица слежения программное обеспечение было использовано для анализа и выход подвижного траектории клеток в течение времени, когда они двигались по одним рецептором узором линии. Траекторий затем были рассмотрены с целью получения распределений клеточных подвижного скоростей и края отслеживания длины для каждой ячейки для различных моделей.
Этот протокол используется для количественного ячейки подвижного траекторий на рецептор модели и связанные этим параметрам инженерных таких как угловая форма и напряжение сдвига. Такие данные будут полезны для проектирования микрожидкостных устройств для этикеток без разделения клетки и анализа.
протокол
1. HL60 ячейки подвижного
1.1. Изготовление рисунком поверхности.
- Использование микроконтактной печати (μCP) 4-7, чтобы сделать переменного самоорганизующихся монослоев (ЗРК) ПЭГ молекул на золотым покрытием слайды стекла: Изготовление микроконтактной печати полидиметилсилоксан (PDMS) марок, что определенный рецептор модели с углом наклона α = 10 °, SU-8 процесса формования. Очистите поверхности золота с пираньи решение (3:1 смесь серной кислоты до 30% пероксида водорода) в течение 20 минут и затем ополосните поверхность с обильным воды DI в 24,5 ° C до использования. Чернила штамп PDMS с 5 мМ раствор ПЭГ в этаноле. Сухой штамп на воздухе в течение 20 минут. Аккуратно положил печать на поверхности золота в течение 40 секунд и убедитесь, что есть хороший контакт между поверхностью золота и печатью. Нет избыточного давления не требуется. Промыть поверхность с этанолом и высушить под струей N 2.
- Инкубируйте субстрата в Р-селектина решение (15 мкг / мл в DPBS) с помощью перфузионной камере (Электронная микроскопия наук) в течение 3 часов при 24,5 ° C, чтобы скопировать оставшиеся районы с P-селектина. Промыть поверхность с обильным DPBS.
- Засыпка поверхности с BSA (1 мг / мл в DPBS) в течение 1 ч для блокирования неспецифических взаимодействий. Промыть поверхность с обильным DPBS.
1.2. Сотовые Роллинг Эксперименты в потоке палаты.
- Поток приостановлении HL60 клетки (~ 10 5 клеток / мл) по сравнению с узорной поверхности в прямоугольной камере потока (Glycotech, Inc, ширина W = 1,0 см, длина = 6 см, высота Н = 0,0127 см) при 24,5 ° C. Используйте шприцевой насос (инструменты Всемирного Precision, SP230IW) для генерации скорости потока 75 мкл / мин, с соответствующими напряжение сдвига около 0,5 дин / см 2 (~ 0,05 Па). Рассчитать напряжение сдвига τ с помощью плоского течения Пуазейля уравнение τ = 6μQ/wh 2, где μ-кинематическая вязкость (0,001002 Па с), Q является объемная скорость потока, ш ширина потока камеры и ч является высота проточную камеру.
- Использование инвертированного микроскопа (Nikon TE2000-U) с смонтирована камера (Андор IXON 885) для записи HL60 клетки прокатке взаимодействие с клеем P-селектина подложках с использованием 4 × цель, как правило, со скоростью 1 кадр в секунду при длительности 300 s. Выполните три независимых экспериментов, для каждого сдвига величины напряжения и угол наклона картины. Представление данных, как среднее значение и стандартное отклонение средней величины, полученные от каждого эксперимента.
- Анализ данных.
Анализ последовательности изображений на индивидуальные Matlab (MathWorks, Inc) программы, которые использовали частицы отслеживания бесплатная 8 генерировать дорожки вдоль узорными краями линии. Треки продлении до конца P-селектина нитью, будут выделены и оборудованные двумя отрезками прямых линий - один в соответствие с потоком, другие приведены в соответствие с картины края. Эти два сегмента в дальнейшем используются для вычисления длины края слежения, скорость качения на краю, и скорость качения на равнине регионе.
2. Представитель Результаты:
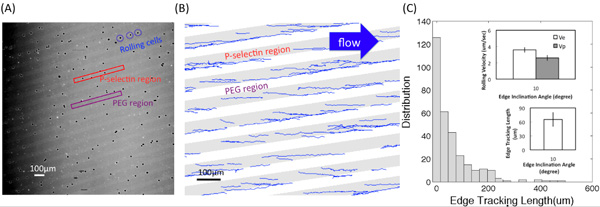
На рисунке (А) показывает один из микроскопа изображения преобразованы из видео HL60 прокатке взаимодействие с клеем P-селектина подложках с использованием 4 × цели. Светлые и темные области соответствуют Р-селектина рецепторов и PEG регионов, соответственно. Рис (B) показывает треки получены с помощью пользовательской программы Matlab. Угол наклона края составляла 10 ° и напряжение сдвига составляла 0,5 дин / см 2. Длина ребра слежения, л е, перемещение, д, и скорости прокатки на краю и внутри групп, V е и V р, соответственно, описаны на рисунке (С-1). Рис (С-2) показывает, распределения (число зарегистрированных клеток) с длиной ребра слежения. На врезках среднее значение л е и скорость качения на краю (V е) и внутри полосы (V р) на угол наклона α = 10 ° и сдвига жидкости величины напряжения около 0,5 дин / см 2. Планки погрешностей представляют одно стандартное отклонение, где п = 3 повторить эксперименты (3 повторить поверхностей) для каждого условия.
Обсуждение
Мы описали протокол для изучения ячейки подвижного траекторий на асимметричные рецепторов узором поверхности изготовлены с использованием микроконтактной печати 2. Оптических изображений микроскопа узорчатой поверхности показывает четкий контраст между ПЭГ и Р-селектина ...
Раскрытие информации
Благодарности
Этот проект был поддержан Deshpande Центр технологических инноваций в Массачусетском технологическом институте (РК и JMK) и премии NSF КАРЬЕРА 0952493 в РК через химической и биологической программы Цветоделение. Мы благодарим Институт солдата нанотехнологий (ISN) и Microsystems техническая лаборатория (МТЛ) в Массачусетском технологическом институте за использование их средств.
Материалы
| Name | Company | Catalog Number | Comments |
| Human promyelocytic leukemia cells | ATCC | CCL-240 | HL60 cells |
| Gold-coated glass slides | EMF | TA134 | Gold slides |
| (1-Mercaptoundec-11-yl)tetra(ethylene glycol) | Sigma-Aldrich | 674508 | PEG |
| Recombinant human P-selectin | R&D Systems | ADP3-050 | P-selectin |
| Bovine serum albumin | Rockland Immunochemicals | BSA-50 | BSA |
| Dulbecco’s phosphate buffered saline | Mediatech, Inc. | 21-030 | DPBS |
| Sulfuric acid | Sigma-Aldrich | 339741 | |
| Hydrogen peroxide | Sigma-Aldrich | 316989 |
Ссылки
- Karnik, R., Hong, S., Zhang, H., Mei, Y., Anderson, D. G., Karp, J. M., Langer, R. Nanomechanical control of cell rolling in two dimensions through surface Patterning of receptors. Nano Lett. 8 (4), 1153-1158 (2008).
- Lee, C. H., Bose, S., Van Vliet, K. J., Karp, J. M., Karnik, R. Examining Lateral Displacement of HL60 Cells Rolling on Asymmetric P-selectin Patterns. Langmuir. 27 (1), 240-249 (2011).
- Norman, K. E., Moore, K. L., McEver, R. P., Ley, K. Leukocyte rolling in-vivo is mediated by p-selectin glycoprotein ligand-1. Blood. 86 (12), 4417-4421 (1995).
- Bernard, A., Delamarche, E., Schmid, H., Michel, B., Bosshard, H. R., Biebuyck, H. Printing patterns of proteins. Langmuir. 14 (9), 2225-2229 (1998).
- James, C. D., Davis, R. C., Kam, L., Craighead, H. G., Isaacson, M., Turner, J. N., Shain, W. Patterned protein layers on solid substrates by thin stamp microcontact printing. Langmuir. 14 (4), 741-744 (1998).
- Mrksich, M., Whitesides, G. M. Using self-assembled monolayers to understand the interactions of man-made surfaces with proteins and cells. Annual Review of Biophysics and Biomolecular Structure. 25, 55-78 (1996).
- Tan, J. L., Tien, J., Chen, C. S. Microcontact printing of proteins on mixed self-assembled monolayers. Langmuir. 18 (2), 519-523 (2002).
- Lee, D., King, M. R. Microcontact Printing of P-Selectin Increases the Rate of Neutrophil Recruitment Under Shear Flow. Biotechnology Progress. 24 (5), 1052-1059 .
- Greenberg, A. W., Hammer, D. A. Cell separation mediated by differential rolling adhesion. Biotechnol. Bioeng. 73 (2), 111-124 (2001).
- Higuchi, A., Tsukamoto, Y. Cell separation of hepatocytes and fibroblasts through surface-modified polyurethane membranes. J. Biomed. Mater. Res. Part A. 71A (3), 470-479 (2004).
- Alexeev, A., Verberg, R., Balazs, A. C. Patterned surfaces segregate compliant microcapsules. Langmuir. 23 (3), 983-987 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены