Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Анализ функций малого ГТФаз по микроинъекции Плазмиды в поляризованных эпителиальных клеток
* Эти авторы внесли равный вклад
В этой статье
Резюме
Эта статья подробно описывает процедуры, связанные с гиперэкспрессией и анализа малых ГТФаз в поляризованных эпителиальных клеток с помощью микроинъекции техники.
Аннотация
Epithelial cells polarize their plasma membrane into biochemically and functionally distinct apical and basolateral domains where the apical domain faces the 'free' surfaces and the basolateral membrane is in contact with the substrate and neighboring cells. Both membrane domains are separated by tight junctions, which form a diffusion barrier. Apical-basolateral polarization can be recapitulated successfully in culture when epithelial cells such as Madin-Darby Canine Kidney (MDCK) cells are seeded at high density on polycarbonate filters and cultured for several days 1 2. Establishment and maintenance of cell polarity is regulated by an array of small GTPases of the Ras superfamily such as RalA, Cdc42, Rab8, Rab10 and Rab13 3 4 5 6 7. Like all GTPases these proteins cycle between an inactive GDP-bound state and an active GTP-bound state. Specific mutations in the nucleotide binding regions interfere with this cycling 8. For example, Rab13T22N is permanently locked in the GDP-form and thus dubbed 'dominant negative', whereas Rab13Q67L can no longer hydrolyze GTP and is thus locked in a 'dominant active' state 7. To analyze their function in cells both dominant negative and dominant active alleles of GTPases are typically expressed at high levels to interfere with the function of the endogenous proteins 9. An elegant way to achieve high levels of overexpression in a short amount of time is to introduce the plasmids encoding the relevant proteins directly into the nuclei of polarized cells grown on filter supports using microinjection technique. This is often combined with the co-injection of reporter plasmids that encode plasma membrane receptors that are specifically sorted to the apical or basolateral domain. A cargo frequently used to analyze cargo sorting to the basolateral domain is a temperature sensitive allele of the vesicular stomatitis virus glycoprotein (VSVGts045) 10. This protein cannot fold properly at 39°C and will thus be retained in the endoplasmic reticulum (ER) while the regulatory protein of interest is assembled in the cytosol. A shift to 31°C will then allow VSVGts045 to fold properly, leave the ER and travel to the plasma membrane 11. This chase is typically performed in the presence of cycloheximide to prevent further protein synthesis leading to cleaner results. Here we describe in detail the procedure of microinjecting plasmids into polarized cells and subsequent incubations including temperature shifts that allow a comprehensive analysis of regulatory proteins involved in basolateral sorting.
протокол
1. Выделение плазмидной ДНК
- Используйте Sigma-Aldrich эндотоксина бесплатный комплект maxiprep подготовить эндотоксина свободной ДНК в соответствии с протоколом производителя. Этот комплект работает на нас, потому что она надежно удаляет любые эндотоксинов из препаратов ДНК. Эндотоксины, которые вводили ДНК в ядрах клеток приводит к гибели клеток.
- Добавить 100 мкл фенола / chlorofom / изоамилового спирта (25:24:1), чтобы выделенной ДНК, вихревые и спина в течение 1 мин при 13000 оборотов в минуту в микроцентрифужных Эппендорф. Передача верхней фазы воды в новую пробирку и добавить 100 мкл хлороформа / изоамилового спирта (24:1), вихревые и спин, что и выше. Передача верхней фазе воды, содержащие ДНК, чтобы новые трубы. Этот шаг необходим для удаления белка из ДНК, которая предотвращает засорение микроинъекции иглы.
- Осадок ДНК, добавив Na ацетат (рН 6,0) до конечной концентрации 300 мМ и 2 х т. 100% этанола. Инкубировать при температуре -20 ° С в течение ночи. Спиновые ДНК в течение 20 мин при 13000 оборотов в минуту в микроцентрифужных Эппендорф, мыть один раз с 70% этанола, и ресуспендируют в 300 мкл эндотоксина без воды (Sigma-Aldrich).
- Определение концентрации ДНК. Типичная концентрация ДНК составляет от 1 до 5 мкг / мкл.
2. Культура MDCK клетках
- Сплит MDCK клеток. Граф клеток и семян 4 х 10 5 клеток на ясно 12-мм фильтры Transwell (0,4 мкм, размер пор, Corning Costar, 3460). Для эксперимента содержащие макет инъекции управления и двух различных мутантных белков Раб нужно семян трех фильтров.
- Культуры MDCK клеток в среде MEM с 2 мМ L-глутамина, 0,1 мг / мл пенициллина / стрептомицина и 7% (об / об) эмбриональной телячьей сыворотки (= СМИ MEM роста) при 37 ° С и 5% СО 2.
- Изменение информации в базолатеральной камеру каждый день. Это способствует поляризации процесс, так как он имитирует ситуацию эпителиальных клеток у животных.
- 2-х дней после посева проверки в микроскоп ли клетки растут в закрытой монослоя. Если вы не можете обнаружения возможных дыр в монослой, выполнить свой эксперимент на 3 день. Если Есть еще дыры, выполнить свой эксперимент на 4-й день.
3. Процедура Микроинъекция и после инъекции Инкубации
- В день эксперимента подготовить 5 мл MEM питательной среды плюс 50 мМ HEPES в одном 60 х 15 мм пластины для каждого фильтра и поместить в 39 ° C инкубатора. Кроме того, создать одну лунку 12-луночного планшета с 1 мл MEM питательной среды плюс 50 мМ HEPES и 0,1 мг / мл циклогексимид в фильтр, и поместите в 31 ° C инкубатора.
- Включите микроинъекции микроскопа и установить его нагревают этапе до 39 ° C. Мы используем инвертированного микроскопа (Axiovert 200, объективом Carl Zeiss MicroImaging, Inc) с подогревом этапе, 10X и 32X цели и Эппендорф Femtojet (Injectman Ni2). И наконец, открыть резервуар азота, которая поставляет воздух стол с азотом.
- Развести ДНК с фильтрованной водой (используйте фильтр 0,2 мкм) до конечной концентрации 0,2 мг / мл в общем объеме 10 - 100 мкл. Впоследствии, спина ДНК в микроцентрифужных Эппендорф при 13000 оборотов в минуту в течение 30 мин. Снимите верхнюю часть и место в новой трубки. Этот шаг гарантирует, что при загрузке вашего разбавленный ДНК в микроинъекции иглы вы можете точно нагрузки "чистым" ДНК. Ваша ДНК готов к микроинъекции.
- Подготовка клетки, взяв первый из фильтра его культуры блюдо. При хирургическом лезвия (перо Хирургическое Blade, нержавеющая сталь, № 11), вырезать фильтр из держателя фильтра и поместить в 5 мл, 39 ° С теплыми питательной среды MEM плюс 50 мМ HEPES (60 х 15 мм пластины). Взвесьте вниз фильтра в культуре пластину с лезвием хирургического вы использовали для резки его. Поставьте его на фильтр так, что отверстие хирургические лезвия окружает середине фильтра. Наведите культуры пластины на нагревательный столик микроскопа.
- Нагрузка 2-3 мкл разбавленного вашей ДНК (в данном случае кодирования плазмид VSVGts045-GFP = макет контроль инъекций) в микроинъекции иглы (Femtotip II, Эппендорф, 930000043), твист защитную крышку иглы и дать ему упасть на пол . Теперь игла готова быть пьяным в держатель. Для этого нажмите клавишу меню вашего injectman и убедитесь, что клапан закрыт. Винт иглу в держатель, будьте осторожны, чтобы не винт в иглу слишком сильно, поскольку это может привести к поломке. Теперь, нажмите клавишу меню снова, применяемые Р С предотвратит СМИ от того, всасывается в иглу во время процедуры microinjeciton. Наконец, нажмите джойстик, чтобы стереть хранится самонаведения.
- Чтобы опустить иглу на клетки, используйте 10X цель и принести иглу в луч света над жидкостью. Теперь акцент на клетки, довести фокус снова, повернув колесо фокус 180 ° вверх, и найти иголку. Впоследствии, медленно перемещайте иглы в центр внимания, а затем привести в фокусе снова (рабочие по приведению клетки в центре внимания снова), сбить иглу длякли снова. Повторяйте, пока игла не коснется поверхности средствах массовой информации, и в этот момент все, что вы увидите, это гало. Когда вы дойдете до точки, в которой клетки находятся в центре внимания, но иглы все еще нечеткое (то есть из фокальной плоскости) изменение целей 32X и тонкой грубой настройки.
- Установите Z-лимит, касаясь апикальной мембраны с кончиком иглы и вычитая около 10 мкм, как ядер закладываем около 10 мкм под апикальной мембраны.
- После установки Z-предел, найти правильное давление впрыска. Начало в 95 PSI. Если давление слишком высокое, ваши клетки взорвется. Если давление слишком низкое, то вы увидите белую точку, которая остается, но ничего не происходит. При успешной инъекции, вы увидите изменения фазы без изменения размера ячейки. Для инъекций, принесите иглу пару микрон из фокальной плоскости как можно быстрее. Цель с иглой над ядром (т.е. середина отдельной клетки) и нажмите инъекции клавишу джойстика, но не удерживайте кнопку нажатой.
- Inject 100-500 клеток в отверстие вашего хирургического лезвия, которая лежит на ваших клеток. Когда вы закончите, поместите клеток с блюдом культуры и хирургические лезвия в 39 ° C инкубатор, и инкубировать в течение 2 ч. За это время VSVGts045-GFP выражается и выделяются в ER. Тем не менее, на 39 ° C, VSVGts045-GFP не раз правильно и, следовательно, не могут оставлять ER. Между тем, небольшие ГТФ интерес будет накапливаться в цитозоле в сотрудничестве инъекции экспериментов.
- Через 2 ч, разместить клеток в 1 мл MEM питательной среды плюс 50 мМ HEPES и 0,1 мг / мл циклогексимид в 12-луночного планшета и инкубировать в течение 2 ч при 31 ° C. За это время погони, VSVGts045-GFP сбросят правильно, оставьте ER и поставляется на поверхности клетки.
- Повторите шаги с 3,1 - 3,10 для фильтров два (плазмиды вводить кодировку VSVGts045-GFP и, например, V5 с метками Rab13T22N) и три (вводят плазмиды кодирования VSVGts045-GFP и, например, V5 с метками Rab13Q67L). Каждая инъекция займет около 20 - 60 мин. Тем не менее, она имеет решающее значение для лечения каждого фильтра так же всей температурный сдвиг инкубации и поверхностные окрашивания до устранения клеток. После фиксации, вы можете выполнять всю оставшуюся окрашивание протокола для всех фильтров в то же время.
4. Поверхностное окрашивание для иммунофлуоресценции анализа
Обратите внимание, во избежание отбеливания GFP сигнал VSVGts045-GFP, защищают образцы от света, покрывая с алюминиевой фольгой в течение всех последующих процедур.
- Если вы хотите выполнить окрашивание поверхности, поместите клеток в культуре блюдо на металлическую пластину на льду и мыть клетки 1X с ледяным PBS 2 + (PBS [0,2 г / л KCl, 0,2 г / л KH 2 PO 4, 8 г / л NaCl и 2,17 г / л Na 2 HPO 4 х 7 H 2 O] плюс 0,1 г / л CaCl 2 и 0,1 г / л MgCl 2 х 6 H 2 O). Впоследствии, место 30 мкл антител, которая признает эктодомена вашего белка, в данном случае мышиных моноклональных антител TK1 (IgG 1, полученные с конца Томас Kreis), на чистую парафильмом размещены на металлическую пластину на льду. Место фильтр с вашим клеткам с ног на голову на капли и добавить несколько капель антител на обратной стороне фильтра. Инкубируйте в течение 1 часа на льду.
- Место клеток в 12-луночного планшета, мыть 3X с ледяным PBS 2 + (или RT теплой PBS 2 + без предварительного окрашивания поверхности), и исправить с 3% параформальдегида в течение 15 мин при комнатной температуре.
- Вымойте клетки сразу с PBS 2 + и оставить в PBS 2 + в течение 5 мин.
- Инкубируйте клетки в блокировании / пермеабилизации буфера (BPB) (2% [вес / объем] БСА, 0,4% [вес / объем] сапонина в PBS 2 +) с 10% [об / об] козу сыворотки. Инкубируйте 1 час при комнатной температуре.
- Развести первичных антител для обнаружения выразил Раб ГТФ, в этом примере анти-V5 (мышиное моноклональное антитело IgG 2а, Invitrogen), 1:200 в BPB. Спиновые разбавленного антитела в микроцентрифужных Эппендорф в течение 10 мин при 13000 оборотах в минуту. Место 30 мкл раствора антител на чистую парафильмом помещен в мокрой камеры. Место клеток на фильтре с ног на голову на антитела падение и инкубировать в течение 1 часа при комнатной температуре.
- Место клетки обратно (правой стороной вверх) в 12-луночного планшета и промыть 5 раз в течение 30 минут с BPB при комнатной температуре.
- Развести соответствующие вторичные антитела, в данном случае антимышиного IgG 1 Alexa 594-меченых (для VSVG обнаружения на поверхности, Invitrogen), и Cy5 меченых вторичных антител для распознавания вашего Раб ГТФ, в этом примере антимышиного IgG 2а Cy5 меченных (Jackson ImmunoResearch), 1:200 в BPB и спин, что и выше. Место 30 мкл раствора антител на чистую парафильмом в мокрую камеру и поместить клетки на фильтр вверх дном на антитела капли. Инкубируйте 1 час при комнатной температуре.
- Повторите шаг 4.6.
- Dip клеток на фильтре 3X в деионизированной воды и место тIGHT стороной вверх на microslides. Добавить 10-15 мкл горы (10% [вес / объем] DABCO, 50% [вес / объем] глицерина в дистиллированной воде) в верхней части клетки. Место 18x18 мм микро покровного стекла на вершине и использованием тканей лица слегка нажмите на микро стеклянной крышкой на клетки. Печать с лаком для ногтей.
- Анализ образцов с конфокальной микроскопии. Мы использовали микросистемная LSM 510, объективом Carl Zeiss MicroImaging, Inc, которая была оснащена 63x объектив погружением в воду.
- Для подготовки цифры, настраивать и комбинировать изображения с помощью таких программ, как Adobe Photoshop и Adobe Illustrator.
5. Представитель Результаты
Примеры того, как коэкспрессией малого ГТФаз мешает VSVG сортировки просьба ссылаться на опубликованные статьи или для апикальной missorting 3, 4 или ингибирование поверхности доставки 7.
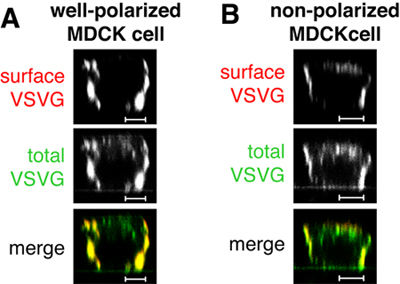
Рисунок 1. В макете инъекции, то есть введение только плазмиды, кодирующей VSVGts045-GFP, белка доставляется базолатеральной поверхности хорошо поляризованного MDCK клетках можно судить по поверхности окраски (красные, Рисунок 1). Обратите внимание, что не все VSVGts045-GFP доставляется базолатеральной мембраны во время погони на 31 ° C, о чем свидетельствует обширная внутриклеточный сигнал для общего белка (в зеленом, рисунках 1 и В). В клетках, которые не так-поляризованного VSVGts045-GFP будет поставляться также на апикальной мембране (рис. 1 б). Если ваши образцы контроль выглядеть ячейки на рисунке 1 В, вы не можете доверять свои данные и придется повторить эксперимент с более-поляризованных клеток. Шкала баров 5 мкм.
Обсуждение
Наиболее важных шагов для успешного эксперимента микроинъекции являются качество и чистоту ДНК и полярность ваших клеток. Без поляризованных клеток, инъекции ваш контроль будет уже mistargeted VSVG и эксперимент не может быть использован. Если ДНК имеет низкое качество, ДНК может засорить ин...
Раскрытие информации
Благодарности
Эта работа финансировалась за счет гранта от Национального института здоровья (GM070736) к H. Fölsch. SF Анг была поддержана * STAR награды стипендии Высшее и RS Кан был поддержан клеточной и молекулярной основы болезни программы обучения (GM8061)
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | |
| Axiovert 200 Микроскоп с подогревом этапе | Carl Zeiss Inc | Индивидуальный заказ | |
| Injectman Ni2 Femtojet микроманипулятора | Эппендорф | Индивидуальный заказ | |
| Femtotips II (Микроинъекция иглы) | Эппендорф | 930000043 | |
| Microloader советы | Эппендорф | 930001007 | |
| Открытый 12-мм transwell фильтр поддерживает | Corning Costar | 3460 | |
| Эндотоксина без плазмиды комплект maxiprep | Sigma-Aldrich | NA0400 |
Ссылки
- Mellman, I., Nelson, W. J. . Nature reviews. 9 (11), 833-833 (2008).
- Rodriguez-Boulan, E., Kreitzer, G., Musch, A. . Nature reviews. 6 (3), 233-233 (2005).
- Ang, A. L., Fölsch, H., Koivisto, U. M. . The Journal of cell biology. 163 (2), 339-339 (2003).
- Kroschewski, R., Hall, A., Mellman, I. . Nature cell biology. 1 (1), 8-8 (1999).
- Moskalenko, S., Henry, D. O., Rosse, C. . Nature cell biology. 4 (1), 66-66 (2002).
- Schuck, S., Gerl, M. J., Ang, A. . Traffic (Copenhagen, Denmark). 8 (1), 47-47 (2007).
- Nokes, R. L., Fields, I. C., Collins, R. N. . The Journal of cell biology. 182 (5), 845-845 (2008).
- Collins, R. N. Molecular cell. 12, 1064-1064 (2003).
- Hall, A. . Science (New York, N.Y. 279 (5350), 509-509 (1998).
- Scales, S. J., Pepperkok, R., Kreis, T. E. . Cell. 90 (6), 1137-1137 (1997).
- Keller, P., Toomre, D., Diaz, E. . Nature cell biology. 3 (2), 140-140 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены