Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Инженерно-биологической основе сосудистых трансплантатов использовании пульсирующего биореактора
В этой статье
Резюме
Наша группа разработала систему биореакторов культуры, который имитирует физиологическим стрессам пульсирующей сердечно-сосудистой системы к регенерации имплантируемых малого диаметра сосудистых трансплантатов.
Аннотация
Much effort has been devoted to develop and advance the methodology to regenerate functional small-diameter arterial bypasses. In the physiological environment, both mechanical and chemical stimulation are required to maintain the proper development and functionality of arterial vessels1,2.
Bioreactor culture systems developed by our group are designed to support vessel regeneration within a precisely controlled chemo-mechanical environment mimicking that of native vessels. Our bioreactor assembly and maintenance procedures are fairly simple and highly repeatable3,4. Smooth muscle cells (SMCs) are seeded onto a tubular polyglycolic acid (PGA) mesh that is threaded over compliant silicone tubing and cultured in the bioreactor with or without pulsatile stimulation for up to 12 weeks. There are four main attributes that distinguish our bioreactor from some predecessors. 1) Unlike other culture systems that simulate only the biochemical surrounding of native blood vessels, our bioreactor also creates a physiological pulsatile environment by applying cyclic radial strain to the vessels in culture. 2) Multiple engineered vessels can be cultured simultaneously under different mechanical conditions within a controlled chemical environment. 3) The bioreactor allows a mono layer of endothelial cells (EC) to be easily coated onto the luminal side of engineered vessels for animal implantation models. 4) Our bioreactor can also culture engineered vessels with different diameter size ranged from 1 mm to 3 mm, saving the effort to tailor each individual bioreactor to fit a specific diameter size.
The engineered vessels cultured in our bioreactor resemble native blood vessels histologically to some degree. Cells in the vessel walls express mature SMC contractile markers such as smooth muscle myosin heavy chain (SMMHC)3. A substantial amount of collagen is deposited within the extracellular matrix, which is responsible for ultimate mechanical strength of the engineered vessels5. Biochemical analysis also indicates that collagen content of engineered vessels is comparable to that of native arteries6. Importantly, the pulsatile bioreactor has consistently regenerated vessels that exhibit mechanical properties that permit successful implantation experiments in animal models3,7. Additionally, this bioreactor can be further modified to allow real-time assessment and tracking of collagen remodeling over time, non-invasively, using a non-linear optical microscopy (NLOM)8. To conclude, this bioreactor should serve as an excellent platform to study the fundamental mechanisms that regulate the regeneration of functional small-diameter vascular grafts.
протокол
Автоклав
Собрать и автоклава труб для системы потока и биореактор компонентов (биореактор себя и крышки силиконовой пробкой), как указано на рисунке 1 и рисунке 2. Кормление трубка имеет штекер на одном конце и открытый конец на другую сторону. Три коротких отрезков трубы вставляются через силиконовый колпачок для газообмена.
1. Швейные PGA Mesh
- Вырезать PGA сетки 1.1cm х ~ 8 см листов (в зависимости от биореактор размером).
- Чистая трубки силиконовые (3 мм внутренний диаметр) с дистиллированной водой (dH20) и сухой воздух перед использованием.
- Используйте Дексон 6,0 шва зашить PGA сетку вокруг чистой силиконовой трубкой, начиная с трех хирургических узлов следуют одно швов.
2. PGA Строительные леса для обработки поверхностей
- Dip PGA леса в 1 М NaOH в течение 1-2мин и записывать время лечения и использовать одновременно для всех PGA лесов.
- Промыть PGA лесов в ваннах dH2O в течение 2 минут 3 раза.
- Пэт PGA леса насухо Kimwipes между купанием в дН 2 ванны-вывода.
- Сухие строительные леса PGA под капотом культуре ткани высохнуть на воздухе в течение 15 минут с вентилятором далее.
3. Швейные оружия Dacron
- Используйте Prolene 4,0 шва шить небольшие кусочки Dacron манжетами (1 см) на каждом конце сетки PGA с перекрытием 2-3мм. Примечание: будьте осторожны, чтобы не прокалывать силиконовые трубки (рис. 3).
- Используйте те же шов, чтобы сшить три стежка вокруг свободного конца Dacron манжетами. Не забудьте оставить достаточно швов на свободные концы Prolene шва за шагом 5,1 (рис. 3).
4. Ассамблея биореактора (день до начала биореактор культуры)
- Замочите сшиты сетки и силиконовые трубки, хирургические инструменты, и тонкий провод в 70% этанола ванну на 20-30 минут.
- Открытое автоклаве пакетов содержащих биореактор и погрузить его в 70% этанола ванны, по крайней мере за 30 минут до сборки. Убедитесь в том, чтобы избавиться биореактор тщательно этанолом. Воздействие на все биореактор компонентов до 70% этанола шаг Помимо стерилизации. Этот шаг также удаляет эндотоксин, который не снимается в автоклаве и является вредным для сосудистых клеток.
- Вытяните силиконовые трубки через холодное оружие с использованием тонких провод тянуть его до конца.
- Возьмите биореактор из этанола ванны (держать сетку погружены в этанол). Fix PGA эшафот в биореакторе на крепление Dacron манжеты над вспыхнул губами стекла, затянув и сопутствующие вниз Prolene швов (рис. 3).
- Подключите одну сторону оружия биореактор стороны разъемов через силиконовые трубки.
- Вытяните другой стороне силиконовые трубки с достаточным напряжением и вставьте остальные два разъема в силиконовые трубки. Держитесь за силиконовые трубки плотно при установке разъемов!
- Вставьте биореактор в этанол ванной и на одном уровне с этанолом, осторожно потянув разъемы из боковых рукавов.
- Флип биореактор снова и позволит впитаться в течение 10 минут.
- Флип биореактор правой стороной вверх и выдержите в течение дополнительных 10 минут.
- Слейте все этанола.
- Настройка три большие чашки Петри (10 см) в ряд и место биореактор в центре блюда держать избыток этанола капала с концов труб.
- Флеш биореактор и PGA сетки с тканевой культуре воды, используя 5 мл или 10 мл пипетки. Также промывочной воды культуре ткани в силиконовые трубки.
- Тщательно слить лишнюю воду в чашки Петри по обе стороны от биореактора.
- Сухой биореакторе на ночь в капюшон с вентилятором на-и УФ-OFF.
- Дополнительные примечания: убедитесь, что стерильные мешалкой в биореактор. Удостоверьтесь, чтобы не "парить" над биореактор с этого момента, чтобы избежать загрязнения. Нарежьте много парафильмом полосы и замочить их в небольшом 70% этанола ванны (большой чашке Петри работает хорошо).
5. День 1: биореактор установки
- Место стерильную чашку Петри на открытии каждой биореактор для защиты внутри PGA лесов от загрязнения.
- Соберите потока система биореактора, как показано на рисунке 4 и парафильмом все суставы соединения.
- Протрите разъемы сначала с спиртовые салфетки.
- Прикрепить инъекционным портом третьим, неиспользуемые руку биореактора.
- Удалить моржей трубы и синий галстук с конца солевой разбавления набор как можно ближе к Y-образного перекрестка, насколько возможно. Вытяните трубку зажим в месте, чтобы убедиться в отсутствии жидкости передаче этой части трубки
- Удалить IV сумку, и приложите моржей трубки (красного цвета) для дальнего конца мешок IV. Убедитесь в том, чтобы вытереть вставки порт с алкоголем уничтожить в первую очередь.
- Прикрепить моржей в сторону потока системы (через конца трубы белый).
- Вставьте 3-полосная краном в проточной системе.
- Удалить датчик давления и подключения к трехходовым краном.
- Присоединить другой конец датчика давления до середины отверстия в сумке.
- Соединятьсябиореактор с потоком системе через Y-образного перекрестка. Используйте 60 мл шприц, чтобы добавить 350 мл 1% Fungizone (смесь 5 мл Fungizone с 495ml ФСБ), чтобы мешок IV.
- Сожмите IV сумку, чтобы смыть текущей системы, регулируя остановить краны, чтобы поток PBS. Примечание: проверить внутри биореактора чтобы у пассажиров было в случае утечки.
- Повторное приостановить 8 x10 6 ГМК (около одной сливной T75) в 1.25ml среднего и семян на каждый PGA scafffold. Убедитесь, что клеточная суспензия была равномерно капает на PGA сетки Dacron-соединения, а также на нижней стороне PGA сетки.
- Протрите край биореактор с алкоголем протрите через вращающуюся биореактор боком избежать зависания.
- Силиконовые пробки крышки сборки (рис. 2)
- Пил автоклаве рюкзак осторожно, стараясь не подвергать нижней части крышки.
- Прикрепить инъекционным портом для питания трубки на штекер.
- Прикрепить PTFE 0,20 мкм фильтры для каждого из трех портов воздуха.
- Будьте осторожны, не подвергайте / сенсорный нижней части крышки во время этого процесса.
- Парафильмом инъекционным портом.
- Вставьте крышку силиконовые пробки в стеклянные биореактор и убедитесь, что питательная трубка внутри биореактора не касается посеяны PGA лесов. Парафильмом вокруг крышки.
- Место биореактор с проточной системы внутри инкубатора (на бок) и поверните биореактор каждые 5 минут в течение 25-30 минут.
- Заполните биореактор камеры с 400 мл наших 4-10 медиакультуры, как описано в (табл. 1). Эта культура среда "оптимизированы" для свиного инженерии артерий.
6. День 6-7: Включение насоса, и первого кормления
- Расти посеян леса статически без каких-либо пульсирующей прокачивая силиконовые трубки в течение 6-7 дней. Существует не нужно для средних изменить или витамина С в это время.
- Убедитесь, что Есть нет утечки ФСБ или перегиба потока системы трубопроводов до включения насоса.
- Включите насос поток системы и убедитесь, что для регулировки насоса настройки, так что давление читает примерно 270/-30mmHg.
- Запись давление ежедневно в течение культуре и поддерживать давление в 270/-30mmHg. Датчик давления может быть подключен к компьютеру, чтобы читать и следить за давлением.
Первое кормление
- Соберите инъекционным портом и PTFE фильтр на кормление крышками для изменения среды и средних отходов deposal целей.
- Место для подачи твердо на насос и вставьте один конец к кормлению порт биореактор, а другой конец к кормления крышкой. Убедитесь в том, чтобы вытереть инъекции этанола порты с салфетками.
- Использование двойного направленного Masterflex насос для откачки 200 мл среды. Затем с помощью новой трубы для перекачки кормления 200 мл свежей среды обратно в биореактор. Всегда начинайте с очень медленной скоростью, особенно когда перекачиваемой среды обратно в биореактор.
- Изменение средних и дополнения аскорбиновой кислоты 2x/week. Для добавления аскорбиновой кислоты, использовать 30 мл шприц, чтобы вывезти 25 мл среды и поместить его в сторону в тканях капотом. Растворите 25 мг аскорбиновой кислоты в 5 мл PBS и процеживают через 0,22 мкм фильтр. Первые вводят стерильный аскорбиновой кислоты в питательную трубку и добавить обратно 25мл среду приняты ранее. Средний рецепт приведен в таблице 1.
7. Представитель Результаты:
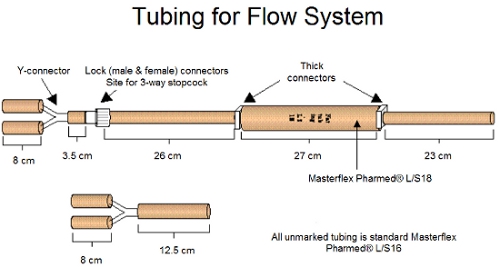
Рисунок 1. Труб и соединителей для сборки системы потока показано выше.
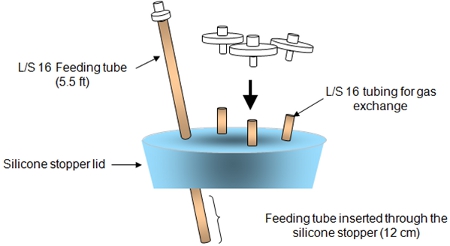
Рисунок 2. Крышка силиконовой пробкой сборка показано выше.

Рисунок 3. Схемы сборки биореактор приведены выше. Внутри манжеты биореактор Dacron крепятся на стекло оружие с синим узлов шва.

Рисунок 4. Поток связан с системой труб и биореактор показано выше. L/S18 трубка будет прокачиваться по насоса Masterflex и, таким образом, при котором поток. Датчик давления будет измерять давление перед входом в биореакторе на верхнем течении.

Рисунок 5. Изображение заготовленной инженерии судна. Engineered суда окажется непрозрачной и достичь толщины стенок около 250 мкм после 8-недельного культуры под пульсирующие условиях.
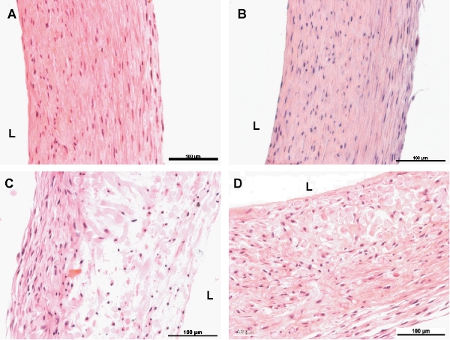
Рисунок 6. Гематоксилин-эозином окрашенных сечения инженерных судов. А и В 8-недельном непульсирующее и импульсного сосуды, соответственно.C и D. 4-недельного непульсирующее и импульсного сосуды, соответственно. L указывает сторону просвета сосудов. Бар шкал 100 мкм.

Рисунок 7. Массона Trichrome пятна для коллагена (синий) для сечений инженерных судов. А и В 8-недельном непульсирующее и импульсного сосуды, соответственно. C и D. 4-недельного непульсирующее и импульсного сосуды, соответственно. Обратите внимание, что 4-недельный импульсного судна показывает больше коллагена, чем его непульсирующее коллегой. Белые стрелки указывают на оставшиеся PGA фрагментов в судах. Бар шкал 100 мкм.
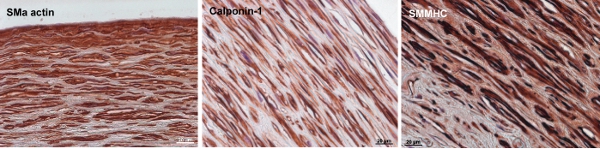
Рисунок 8. Иммунохимии окрашивание SMC маркеров в бычьей инженерии артерий. Гладкая мышца α-актин, calponin-1, а гладкие мышцы миозина тяжелой цепи (SMMHC) ранние, средние и поздние SMC сократительной маркеров, соответственно. К концу 12-недельного культуры, клеток в стенке сосуда выразить SM α-актина и умеренное количество Calponin-1 и SMMHC. Бар шкал 20 мкм.
| Компонент | Количество |
| DMEM (DME / низкая модифицированный) | 500 мл |
| FBS (эмбриональной телячьей сыворотки) тепла инактивированной | 100 мл |
| HEPES 1,0 М | 5 мл |
| Витамин С (в растворенном виде в ФБР или DMEM) | 25 мг |
| Proline / глицин / аланин 25 mg/25 мг/10 мг (растворенных в 5 мл PBS) | 5 мл |
| CuSO 4 1,5 мкг (в растворенном виде in1 мл PBS) | 1 мл |
| Пенициллин G по 10 000 ЕД / мл | 5 мл |
| PDGF-BB (тромбоцитарный фактор роста-BB) на 10ng/ml | 5 мкг |
| bFGF (основной фактор роста фибробластов) в 10ng/ml | 5 мкг |
Таблица 1. Компоненты "4-10" средний приведены в таблице выше. За исключением PDGF-BB и bFGF, все остальные компоненты должны быть фильтруется через фильтр 0,2 мкм до использования.
Обсуждение
Качество инженерных судов в значительной степени диктуется качеством ГМК использоваться в культуре ткани. Важнейшие аспекты SMC фенотип включают сократительной морфологии, низкое число проход, и способность размножаться внутри биореактора. Мы рекомендуем пассаж быть не более P3 во вре...
Раскрытие информации
Благодарности
Эта работа финансируется Национальным институтом здоровья Грант R01 EB-008 836 и R01 HL083895 (как для LEN). Мы могли бы поблагодарить Дэрил Смит, стеклодув университета, для создания биореакторов для нашего исследования.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента / Материал | Поставщик | Номер по каталогу | |
|---|---|---|---|
| FBS (эмбриональной телячьей сыворотки) Тепло-инактивированная | Hyclone | SH30071 | |
| DMEM | GIBCO | 11885 | |
| rhFGF-основные | R & B | 234-FSE | |
| rrPDGF-BB | R & B | 520-BB | |
| Penicilin G | Сигма | Пенна | |
| Медь (II) сульфат | Сигма | C8027 | |
| Gylcine | Сигма | C8790 | |
| L-аланин | Сигма | A7469-25G | |
| L-пролин | Сигма | P5607-25G | |
| Аскорбиновая кислота | Сигма | A4544-25G | |
| HEPES | Сигма | H3375-100G | |
| Силиконовая пробка | Коул-Пармер | 06298-24 | |
| Masterflex труб L / S | Коул-Пармер | 06508-16, 06508-18 | |
| Masterflex насоса | Коул-Пармер | 7553-80 | |
| Dacron манжеты | Маке | 174406 | |
| PGA чувствовал | Конкордия | MO000877-01 | |
| 4-0 1,5 метрический Surgipro II шва | Syneture | VP-557-X | |
| 6-0 0,7 метрический шва Дексон | Syneture | 7538-11 | |
| 0.22μm PTFE фильтры | Ватман | 6780-2502 | |
| Три Пути Стоп-кран | Эдвардс Lifesciences | 593WSC | |
| Датчик давления | Эдвардс Lifesciences | PX212 | |
| IV сумки | Бакстер | R4R2110 | |
| Соленая набор разбавления | Стрелка | W20030 | |
| Силиконовые трубки | Saint-Gobain | F05027 |
Ссылки
- Risau, W., Flamme, I. Vasculogenesis. Annu. Rev. Cell Dev. Biol. 11, 73-91 (1995).
- Fankhauser, F., Bebie, H., Kwasniewska, S. The Influcence of mechanical Forices and Flow Mechanisms on Vessel Occlusion. Lasers in Surgery and Medicine. 6, 530-532 (1987).
- Niklason, L. E., Gao, J., Abbott, W. M., Hirschi, K. K., Houser, S., Marini, R., Langer, R. Functional arteries grown in vitro. Science. 284, 489-493 (1999).
- Prabhakar, V., Grinstaff, M. W., Alarcon, J., Knors, C., Solan, A. K., Niklason, L. E. Engineering porcine arteries: Effects of scaffold modification. Journal of Biomedical Materials Research Part A. 67A, 303-311 (2003).
- Mitchell, S. L., Niklason, L. E. Requirements for growing tissue-engineered vascular grafts. Cardiovascular Pathology. 12, 59-64 (2003).
- Dahl, S. L. M., Rhim, C., Song, Y. C., Niklason, L. E. Mechanical properties and compositions of tissue engineered and native arteries. Annals of Biomedical Engineering. 35, 348-355 (2007).
- Quint, C., Kondo, Y., Manson, R. J., Lawson, J. H., Dardik, A., Niklason, L. E. Decellularized tissue-engineered blood vessel as an arterial conduit. Proc Natl Acad Sci U S A. 108, 9214-9219 (2011).
- Niklason, L. E., Yeh, A. T., Calle, E. A., Bai, Y., Valentín, A., Humphrey, J. D. Enabling Tools for Engineering Collagenous Tissues Integrating Bioreactors, Intravital Imaging, and Biomechanical Modeling. Proceedings of the National Academy of Sciences of the United States of America. 107, 3335-3339 (2010).
- Gong, Z., Calkins, G., Cheng, E. -. c., Krause, D., Niklason, L. E. Influence of Culture Medium on Smooth Muscle Cell Differentiation from Human Bone Marrow-Derived Mesenchymal Stem Cells. Tissue Engineering Part A. 15, 319-330 (2009).
- Gong, Z. D., Niklason, L. E. Small-diameter human vessel wall engineered from bone marrow-derived mesenchymal stem cells (hMSCs. Faseb Journal. 22, 1635-1648 (2008).
- Poh, M. Blood vessels engineered from human cells. Lancet. 365, 2122-2124 (2005).
- American Heart Association. . Biostatistical fact sheet: cardiovascular procedures. , (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены