Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
ampliPHOX Колориметрические обнаружения на ДНК-микрочипов по гриппу
В этой статье
Резюме
ampliPHOX колориметрических технологии обнаружения представлена как недорогая альтернатива флуоресценции обнаружения микрочипов. На основе фотополимеризации, ampliPHOX производит твердые пятна полимера видна невооруженным глазом в течение нескольких минут. Результаты затем отображаемого и автоматически интерпретировать с простой, но мощный пакет программного обеспечения.
Аннотация
DNA microarrays have emerged as a powerful tool for pathogen detection.1-5 For instance, many examples of the ability to type and subtype influenza virus have been demonstrated.6-11 The identification and subtyping of influenza on DNA microarrays has applications in both public health and the clinic for early detection, rapid intervention, and minimizing the impact of an influenza pandemic. Traditional fluorescence is currently the most commonly used microarray detection method. However, as microarray technology progresses towards clinical use,1 replacing expensive instrumentation with low cost detection technology exhibiting similar performance characteristics to fluorescence will make microarray assays more attractive and cost-effective.
The ampliPHOX colorimetric detection technology is intended for research applications, and has a limit of detection within one order of magnitude of traditional fluorescence11, with a main advantage being an approximate ten-fold lower instrument cost compared to the confocal microarray scanners required for fluorescence microarray detection. Another advantage is the compact size of the instrument which allows for portability and flexibility, unlike traditional fluorescence instruments. Because the polymerization technology is not as inherently linear as fluorescence detection, however, it is best suited for lower density microarray applications in which a yes/no answer for the presence of a certain sequence is desired, such as for pathogen detection arrays. Currently the maximum spot density compatible with ampliPHOX detection is ˜1800 spots/array. Because of the spot density limitations, higher density microarrays are not suitable for ampliPHOX detection.
Here, we present ampliPHOX colorimetric detection technology as a method of signal amplification on a low density microarray developed for the detection and characterization of influenza viruses (FluChip). Although this protocol uses the FluChip (a DNA microarray) as one specific application of ampliPHOX detection, any microarray incorporating biotinylated target can be labeled and detected in a similar manner. The microarray design and biotinylation of the target to be captured are the responsibility of the user. Once the biotinylated target has been captured on the array, ampliPHOX detection can be performed by first tagging the array with a streptavidin-label conjugate (ampliTAG). Upon light exposure using the ampliPHOX Reader instrument, polymerization of a monomer solution (ampliPHY) occurs only in regions containing ampliTAG-labeled targets. The polymer formed can be subsequently stained with a non-toxic solution to improve visual contrast, followed by imaging and analysis using a simple software package (ampliVIEW). The entire FluChip assay from un-extracted sample to result can be performed in about 6 hours, and the ampliPHOX detection steps described above can be completed in about 30 min.
протокол
1. Примеры усиления использованием RT-PCR
- Выделите вирусную РНК из клинического материала или вирусной изолировать использованием вирусов Qiagen MinElute Спиновые Kit в сочетании с автоматизированной QIAcube нуклеиновые кислоты платформы добычи. Экстракция выполняется на 200 мкл образца с конечного объема элюции 60 мкл. Магазин экстрактов при -70 ° С или ниже для дальнейшего использования.
- В шаблоне свободной области, подготовить RT-PCR Master Mix на льду в соответствии с протоколом производителя. Чтобы включить биотина в течение RT-PCR, используйте смесь биотинилированного дНТФ вместо производителя поставляются дНТФ смеси. Стоимость использования биотинилированного смесь дНТФ меньше, чем $ 1 USD / анализа. Альтернативные методы биотин включения, такие как использование биотинилированного грунтовка также может быть использован. Добавить грунтовки смеси при конечных концентрациях 1,0 мкМ для гриппа, 1,0 мкМ для гриппа В, и 0,14 мкМ для внутреннего контроля. Грипп грунтовки набор усиливает сегмент матрицу гена (1032 п продукт) и гриппа B набор грунтовка усиливает неструктурных генов сегмента (811 нт продукта). Каждый набор содержит FluChip грунтовки одного праймера с 5 'фосфорильной группы для облегчения поколения одноцепочечной ДНК с помощью ферментативного расщепления с лямбда экзонуклеазная следующих ПЦР. В результате одноцепочечной продукт требует гораздо меньше времени, чем гибридизации двухцепочечную эквивалента и значительно сокращает общее время анализа. Предварительно приготовленной смеси из этих праймеров, а также внутреннюю РНК шаблон управления доступны из InDevR заинтересованных научных работников на ограниченной основе.
- Кратко вихря и распределять 18 мкл мастер смеси в тонкостенных труб ПЦР.
- Передача трубок на лед, чтобы подходящее место работы для того шаблона, и добавьте 2 мкл шаблон для каждой реакции трубки.
- Передача пробирки для ПЦР в термоциклер, и выполните следующие тепловые Профиль обратной транскрипции при 50 ° С в течение 30 мин, инактивации фермента / активации при температуре 95 ° С в течение 15 мин, 40 циклов ПЦР составляет 95 ° С в течение 30 с, 55 ° С в течение 30-х и 72 ° С в течение 1 мин, а окончательное расширение при 72 ° С в течение 10 мин.
2. Гибридизация ПЦР-продукты с низкой плотностью микрочипы
- В целях получения одноцепочечной ДНК для FluChip гибридизации, готовят смесь ферментативного пищеварения, комбинируя 1,0 мкл фермента экзонуклеазная лямбда, 2,2 мкл буфера сопровождающих реакцию, и 0,8 мкл нуклеазы без воды. Эти суммы для одного образца, но может быть просто масштабируется для общего количества проб, чтобы быть переварены. Удалить образцы термоциклер и добавьте 4 мкл приготовленной смеси для каждой реакции переварить фосфорилированных прядь продукта ПЦР. Вернуться образцы термоциклер и программы термоциклер до 37 градусов по Цельсию в течение 15 минут, затем на 95 градусов по Цельсию в течение 10 минут для завершения ферментативного пищеварения и шаги тепла фрагментации.
- Пользовательских микрочипов гриппа использоваться печатаются на альдегид функционализированных слайды стекла прикладной Microarrays Inc (Темпе, штат Аризона). 5'-амино прекращено последовательности захвата в сочетании с оптимизированной кровянистые выделения буфера и напечатаны в конечной концентрации 20 мкМ (за исключением прямой последовательности управления, которая дополнительно имеет 3'-биотин модификации и выставляется в конечной концентрации 500 нМ) . Бесконтактного кровянистые выделения метод, с оптимальным диаметром пятна 300 мкм и от центра до центра шагом 700 мкм.
- Удалить из микрочипов ящик для хранения и применения одноразовых скважин гибридизации вокруг микрочипов, удалив защитный лист и нажимая твердо вокруг хорошо периметру.
- Место слайдов мыть бен содержащих 110 мл очищенной воды на 5 минут предварительно гибридизации смойте орбитальный шейкер на 60-90 оборотов в минуту. Сухой массив, слегка касаясь ткани стеклоочистителя на край колодца и позволяет воде быть злой прочь.
- Комбинат 22 мкл 2х буфера гибридизации с каждым из фрагментированных продуктов оцДНК и пипеткой 40 мкл гибридизации решений в микрочипов скважин.
- Разрешить слайды к гибридизации в закрытой камере влажности в течение 60 минут.
- Удалить слайды из камере влажности, кратко ополосните массивов с промывочного буфера D в ополосните бутылку прежде чем положить в слайд стойку. Обычно промывку объем промывочного буфера D составляет 2 мл на массив. Место слайд стойку содержащих слайды в мытье бен содержащих 110 мл промывочного буфера А. Место бен на орбитальном шейкере при 60-90 оборотов в минуту в течение 1 минуты.
- Удалить слайд стойки из промывочного буфера, кратко промыть промывочного буфера D, передача слайд стойку, чтобы бен содержащие B промывочный буфер, и пожать на 60-90 оборотов в минуту в течение 5 минут.
- Аккуратно сухой массив на каждом слайде, и место сушеные слайдов в камере влажности при подготовке шаги ampliPHOX колориметрический Detection.
3. ampliPHOX: маркировка гибридизированных и калибровку продукции чипов с ampliTAG
- Объединять 10 мкл ampliTAG, 20 мкл 2х буфера ampliTAG и 10 мкл очищенной воды для каждого массива, подлежащих обработке. Реагент объемы могут быть просто масштабируется для общего количества проб. Убедитесь в том, чтобы подготовить достаточно смеси маркировки для учета всех образцов массивы массивов и калибровки необходимо. Число калибровочных чипов необходимо зависит от того, вы выполняете полную калибровку (для нового документа или новой партии реагентов), или просто инструмент проверки. Для полной калибровки, 3 фишки калибровки, должны быть маркированы, и для реагента проверить, только один чип калибровки, должны быть маркированы. Пожалуйста, обратите внимание, что до калибровки массивы помечены, они должны пройти через предварительно гибридизации стиральной шаг, который ранее был описан для гриппа массивов.
- Передача 40 мкл этикетке смеси каждого массива и позволяют маркировки протекания реакции в закрытой камере влажности в течение 5 минут.
- Немедленно промойте массивов с промывочного буфера D в ополосните бутылку до размещения слайдов в слайд стойку. Трансфер в стойку бен содержащих 110 мл промывочного буфера C, и пожать на 60-90 оборотов в минуту в течение 5 минут.
- Использование второго бен мыть с водой очищенной, выполнить три последовательных кратких провалы водой, чтобы удалить соль остатка. Сухой массивов, слегка касаясь ткани стеклоочистителя к краю скважин.
- Микрочипы теперь правильно помечены ampliTAG, а остальная часть процедуры обнаружения ampliPHOX может быть выполнена. Фотоактивация и обработки изображений меченых массивы должны быть завершены в течение 24 часов, а также дополнительные массивы могут быть сохранены в темном поле слайда до использования.
4. ampliPHOX: калибровка, усиления сигнала и изображения
- Включите ampliPHOX читателя и обеспечить ampliVIEW программное обеспечение готово к фотоактивации.
- Определить оптимальное время фотоактивации использованием калибровочных чипов. В дополнение к кратким введением, которое следует, эта процедура также подробно описан в ручном режиме ampliPHOX. Калибровки чипы содержат ряд разведений биотинилированного последовательного управления, которые используются для оптимизации чувствительности анализа, с целью максимизации числа строк калибровки чипа, которые производят положительный сигнал, как определено программного обеспечения.
- Удалить ampliPHY от 4 ° C, позволяют нагреться до комнатной температуры, и вихрь коротко перемешать. Внесите 3 мкл ampliPHY усилитель в ampliPHY флаконе, и вихревые тщательно в течение 10 секунд.
- Равномерно передачи 40 мкл раствора в ampliPHY микрочипов и содержащие ampliTAG меченных массив, гарантирующий, что ни пузырьков присутствуют. Закройте флакон ampliPHY между каждым приложением. Вставьте слайд микрочипов в фотоактивации бухте чтения ampliPHOX.
- Для первого массива калибровку, использовать время по умолчанию фотоактивации в 'Time' окно на панели левой программного обеспечения, и нажмите кнопку "Пуск" зеленую кнопку, чтобы начать фотоактивации. После завершения удаления массива и промыть очищенную воду, чтобы удалить лишнюю ampliPHY. Открытый образования полимера на некоторых из пятна теперь должна быть доступна.
- Разрешить полимера пятна высохнуть в течение 2 минут, затем распространить две капли ampliRED на массив и позволить окрашивание проводили в течение 2 минут.
- Затем, быстро промыть микрочипов с очищенной водой и насухо протрите тканью.
- Вставьте микрочипов в визуализации бухте ampliPHOX Reader, и нажмите кнопку «New Image Capture" в закладке изображений. После отображаемого, настроить обрезать и сохранить изображение.
- В Анализ вкладки, выберите маску калибровки Чип и кнопку "Auto размещения", чтобы начать анализ. Программное обеспечение будет автоматически производить "Краткий отчет 'показывает количественные результаты. Основываясь на этих результатах, фотоактивации время корректируется на 10 секунд для второго массива калибровки, и процедура повторяется.
- Как только оптимальное время фотоактивации был определен, образец массивы могут быть обработаны с использованием тех же усиление сигнала и изображения протокол, используемый для калибровки массивов.
- После съемки изображения для выборки массивов, маски для вашего конкретного расположения массива, такие как расположение гриппа массива описаны здесь, могут быть created.The ampliVIEW программное обеспечение способно выполнять автоматизированный анализ изображений и генерации гриппа подтипов результаты для каждого образца.
5. Представитель Результаты:
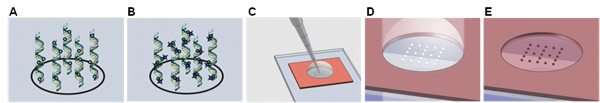
Рисунок 1. Схематическое изображение метода обнаружения ampliPHOX колориметрических. (А) Биотинилированные ДНК цель гибридизации с каждой точки в массиве, и (Б) помечены ampliTAG. (C) ampliPHY раствор затем добавил, и (D) под действием света в форме видимых пятен полимера. (Е) полимера пятна образуются впоследствии окрашиваются нетоксичных красителей для улучшения контрастности.
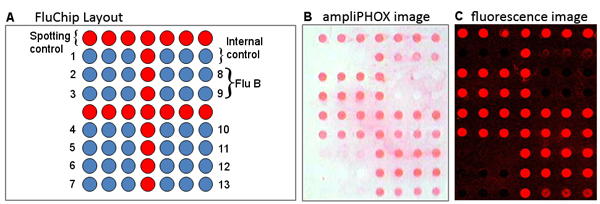
Рисунок 2. () Грипп низкой плотности расположения микрочипов. Последовательности 1-7 и 10-13 целевым грипп, и последовательностей 8, 9 целевой гриппа B. (В) ampliPHOX и (С) флуоресцентные изображения 2009 гриппа H1N1 («свиной грипп») образца показывает той же схеме обнаружения и методы.
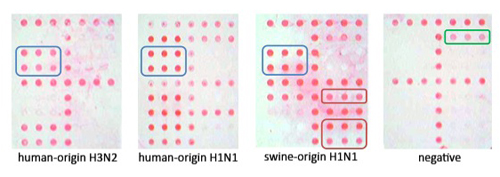
Рисунок 3. Слева направо, представитель изображений ampliPHOX гриппа H3N2, человека происхождения H1N1, 2009 гриппа H1N1 (свиного происхождения), а отрицательные образца. Все три подтипа показать визуально различимых узоров на массив. Обратите внимание на отрицательное, что только MS2 внутреннего контроля видно, что указывает на РТ-ПЦР-амплификации не была запрещена.
Обсуждение
Обнаружение ampliPHOX колориметрических технология, представленная здесь, быстрый, недорогой альтернативой один цвет флуоресценции обнаружения для нижних приложений плотность микрочипов. Схематически показано на рисунке 1, принцип обнаружения основан на использовани?...
Раскрытие информации
Благодарности
InDevR признает NIH / NIAID U01AI070276 и R43AI077112 для финансирования этой работы.
Материалы
| Name | Company | Catalog Number | Comments |
| Реагент / оборудование | Производитель | Каталог # | Комментарии |
|---|---|---|---|
| Qiagen MinElute Вирус Спиновые Kit | Qiagen | 57704 | один 60 мкл элюирования |
| QIAcube | Qiagen | 9001292 | необязательный |
| ABI 9800 Быстрый термоциклер | Applied Biosystems | 4441166 | |
| Qiagen OneStep RT-PCR комплект | Qiagen | 210210 | Комплект дНТФ не используется |
| 2x Зрительные буфера | InDevR ООО | MI-5007 | |
| Биотинилированные Mix дНТФ | InDevR ООО | МИ-5009 | |
| Lambda экзонуклеазная | Эпицентр Биотехнологии | LE032K | 2500 U, 10U/μl |
| FluChip грунтовку перемешать | InDevR | N / A | пока не доступны для продажи |
| Орбитальный Шейкер | Madell технологии | ZD-9556- | |
| Вымойте Бункеры | InDevR ООО | MI-4002 | |
| Вымойте стойки | InDevR ООО | MI-4003 | |
| 2x буфера Гибридизация | InDevR ООО | MI-5004 | |
| Калибровка Фишки | InDevR ООО | AP-5006 | |
| Вымойте Буферы н.э. | InDevR ООО | MI-5005 | |
| ampliRED | InDevR ООО | AP-5004 | |
| ampliTAG | InDevR ООО | AP-5001 | |
| 2x ampliTAG буфера | InDevR ООО | AP-5002 | |
| ampliPHY, ampliPHY усилитель | InDevR ООО | AP-5003 |
Ссылки
- Kumar, R. M. The Widely Used Diagnostics "DNA-Microarray"-A Review. Amer J Inf Dis. 5, 207-218 (2009).
- Miller, M. B., Tang, Y. W. Basic Concepts of Microarrays and Potential Applications in Clinical Microbiology. Clin Microbiol Rev. 22, 611-633 (2009).
- Mikhailovich, V., Gryadunov, D., Kolchinsky, A., Makarov, A. A., Zasedatelev, A. DNA microarrays in the clinic: infectious diseases. BioEssays. 30, 673-682 (2008).
- Call, D. R. Challenges and opportunities for pathogen detection using DNA microarrays. Crit Rev Microbiol. 31, 91-99 (2005).
- Raoult, D., Fournier, P. E., Drancourt, M. What does the future hold for clinical microbiology. Nat Rev Microbiol. 2, 151-159 (2004).
- Dawson, E. D., Rowlen, K. L., Wang, Q., Tao, Y. J. MChip: A Single Gene Diagnostic for Influenza A. Influenza: Molecular Virology. , (2010).
- Gall, A., Hoffman, B., Harder, T., Grund, C., Ehricht, R., Beer, M. Rapid hemagglutinin subtyping and pathotyping of avian influenza viruses by a DNA microarray. J Virol Meth. 160, 200-205 (2009).
- Townsend, M. B., Dawson, E. D., Mehlmann, M., Smagala, J. A., Dankbar, D. M., Moore, C. L., Smith, C. B., Cox, N. J. FluChip: Experimental evaluation of a diagnostic influenza microarray. J Clin Microbiol. 44, 2863-2871 (2006).
- Wang, Z., Daum, L. T., Vora, G. J., Metzgar, D., Walter, E. A., Canas, L. C., Malanosky, A. P., Lin, B., Stenger, D. A. Identifying influenza viruses with resequencing arrays. Emerg Inf Dis. 12, 638-646 (2006).
- Kessler, N., Ferraris, O., Palmer, K., Marsh, W., Steel, A. Use of the DNA Flow-Thru Chip, a three-dimensional biochip, for typing and subtyping of influenza viruses. J Clin Microbiol. 42, 2173-2185 (2004).
- Kuck, L. R., Taylor, A. W. Photopolymerization as an innovative detection technique for low-density microarrays. Biotechniques. 45, 179-186 (2008).
- Avens, H. J., Bowman, C. N. Development of fluorescent polymerization-based signal amplification for sensitive and non-enzymatic biodetection in antibody arrays. Acta Biomat. 6, 83-89 (2010).
- Sikes, H. D., Jenison, R., Bowman, C. N. Antigen detection using polymerization-based amplification. Lab on a Chip. 9, 653-656 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены