Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Фотообесцвечивания Анализы (FRAP и FLIP), чтобы измерить хроматина Динамика белков в живых эмбриональных стволовых клеток
В этой статье
Резюме
Мы опишем методы, включая фотообесцвечивания флуоресценции Восстановление после фотообесцвечивания (FRAP) и флуоресценции Потеря В фотообесцвечивания (FLIP) для контроля динамики хроматина белка в эмбриональных стволовых (ЭС) клеток. Хроматин динамики белков, который считается одним из средств для изучения хроматина пластичность, усиливается в плюрипотентные клетки.
Аннотация
Флуоресценция Восстановление после фотообесцвечивания (FRAP) и флуоресценции Потеря В фотообесцвечивания (FLIP) позволяют изучения динамики белков в живых клетках с хорошим пространственным и временным разрешением. Здесь мы опишем, как выполнять FRAP и FLIP анализов хроматина белки, в том числе H1 и HP1, в мышиных эмбриональных стволовых (ЭС) клеток. В FRAP эксперимента клетки трансфицированных, либо временно или стабильно, с белок сливается с зеленого флуоресцентного белка (GFP) или их производных (YFP, CFP, вишня и т.д.). В трансфекции, флуоресцирующие клетки, интенсивные сфокусированного лазерного луча отбеливатели относительно небольшой области интереса (ROI). Длины волны лазера выбирается в соответствии с флуоресцентный белок используется для синтеза. Лазерного света необратимо отбеливатели флуоресцентный сигнал молекул в рентабельности инвестиций и, сразу же после отбеливания, восстановления флуоресцентного сигнала в беленой площадь - опосредовано замены беленой молекул с небеленой молекул - это контролируется с помощью изображений промежуток времени. Созданный флуоресценции кривые восстановления предоставить информацию о подвижности белка. Если флуоресцентные молекулы неподвижны, не флуоресценции восстановление будет наблюдаться. В дополнительный подход, флуоресцентная Потери в фотообесцвечивания (FLIP), лазерный луч отбеливатели же месте неоднократно и интенсивность сигнала измеряется в других флуоресцирующих клеток. FLIP экспериментов поэтому мера сигнал распада, а не восстановление флуоресценции и полезны для определения белка мобильность, а также белка курсируя между сотовой отсеков. Переходные обязательным является общим свойством хроматина белков, связанных с. Хотя основной доли каждого белка хроматина связана с хроматина в любой момент времени в равновесном состоянии, обязательным является временным, и большинство хроматина белки имеют высокий оборот по хроматина, с временем пребывания в порядке секунд. Эти свойства имеют решающее значение для получения высокой пластичностью в экспрессии генома 1. Фотообесцвечивания эксперименты поэтому особенно полезен для определения хроматина пластичность использования GFP-фьюжн версии хроматина структурных белков, особенно в ЭС клетки, где динамический обмен белков хроматина (в том числе гетерохроматин белок 1 (HP1), компоновщик гистона H1 и основные гистонов) выше, чем в дифференцированных клетках 2,3.
протокол
1. Покрытие ЭС клетки
Т = 0 часов
MEF покрытием
- Пальто жить изображений 8-и μ-Слайды (ibidi, Мюнхен, Германия) с желатином или в патрон покровные стекла (Lab-Tek, Рочестер, штат Нью-Йорк) или стеклянным дном блюда культуры (Маттек; Ashland, MA). Оставьте на 5-30 минут и аспирации от свободных желатин.
- Семенной 22000 MEFs / лунку в 250 мкл общем объеме DMEM [с добавлением 10% эмбриональной телячьей сыворотки (FBS)]. Разрешить клетки расти в культуре ткани инкубатор (37 ° С, 5% СО2).
Т = 6 часов
ЭСК покрытием
- Аспирируйте DMEM.
- Семенной каждого MEF покрытием хорошо с 15000 R1 клеток / лунку в 250 мкл общего объема средств массовой информации ES клетки [с добавлением 10% ESC-класса эмбриональной телячьей сыворотки (FBS), 1 мМ пирувата натрия, 0,1 мМ заменимых аминокислот, 0,1 мМ β- меркаптоэтанол и 1000 ед / мл фактором подавления лейкоза (LIF)], чтобы получить 30% до 50% слияния следующий день.
2. Трансфекции ЭС клетки
Т = 24 часов
Переходные трансфекции
- Замените СМИ ЭСК с 250 мкл / лунку свежий СМИ ячейки ES.
- В 1,5-мл стерильную пробирку, добавьте 100 мкл сыворотки свободных средств массовой информации [Opti-MEM (Gibco)], а затем добавить 10 мкл Транзит-LT1 трансфекции реагента (Mirus) непосредственно в сыворотке свободных средств массовой информации. Смешать, осторожно пипеткой и инкубировать при комнатной температуре в течение 5-20 мин.
- Добавить 1,5 мкг GFP слияния ДНК плазмиды (H1e, H1o или HP1) для разбавленных транзитного LT1 реагента. Смешать, осторожно пипеткой и инкубировать при комнатной температуре в течение 15-30 мин.
- Добавить 13,5 мкл / лунку трансфекции смеси. Swirl 8-и μ-слайды для обеспечения равномерного рассеивания. После 24 часов заменить старые СМИ ячейки ES с 250 мкл свежей среды ячейки ES.
3. Выполнение FRAP и FLIP
Т = 48-72 часов
- Эксперимент может быть выполнена на любом конфокальной лазерной сканирующей микроскопии (CLSM), но так как в нормальных FRAP / FLIP эксперимент, многие последовательных изображений приобретаются, то рекомендуется использовать вращающийся диск конфокальной микроскопии, которая позволяет приобретение скорость и гарантирует, что ни нежелательный пример отбеливания происходит после первоначального преднамеренное обесцвечивания. Здесь, мы рекомендуем использовать революции вращающийся диск конфокальной системы (www.Andor.com), с Yokogawa ХСС-X головы диск вращается. Эта система имеет двойную способность photobleach использованием специализированного модуля FRAPPA с точки сканирования системы, и быстро переключаться свет обратно собирать изображения с помощью вращающегося диска. 3 наиболее распространенных флуоресцирующих белков для фотообесцвечивания эксперименты GFP, YFP и Черри. Если GFP или YFP используются, ~ 488 нм лазер не требуется. Для вишни, используйте ~ 560 нм лазер. Во всех случаях, мы рекомендуем использовать твердотельные лазеры. Наличие автоматизированной этапе полезно, но не требуется. Так как живые клетки изображаются, важно использовать экологической палаты (мы используем одну из LIS, Швейцария), контроль кислорода, влажности, CO 2 и температуры. FRAP осуществляется с использованием максимальной интенсивности лазерного излучения в то время как изображения осуществляется с минимальными мощность лазера требуется (обычно в районе 10%, если уровень флуоресценции достаточно).
Соблюдайте клеток с флуоресцентным светом соответствующей длины волны и выберите ячейку выражения GFP использованием 60X объектив погружения масла. Обеспечить правильное субклеточных распределения. Иногда, когда уровни экспрессии являются слишком высокими, локализация белка может "разлива", чтобы другие отсеки, такие как ядрышко. Такие клетки не должны быть выбраны. - Теперь установите протокол изображений: собрать 3-5 кадров перед фотообесцвечивания, то photobleach на эухроматин или гетерохроматин (рассматриваются как конденсированные GFP очагов) и собрать 90-120 кадров после photobleach, с интервалом 250-1000 мс: H1e-GFP, 1000 мс, H1o и HP1-GFP, 250 мс (изменение интервала времени в соответствии с динамики белков, где очень динамичной белков требуется более короткий промежуток времени). Мы обычно используем 80-100% интенсивности лазерного излучения для фотообесцвечивания с лазерным импульсом 20-40 μseconds (1-2 итераций), но эти цифры могут меняться в зависимости от анализируемого белка и уровни экспрессии. Когда фотообесцвечивания не подходит, вы должны соблюдать "черная дыра" в вашем GFP флуоресценции. Черная дыра постепенно повторно заполнен флуоресценции после выздоровления. Хотя вращающийся диск может получить примерно до 60 изображений в секунду (при хорошей интенсивности флуоресценции и при увеличении на одну ячейку), мы не рекомендуем использовать системы на таких высоких скоростях из-за низкого качества изображения и потенциал увеличился фототоксичности.
- Для FLIP эксперимент, создать другой протокол изображений: собрать 3-5 кадров перед отбеливанием, а затем начните повторять отбеливание на том же месте в то время как сбор изображений. Для H1e-GFP, отбеливатель каждые 5 сек, для H1o-GFP, отбеливатель каждые 2 секунды, а для HP1-GFP отбеливателя каждые 1 сек. Bleachг собирать фотографии неоднократно на протяжении всего эксперимента.
- Для любой техники, повторите этот процесс на 20-30 клеток. Для статистических целей повторить эксперимент в 3 раза или более, предпочтительно в разные дни. В однородное население и правильные настройки, стандартное отклонение, как правило, низкое (<5%).
Для обоих FRAP и FLIP, размер и форму беленой региона влияет на восстановление динамики и должно оставаться постоянным в течение эксперимента. Кроме того, когда две клетки сравниваются, идентичные протоколы должны быть использованы и клетки должны быть проанализированы последовательно в тот же день, как мощность лазера и других условий может изменяться, и могут повлиять на исход эксперимента.
4. FRAP и FLIP анализа данных
- Во всех FRAP кадров собраны, измерять интенсивность флуоресценции в ROI (возврат инвестиций Ь = беленой район), области фона (ROI BG), и небеленый в ядерной области (ROI NB) в зависимости от времени до и после отбеливания. Когда отбеленная регионе незначительно всего ядра могут быть выбраны для нормализации целей.
- Для каждого момента времени, нормализовать данные в соответствии с формулой: (ROI б - ROI BG) / (ROI NB - ROI BG) / (pbROI б - pbROI BG) / (pbROI NB - pbROI BG), Pb означает предварительно осветленный. Для предварительной отбеливателя изображения, которые вы должны получить сумму около 1. Первое изображение после отбеливания будет указывать Bleach глубины. Вычтите значение от 1 для фактического значения Глубина Bleach. Повторите эти действия для каждой клетки и среднем 20-30 клетки от каждого эксперимента.
- Во всех FLIP кадров собраны, измерять интенсивность флуоресценции в небеленый в ядерной области, и области фона (ROI = пЬ небеленый области, ROI BG = фоне). Расчет FLIP данных похожа на FRAP кривой, только анализ окупаемости инвестиций (ROI NB) должен быть иным, чем фактические беленой региона, который не используется для расчета: (ROI NB - ROI BG) / (pbROI NB - pbROI BG) . Кроме того, можно использовать соседней камере (ROI п = соседней клетки) для нормализации целей: (ROI NB - ROI BG) / (ROI га - ROI BG) / (pbROI NB - pbROI BG) / (pbROI га - pbROI BG ).
После сбора данных, можно в соответствии с экспериментальными данными компьютерного моделирования. Это позволяет рассчитывать, с хорошей близости, мобильные фракции, фракции и неподвижные полувысоте. Мы не будем обсуждать математические и статистические аспекты FRAP анализ здесь и отсылаем читателя к другим превосходным публикаций 4-9. Отбеливатель глубина ссылается на расстоянии (по оси ординат) между заранее отбеливателя (100%) сигнал и первое изображение после отбеливания; мобильные фракция относится к расстоянию (по оси ординат) между глубиной и отбеливатель восстановленный сигнал, когда кинетика выходит на плато, и неподвижные фракция относится к расстоянию (по оси ординат) между восстановления сигнала и заранее отбеливателя (100%) сигнала (см. рис 1В и 2В). Помимо этого анализа, Есть хорошие математические модели в соответствии с данными. Для одного показателя, то уравнение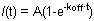
где Т-время является мобильная часть, 1-А является неподвижным фракции и к выключение константа диссоциации, могут быть использованы в соответствии с данными, и прямую оценку от скорости связывания (к выключено) может быть получены, а также для параметров, которые могут быть использованы для расчета скорости ассоциации.
5. Представитель Результаты:
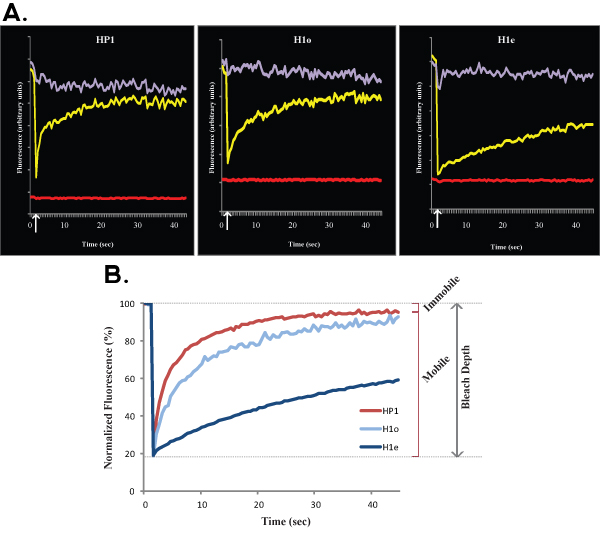
Рисунок 1. А и В показывают, представитель FRAP кривые HP1 (слева), H1o (в центре) и H1e (справа) в R1 ЭС клеток. Для Рис простотой и ясностью показывает, 1A необработанные данные из одной клетки до того, нормирование и расчет. Желтая кривая соответствует беленой регион, пурпурный кривая соответствует небеленый в ядерной области (когда беленой регионе незначительно всего ядра могут быть выбраны для нормализации целей), а красная линия соответствует фоновой флуоресценции, которая минимальной в этом случае. Вертикальная стрелка представляет отбеливателя времени. Нормализованная и усредненные данные показано на рисунке 1b. Обратите внимание на медленное восстановление H1 (синий) по сравнению с HP1 (красный). Также H1e вариант (темно-синий) происходит медленнее, чем вариант H1o (светло-голубой). Подвижные и неподвижные фракций и Bleach Глубина указаны для HP1.
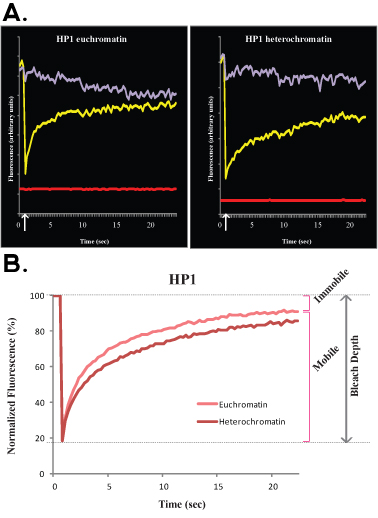
Рисунок 2. А и В показывают, представитель FRAP кривые сравнения эухроматин (слева) с гетерохроматин (справа) HP1 в клетках R1 ES. Как и в рисунке 1, Рисунок 2А показывает необработанные данные из одной ячейки, желтая кривая соответствует беленой регион, пурпурный кривая соответствует небеленый в ядерной области, и красная линия соответствует фоновой флуоресценции. Вертикальная стрелка представляет отбеливателя времени. Нормализованная и усредненные данные показан на рисунке 2Б. Обратите внимание на медленное восстановление гетерохроматина (темно-красный) по сравнению с эухроматин (светло-красный). Подвижные и неподвижные фракций и Bleach Глубина указаны для эухроматин.
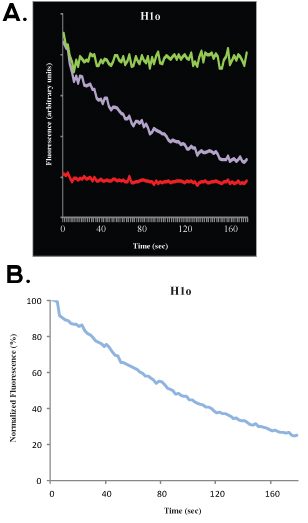
Рисунок 3.. Типичный FLIP эксперимент H1o R1 ЭС клетки показана на рисунке 3А (сырье, не-нормированный данных) и B (нормированный и усредненные данные). В этом эксперименте фиолетовый кривой соответствует небеленый в ядерной области, зеленая линия соответствует соседнего ядра клетки и красная линия соответствует фоновой флуоресценции.
Обсуждение
В отличие от большинства имеющихся методов, которые включают очищенный от хроматина клеточных популяций или фиксированные клетки, FRAP экспериментов следить за изменениями в динамике хроматина белков в живых клетках. Мы обнаружили, динамика хроматина белки быть хорошим индикатором дл?...
Раскрытие информации
Благодарности
Мы благодарим членов Meshorer лаборатории, особенно Шай Melcer, Ади Alajem, Edupuganti Рагху Рам, Шри-Бади Sailaja, Анна Mattout и Альва Биран, за критические замечания и для устранения неисправностей фотообесцвечивания эксперименты на ежедневной основе. ЭМ Джозеф Х. и Belle Р. Браун старший преподаватель естественных наук и при поддержке Израиля научного фонда (ISF 943/09), министерства здравоохранения Израиля (6007) Европейский Союз (IRG-206872 и 238176), Израиль онкологический научный фонд, внутренних прикладной медицинской Гранты Еврейского университета и Израильского института психобиологического.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | |
|---|---|---|---|
| DMEM | Сигма | D5671 | |
| Желатин | Merck | 1,04078 | |
| Opti-MEM | Гибко | 31985 | |
| Транзит-LT1 | Mirus | MIR2300 | |
| 8-и μ-слайды | ibidi | 80826 |
Ссылки
- Phair, R. D. Global nature of dynamic protein-chromatin interactions in vivo: three-dimensional genome scanning and dynamic interaction networks of chromatin proteins. Mol Cell Biol. 24, 6393-6402 (2004).
- Meshorer, E., Girard, L. . Imaging chromatin in embyonic stem cells in StemBook. , (2008).
- Meshorer, E. Hyperdynamic plasticity of chromatin proteins in pluripotent embryonic stem cells. Dev Cell. 10, 105-116 (2006).
- Bancaud, A., Huet, S., Rabut, G., Ellenberg, J. . Fluorescence perturbation techniques to study mobility and molecular dynamics of proteins in live cells: FRAP, photoactivation, photo conversion, and FLIP. , (2009).
- Dundr, M., Misteli, T. Measuring dynamics of nuclear proteins by photobleaching. Curr Protoc Cell Biol. Chapter 13, Unit 13-Unit 13 (2003).
- Ellenberg, J. Nuclear membrane dynamics and reassembly in living cells: targeting of an inner nuclear membrane protein in interphase and mitosis. J Cell Biol. 138, 1193-1206 (1997).
- Lenser, T., Weisshart, K., Ulbricht, T., Klement, K., Hemmerich, P. Fluorescence fluctuation microscopy to reveal 3D architecture and function in the cell nucleus. Methods Cell Biol. 98, 2-33 (2010).
- Mueller, F., Mazza, D., Stasevich, T. J., McNally, J. G. FRAP and kinetic modeling in the analysis of nuclear protein dynamics: what do we really know. Curr Opin Cell Biol. 22, 403-411 (2010).
- Phair, R. D., Misteli, T. Kinetic modelling approaches to in vivo imaging. Nat Rev Mol Cell Biol. 2, 898-907 (2001).
- Poser, I. BAC TransgeneOmics: a high-throughput method for exploration of protein function in mammals. Nat Methods. 5, 409-415 (2008).
- Sigal, A. Generation of a fluorescently labeled endogenous protein library in living human cells. Nat Protoc. 2, 1515-1527 (2007).
- Cohen, A. A. Dynamic proteomics of individual cancer cells in response to a drug. Science. 322, 1511-1516 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены