Method Article
Определение Митохондриальная мембранного потенциала и активных форм кислорода в Живом Крыса корковых нейронов
В этой статье
Резюме
Мы демонстрируем применение флуоресценции индикатора, TMRM, в корковых нейронов, чтобы определить относительные изменения TMRM интенсивности флуоресценции до и после применения конкретных стимулов. Мы также показываем применения флуоресценции зонда Н 2 DCF-DA для оценки относительного уровня активных форм кислорода в корковых нейронов.
Аннотация
Митохондриальная мембранного потенциала (ΔΨm) имеет решающее значение для поддержания физиологических функций дыхательной цепи для генерации АТФ. Значительные потери ΔΨm оказывает клетки обедненного энергии с последующей смерти. Активные формы кислорода (АФК) играют важную роль сигнальных молекул, но и их накопление в патологических условиях приводит к окислительному стрессу. Два основных источника АФК в клетках являются экологические токсины и процесс окислительного фосфорилирования. Митохондриальной дисфункции и окислительного стресса были замешаны в патофизиологии многих заболеваний, поэтому способность определять ΔΨm и ROS могут предоставить важную информацию о физиологического состояния клетки и функции митохондрий.
Несколько флуоресцентных зондов (родамина 123, TMRM, TMRE, JC-1) может быть использована для определения Δψm в различные типы клеток, и многие флуоресценции показателей (Dihydroethidium, Dihydrorhodamine 123, H 2 DCF-DA), могут быть использованы для определения ROS . Почти все доступные зондов флуоресценции используется для оценки ΔΨm или ROS являются одной длине волны показателей, увеличение или уменьшение их интенсивности флуоресценции пропорциональна стимул, который увеличивает или уменьшает уровни ΔΨm или АФК. Таким образом, крайне важно для измерения интенсивности флуоресценции этих зондов на базовом уровне и после применения конкретных стимулов. Это позволяет определить процент изменения интенсивности флуоресценции от базового уровня и стимул. Это изменение в интенсивности флуоресценции отражает изменение относительных уровней ΔΨm или АФК. В этом видео показано, как применять флуоресценции индикатора, TMRM, у крысы корковых нейронов, чтобы определить процентное изменение TMRM интенсивности флуоресценции от базового уровня, и после применения FCCP, митохондриальная разобщающий агент. Более низкие уровни TMRM флуоресценции в результате лечения FCCP отражает деполяризацию митохондриального потенциала мембраны. Мы также показываем, как применять флуоресценции зонда H 2 DCF-DA оценить уровень АФК в корковых нейронов, во-первых в начале исследования, а затем после применения H 2 O 2. Этот протокол (с незначительными изменениями) может быть также использована для определения изменений в ΔΨm и АФК в различных типах клеток и нейронов, изолированы от других участков мозга.
протокол
1. Клеточные культуры
- Корковые нейроны выделяют и выращивают, используя ранее описанные методы и высевают на культуру блюд с прозрачным дном (Маттек Corporation, Ashland, штат Массачусетс) с покрытием из поли-D-лизина и ламинин 1.
2. Подготовка фондовых решений для флуоресцентных зондов TMRM и Н 2 DCF-DA
- Подготовка 10-мм исходного раствора TMRM путем растворения 5,0 мг TMRM в 1 мл безводного диметилсульфоксида. Vortex он в течение 1 мин. Затем, чтобы аликвоты и хранить их при температуре -20 ° C, защищать от света, и использовать в течение одного месяца.
- Далее, подготовить 10-мм исходного раствора H 2 DCF-DA, растворив 4,87 мг H 2 DCF-DA в 1 мл безводного ДМСО. Точно так же вихря в течение 1 мин. Затем, чтобы аликвоты и хранить их при температуре -20 ° C, защищать от света, и использовать в течение одной недели.
3. Загрузка корковых нейронов крысы с TMRM и Н 2 DCF-DA
TMRM является потенциометрического, сотовые проницаемой флуоресцентный индикатор, который накапливается в очень отрицательно заряженных интерьера митохондрий. Важно использовать низкие концентрации (10-50 нм) из TMRM, чтобы избежать автоматического тушения митохондриальной TMRM. Затем, сигнал флуоресценции от TMRM могут быть непосредственно совместно, связанных с ΔΨm через внутреннюю мембрану митохондрий. Потеря ΔΨm причины TMRM течь из митохондрий приводит к потере интенсивности флуоресценции. H 2 DCF-DA является клетка-проницаемой зонда преобразуется в DCF-DA внутриклеточными эстераз и его окисление приводит к флуоресцентным DCF. Конечная концентрация H 2 DCF-DA составляет от 2-10 мкм, и это должно быть проверено эмпирически в нейронах, полученных из различных областей мозга, так как высокие концентрации загрузки могут привести к насыщению DCF флуоресценции даже в отсутствие H 2 O 2. Наличие каких-либо эндогенных или экзогенных окислитель (например, оксид азота, перекиси водорода) увеличит DFC интенсивности флуоресценции. Ниже мы приведем протокол для загрузки корковых нейронов крысы с TMRM и Н 2 DCF-DA.
- Чтобы загрузить крысы корковых нейронов с TMRM, во-первых, мыть культурный нейронов 3 раза буфером Тирода (наложение текста: TB: 145 мМ NaCl, 5 мМ KCl, 10 мМ глюкозы, 1,5 мМ CaCl 2, 1 мМ MgCl 2 и 10 мМ HEPES; регулировать рН до 7,4 с NaOH). Затем, подготовить 20 нМ TMRM путем разбавления 10 мМ TMRM складе 1 / 1000 раз в борьбе с туберкулезом, а затем добавляют 2 мкл разведенной TMRM на 1 мл ТБ. Инкубируйте нейронов с TMRM в течение 45 минут в темном месте при комнатной температуре. Через 45 мин, крепление культуры блюдо на столик микроскопа и начать съемки.
- Чтобы загрузить корковых нейронов крысы с H 2 DCF-DA, мыть культурный нейронов 3 раза с туберкулезом. Далее, подготовить 2 мкМ H 2 DCF-DA путем разбавления 10 мМ H 2 DCF-DA складе 1 / 10 раз в борьбе с туберкулезом, а затем добавляют 2 мкл разбавленной H 2 DCF-DA на 1 мл ТБ. Затем, инкубировать нейронов с H 2 DCF-DA в течение 45 мин в темноте при комнатной температуре. После 45 минут, смойте нейронов в 4 раза с туберкулезом, чтобы удалить лишнюю флуоресцентного индикатора до получения изображения.
4. Живая изображений нейронов инкубировали с TMRM определить ΔΨm
- Для выполнения жить изображений нейронов инкубировали с TMRM, конфокальной микроскопии лазерного сканирования (наложение текста: LSM 510, объективом Carl Zeiss Inc), с применением жить временных рядов программы, используется. Применять с низким разрешением и ослабленных мощности лазера (наложение текста: низкое разрешение: 256 х 256; мощность лазера: 1%), чтобы минимизировать время, необходимое для получения изображения и избежать фотообесцвечивания.
- . Далее, настроить фокус установлен нейронов загружены TMRM использовании отраженного света. Изучить TMRM флуоресценции при освещении в 514 нм и обнаружение при 570 нм. Установить обнаружения усиления камеры чуть ниже уровня насыщения.
- После того как все параметры, которые включают разрешение, мощность лазера, обнаружение усиления камеры, и покадровой интервал для получения изображения устанавливаются; не изменять эти параметры между экспериментами. Затем измените поле. Начните собирать изображения.
- Чтобы проверить изменения в ΔΨm, стимулы, такие как 1 мкМ FCCP или 2 мкг / мл олигомицину, может быть применена, что позволит существенно деполяризовать или hyperpolarize митохондриального мембранного потенциала, соответственно. Эти изменения будут отражены на снижение TMRM интенсивности флуоресценции по сравнению с базовым уровнем интенсивности флуоресценции в случае FCCP, или увеличение TMRM интенсивности флуоресценции в случае олигомицину.
5. Живая изображений нейронов инкубировали с H 2 DCF-DA, чтобы определить ROS
- Для выполнения жить изображений нейронов инкубировали с H 2 DCF-DA, во-первых, крепление культуры блюдо на стадии микроскоп. Настройте фокус клетки намиING отраженного света. Изучить DCF флуоресценции при возбуждении на 488 нм и эмиссии при 515 нм.
- Далее, регулировать мощность лазера до 5-7%, детектор усиления, и разрешение 256 х 256. Не меняйте эти настройки между экспериментами. Затем установите частоту для получения изображения в реальном времени с помощью программы временных рядов.
- Выберите новое поле и начать приобретения изображений. Чтобы обнаружить изменения уровня АФК, лечить клетками с 100-200 мкМ H 2 O 2. Это отразится на увеличении DCF интенсивности флуоресценции по сравнению с исходным уровнем.
6. Анализ данных
- Используйте область интереса (наложение текста: ROI) инструмент из LSM программа для выбора областей. Затем, измерьте TMRM или ROS интенсивности флуоресценции. Выберите трансформирования из митохондриальных регионов или трансформирования со всего тела ячейки в отображаемого клетки для измерения интенсивности флуоресценции от TMRM или ROS, соответственно.
- Рассчитать средние интенсивности флуоресценции от всех трансформирования каждой ячейки для TMRM или из цельных органов ячейки для всех отображаемого клеток для АФК для каждого момента времени. Выбор регионов рядом с клетками для расчета интенсивности фона флуоресценции. Сделайте несколько измерений и расчета средней интенсивности фона.
- Вычтите средней интенсивности флуоресценции фон от средней интенсивности флуоресценции от трансформирования в каждой ячейке для каждой временной точке использованием Microsoft Excel. После вычитания фона интенсивности, нормализуют TMRM или DCF интенсивности флуоресценции с базовым флуоресценции с помощью этой формулы (наложение текста: ΔF = FF о / Р о х 100, где F = интенсивности флуоресценции в любой момент времени, для = базовый флуоресценции). Затем с помощью программы Sigma участок для создания график, показывающий изменения в интенсивности флуоресценции с течением времени.
7. Представитель Результаты
Рисунок 1А показывает флуоресценции изображение крысы корковые нейроны инкубировали с TMRM. Добавление FCCP, митохондриальная разобщающий агент, приводит к митохондриальной деполяризации и потери TMRM интенсивности флуоресценции (рис. 1В). Флуоресценции базовой TMRM уровень остается стабильным перед добавлением FCCP (первые 350 сек;. Рис 1С). Количественный анализ TMRM флуоресценции изменения с течением времени показывает значительное снижение флуоресценции TMRM после добавления FCCP (рис. 1в).
Рис. 1D показывает флуоресценции изображение крысы нейроны коры загружены DCF. Добавление H 2 O 2 приводит к увеличению интенсивности флуоресценции DCF в клеточных тел (рис. 1E). Базовые DCF уровень флуоресценции остается неизменным (первые 120 сек) перед нанесением H 2 O 2. Покадровый измерения флуоресценции DCF показать его устойчивые уровни, которые повышают после H 2 O 2 лечения (рис. 1е).
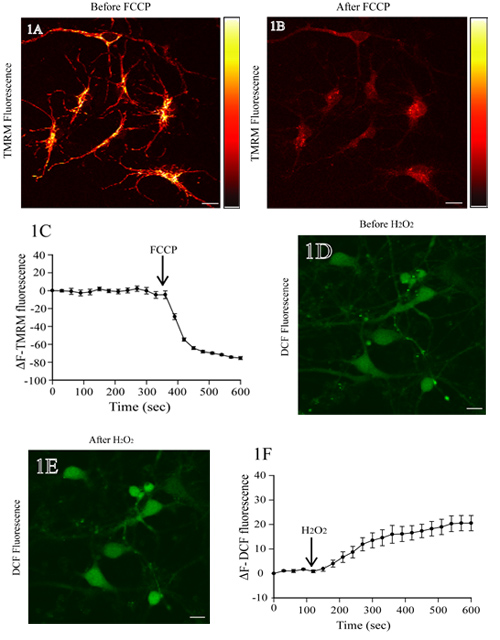
Рисунок 1. Оценка митохондриального мембранного потенциала и уровня АФК в живых крысы корковые нейроны. () Представитель флуоресценции образ нейронов коры загружены TMRM. После сканирования базовой TMRM флуоресценции, нейроны лечили protonophore FCCP (1 мкМ). Справа псевдо-бар интенсивность флуоресценции TMRM с ярко-желтыми и черными представляющих максимальной и минимальной интенсивности, соответственно. Потери флуоресценции TMRM от митохондриальной регионов показывает крах ΔΨm на FCCP лечения (группа В). Количественное представление изменения TMRM интенсивности флуоресценции в различные моменты времени до и после лечения FCCP показан в панели C (D) флуоресценции изображение крысы корковые нейроны загружены H2DCF-DA. После определения базовых DCF флуоресценции, клетки обрабатывали 200 мкМ H 2 O 2, а также изменение флуоресценции DCF был оценен. Увеличение DCF флуоресценции отражает повышение уровня АФК при H 2 O 2 лечения (E). Количественный анализ изменения флуоресценции DCF, до и после H 2 O 2 лечения, показана на панели бар Ф. Масштаб = 10 мкм
Video.7.1 - labmedia 2704_Joshi.avi
Живая клетка изображений TMRM в нейроны коры до и после того FCCP использованием 40X цели. Интенсивность псевдо показывает максимум (ярко-желтого, до того FCCP) и снизились (красный цвет, после того FCCP) TMRM интенсивность флуоресценции после того FCCP. Щелкните здесь для просмотра видео
Видео. 7,5 - labmedia 2704_Joshi.avi
Живая клетка изображений DCF в нейроны коры до и после H 2 O 2 Помимо использования 40X цели. Базовые DCF флуоресценции светло-зеленого цвета в клеточных тел и Н2О2 того увеличивает DCF интенсивности флуоресценции в ярко-зеленый цвет. Щелкните здесь для просмотра видео
Обсуждение
Мы представили шаг за шагом описывающие процедуры, как определить, ΔΨm и АФК крыс нейроны коры использованием флуоресцентных индикаторов TMRM и Н 2 DCF-DA, соответственно. Для других типов клеток, важно, чтобы эмпирически определить конечную концентрацию и время загрузки для TMRM или H 2 DCF-DA. В общем, TMRM диапазоне концентраций от 20-200 нм, а время клетка инкубации с TMRM колеблется от 20 до 60 мин. Конечная концентрация H 2 DCF-DA составляет от 2-10 мкм, а инкубации клеток в растворе, содержащем загрузку этот показатель колеблется от 30-45 мин.
Очень важно для оптимизации мощности лазера и скорость сканирования взятия изображения, чтобы избежать как фото-токсичности для клеток и изменения в интенсивности флуоресценции (например мерцание TMRM флуоресценции) в отсутствие какого-либо стимула. Оптимизированные оптические параметры должны приводить к флуоресценции, не больше или меньше насыщенных (порог) в отсутствии стимула. Оптимальных условий для сбора изображений из выбранного поля в частности мощности лазера и скорость сканирования достигаются тогда, когда Есть никаких изменений в интенсивности флуоресценции зонда в отсутствие какого-либо стимула в течение 10-15 минут живого изображения.
Другие флуоресценции зондов для определения ΔΨm включают родамина 123 и тетра метил родамина этиловый эфир (TMRE). Тем не менее, они были найдены ингибировать дыхательные процессы в изолированных митохондриях 2. Важно отметить, что TMRM не оказывает влияния на дыхание митохондрий при низких концентрациях 2 и имеет низкую фототоксичности и фотообесцвечивания 3 по сравнению с другими датчиками. H 2 DCF-DA является хорошим показателем для АФК, как он хорошо сохраняется в клетках и распознает несколько видов окислителей, таких как перекиси, супер оксидов и оксида азота 4.
Раскрытие информации
Благодарности
Работа выполнена при поддержке Национального института здоровья (K22NS050137 к JCB).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | |
|---|---|---|---|
| Прозрачным дном культуры блюдо | Маттек корпорации | P35G-1.5-14-C | |
| NbActive4 | BrainBits | NbActive4 | |
| TMRM | Invitrogen | T668 | |
| H 2 DCF-DA | Invitrogen | C400 | |
| NaCl | Сигма | S6191 | |
| KCl | Сигма | P3911 | |
| CaCl 2 • 2H 2 O | Сигма | C3306 | |
| MgCl 2 • 6H 2 O | Сигма | M2670 | |
| D-глюкозы | Сигма | G6152 | |
| HEPES | Invitrogen | 15630 |
Ссылки
- Hilgenberg, L. G., Smith, M. A. Preparation of dissociated mouse cortical neuron cultures. J. Vis. Exp. , (2007).
- Scaduto, R. C., Grotyohann, L. W. Measurement of mitochondrial membrane potential using fluorescent rhodamine derivatives. Biophys. J. 76, 469-477 (1999).
- Ward, M. W. The amyloid precursor protein intracellular domain (AICD) disrupts actin dynamics and mitochondrial bioenergetics. J. Neurochem. 113, 275-284 (2010).
- Gunasekar, P. G., Kanthasamy, A. G., Borowitz, J. L., Isom, G. E. NMDA receptor activation produces concurrent generation of nitric oxide and reactive oxygen species: implication for cell death. J. Neurochem. 65, 2016-2021 (1995).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены