Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Экономически эффективный метод для отслеживания источника микробного Использование Конкретные человека и животных вирусов
В этой статье
Резюме
Исследование описывает эффективный метод для идентификации источника фекальных / мочи заражения или загрязнения нитратами в воде с помощью КПЦР для конкретного количественного человека / свинины / бычьей ДНК-вирусы, аденовирусы и polyomaviruses, предложил в качестве инструментов MST.
Аннотация
Microbial contamination of the environment represents a significant health risk. Classical bacterial fecal indicators have shown to have significant limitations, viruses are more resistant to many inactivation processes and standard fecal indicators do not inform on the source of contamination. The development of cost-effective methods for the concentration of viruses from water and molecular assays facilitates the applicability of viruses as indicators of fecal contamination and as microbial source tracking (MST) tools. Adenoviruses and polyomaviruses are DNA viruses infecting specific vertebrate species including humans and are persistently excreted in feces and/or urine in all geographical areas studied. In previous studies, we suggested the quantification of human adenoviruses (HAdV) and JC polyomaviruses (JCPyV) by quantitative PCR (qPCR) as an index of human fecal contamination. Recently, we have developed qPCR assays for the specific quantification of porcine adenoviruses (PAdV) and bovine polyomaviruses (BPyV) as animal fecal markers of contamination with sensitivities of 1-10 genome copies per test tube. In this study, we present the procedure to be followed to identify the source of contamination in water samples using these tools. As example of representative results, analysis of viruses in ground water presenting high levels of nitrates is shown.
Detection of viruses in low or moderately polluted waters requires the concentration of the viruses from at least several liters of water into a much smaller volume, a procedure that usually includes two concentration steps in series. This somewhat cumbersome procedure and the variability observed in viral recoveries significantly hamper the simultaneous processing of a large number of water samples.
In order to eliminate the bottleneck caused by the two-step procedures we have applied a one-step protocol developed in previous studies and applicable to a diversity of water matrices. The procedure includes: acidification of ten-liter water samples, flocculation by skimmed milk, gravity sedimentation of the flocculated materials, collection of the precipitate and centrifugation, resuspension of the precipitate in 10 ml phosphate buffer. The viral concentrate is used for the extraction of viral nucleic acids and the specific adenoviruses and polyomaviruses of interest are quantified by qPCR. High number of samples may be simultaneously analyzed using this low-cost concentration method.
The procedure has been applied to the analysis of bathing waters, seawater and river water and in this study, we present results analyzing groundwater samples. This high-throughput quantitative method is reliable, straightforward, and cost-effective.
протокол
1. Концентрация вирусной частицы, присутствующие в пробах воды
- Сбор и кондиционирования проб воды
- Сбор минимум 2 повторов 10 л на один образец в пластиковых контейнерах с плоским дном и один дополнительный образец в качестве управления процессами. Последний пример будет подсыпали известное количество вирусных частиц и используются в качестве контроля.
Примечание: рекомендуется иметь специальный отдельный материал (бутылки, трубы и т.д.) для шипами образцов. - Проверьте калибровку conductimeter и откалибровать, если необходимо. Подготовка отрицательного контроля с использованием водопроводной воды доводят до ранее адекватной проводимости (см. ниже 1.6) в один дополнительный пластиковый контейнер 10 л.
- Для шипами образцов: Добавить стандартного объема контроля вируса (около 10 5 копий генома на 10 л воды) для образца. Смешайте перемешиванием избежать брызг и аэрозолей. Положительные контроля могли бы состоять в необычных штамм аденовируса суч как HAdV-35 или бактериофаги, такие как MS2.
- Если образец представляет высокое количество взвешенных частиц (песка или других материалов), пусть это осадков в течение 15 минут. Передача воды в новый контейнер.
- Отрегулируйте рН пробы воды до 3,5 (± 0,1) путем добавления 1 н HCl. Этот шаг важен для концентрации вирусов, поэтому убедитесь, что рН были должным образом закреплены. Смешайте воду тщательно интенсивном перемешивании с добавлением соляной кислоты. (Примечание: если рН ниже 3,5 добавляют 1 М NaOH).
- Отрегулируйте проводимости. Если образец имеет проводимость 1500 мкСм / см и выше, этот шаг не нужен. Если проводимость ниже, чем в 1500 мкСм / см образование флоккулируют материала (хлопья) не гарантируется так регулировать проводимость до 1500 мкСм / см за счет добавления искусственных морской соли (Sigma). Mix энергично перемешивают, добавляя морскими солями.
- Запись рН образцов до и после кондиционирования, а такжес объемом соляной кислоты используются. Проводимость должна быть записано после корректировки рН. Всегда дезинфекции рН-метр и conductimeter электродов с свежим раствором соляной кислоты, dechlorinate с 10% раствором натрия tiosulphate и, наконец, промыть дистиллированной водой.
- Сбор минимум 2 повторов 10 л на один образец в пластиковых контейнерах с плоским дном и один дополнительный образец в качестве управления процессами. Последний пример будет подсыпали известное количество вирусных частиц и используются в качестве контроля.
- Подготовка предварительного флоккулируют 1% обезжиренное молоко (PSM)
- Проверка калибровки рН-метра и conductimeter и откалибровать, если необходимо.
- Подготовка предварительно флоккулируют обезжиренное молоко решение (1% PSM, в / о), растворив 10 г сухого обезжиренного молока (Difco) в 1 л искусственной морской воде (растворяется 33,3 г искусственной морской соли в 1 л дехлорированию водопроводной воды и автоклав) и Тщательно регулируя рН до 3,5 1н HCl. Хлопья должны быть видны. Подготовка решения непосредственно перед, которые будут использоваться или хранить при температуре 4 ° С в течение 24 ч. Для дехлорирования использовать 1 мл 10% раствора на tiosulphate 100 мл воды.
- Флокуляция вирусные частицы, присутствующие в пробах воды
- Добавить 100 мл 1% PSM к 10-Л пробы воды.
- Движение образцов в течение 8-10 ч, чтобы позволить вирусам адсорбироваться на хлопья. Используйте таймер на отключение помешивая через 8-10 ч.
- Остановите перемешивание и пусть хлопья осадка под действием силы тяжести в течение 8-10 ч.
- Сбор и повторное растворение хлопьев. Центрифугирование
- Удалить супернатант использованием перистальтического насоса и пластиковые пипетки связаны с пластиковой трубкой. Для шипами образцы супернатанта должны быть сложены в бутылку и дезинфекции в соответствии с внутренними процедурами. Во всех случаях старайтесь не собирать гранул.
- Сбор осадка хлопьев (около 500 мл) в центрифуге бутылку.
- Баланс горшки путем добавления ПСМ рН 3,5.
- Центрифуга горшки в высокоскоростной центрифуге при 8000 мкг в течение 30 мин при 4 ° C. Как только центрифуги останавливается, осторожно удалите центрифуги горшки из центрифуги.
- Очень гвидимому слейте и выбросьте супернатант. Следуйте надлежащие меры по инфекционным материалом.
- Добавить 7 мл фосфатного буфера для растворения гранул в каждой центрифуге бутылку.
- Как только хлопья были разведены, измерять и добавлять фосфатный буфер, чтобы достичь общего объема 10 мл.
- Однородный вирусного концентрата на вортексе и распространение 10 мл в чистые микропробирок которых должны быть заморожены при температуре -80 ° C до необходимости в дальнейшем анализе.
2. Выделения нуклеиновых кислот
- Выполните извлечение нуклеиновых кислот с QIAamp Вирусная РНК Mini Kit следующие инструкции производителя. Этот комплект позволяет использовать автоматизированные платформы (например, Qiacube, Qiagen).
3. Количественный ПЦР человека аденовирусы (HAdV), JC polyomaviruses (JCPyV), свиней аденовирусы (ПБНС) и бычьего polyomaviruses (BPyV)
- Количественная оценка геном копиями в образцах
- ГотовитьКПЦР смесь в чистую отдельную область с помощью TaqMan Экологическая ПЦР Master Mix 2x (Applied Biosystems). Реакция происходит в 96-и оптических реакция пластины, покрытой с оптическим охватывает клея. Концентрации Master Mix, праймеры и зонды, описаны в таблице 1.
- Как только смесь была подготовлена, аликвоту 15μl в каждую лунку, включая элементы управления (см. 3.2). Общий объем для одной реакции после добавления цель будет 25 мкл (15μl микс + 10 мкл образца или стандарта).
- Добавить нуклеиновой кислоты выписки из образцов (10 мкл) в отдельную область. Выполнить прямое и десять раз разбавления в очищенной воде каждого образца в двух экземплярах. Обложка скважин содержащих образцы с частью клей крышкой, держать другой части прикрытия для следующего шага.
- Добавить разведения ДНК стандартных суспензий (10 мкл) от 10 0 до 10 6 GC/10μl от трех экземплярах и использовании микропипетки исключительно для стандартастандартные ДНК. Желательно, чтобы добавить стандартов в области оснащены УФ-излучение для разрушения ДНК плазмиды и очистить микропипетки после каждого использования. Обложка скважин содержащих стандарты нарезанные клей крышкой.
Примечание: Для подготовки стандартных суспензий, которые будут использоваться в количественной оценке геном копиями, область ДНК-мишени должны быть клонирован в плазмиду и линеаризованных. В адресу вы найдете подробные процедуры по созданию стандартных кривых плазмидой ДНК шаблоны для использования в КПЦР:
http://www.appliedbiosystems.com/support/tutorials/pdf/quant_pcr.pdf - Выполните КПЦР в адекватной системы выбора соответствующих параметров (с учетом использования клея покрытия и общий объем в каждой лунке, и т.д.). После активации Золотой AmpliTaq течение 10 мин при 95 ° C, 40 циклов амплификации осуществляется следующим образом: 15 с при 95 ° Cи 1 мин при 60 ° С в течение HAdV, JCPyV и BPyV, и 15 с при 95 ° C, 20-е годы при температуре 55 ° С и 20-е годы при температуре 60 ° С в течение ПБНС.
- Как только реакция завершена, хранить данные и результаты, как описано в руководстве пользователя используемого оборудования. Количество ДНК будет определяться как среднее из данных, полученных после исправления коэффициент разбавления, когда это необходимо.
- Управления
- Использование положительного и отрицательного контроля. Анализ должен включать более одного не-шаблон контролем (NTC), чтобы доказать смесь не вызывает флуоресценцию. Желательно, чтобы запустить процесс положительного контроля с целью оценки потенциальных ингибирования ферментов в связи с ингибиторами настоящее время в исследованных образцах.
- Запись результатов анализов КПЦР двух различных разведений стандартной ДНК и от процесса управления. Использование результатов, подготовить контрольные карты для контроля качества (КК), программы, связанные с чувствительностью и эффективность анализа.
- ПодтверждениеРезультаты
- Положительные результаты могут быть дополнительно подтверждена с помощью вложенных ПЦР и нуклеотидной последовательности ампликонов, производя дополнительных данных о нуклеотидных последовательностей штаммов обнаружен 1,5,6,7,9,12.
После процедуры, описанной, человека и животных вирусов были обнаружены и количественно вод для купания, морской и речной воды 2,3. Как типичный пример, молотый проб воды из областей с высокой степенью уровень нитратов были оценены для определения источников загрязнения. Десять-литровые пробы воды были собраны из 4-х различных скважин в сельских районах Северо-Восточного региона в Испании. Пять повторяет были собраны в каждую лунку являясь одним повторить посеяны с человеческим аденовирусом 2 используется в качестве управления процессами. Образцы были обработаны в соответствии с протоколом представлена на рисунке 1. Четыре повторяет проанализированы в одном из четырех участков изучали показал положительные результаты для ПБНС (среднее значение 7,74x10 2 GC / л), который был бы связан с наличием шламов свиней в районах, прилегающих отбора проб и будет поддерживать загрязнения фекалиями свиней в качестве источника нитратов в подземных водах (табл. 2).
4. Представитель Результаты:
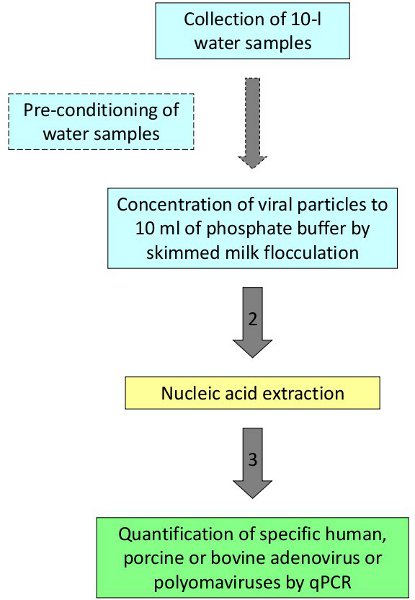
Рисунок 1. Процедура обнаружения и количественного определения вирусов в воде.
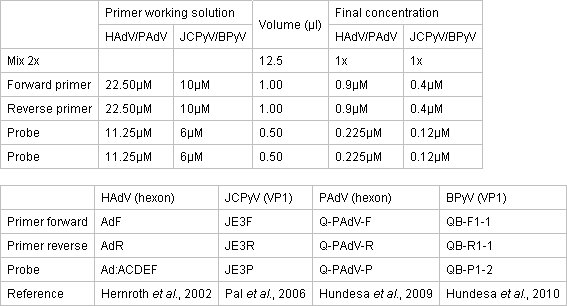
Таблица 1. Концентрация праймеры и зонды для КПЦР анализов.

Таблица 2. Обнаружение и количественное определение животных и человека, аденовирусы и polyomaviruses в пробах грунтовых вод.
N количество дубликатов проанализированы
% Процент положительных повторяет
(-) Не обнаружены
Обсуждение
Процедура, описанная выполнит условия для установки методом для рутинной окружающей среды и лаборатории общественного здравоохранения: воспроизводимый, надежный, простой и экономически эффективной. Протокол прост, однако он должен быть тщательно следили. Низкая проводимость в об...
Раскрытие информации
Две заявки на патенты были поданы в 2009 году для защиты интеллектуальной собственности протоколов для количественной оценки ПБНС и BPyV.
Благодарности
Эта работа была частично поддержана правительством Испании "Ministerio де Educación у Ciencia» (проект AGL2008-05275-C01/ALI), Европейским Союзом Рамочной исследовательской 7 проектов, финансируемых VIROBATHE (контракт № 513648), VIROCLIME (контракт № 243923 ) и Агентством каталонского Воды, Agencia Catalana де l'Aigua (ACA), Департамент управления де я Millora ДЕЛЬЗ Ecosistemes водных видов спорта. Во время исследования разработан Мартой Rusiñol был членом правительства каталонской "AGAUR" (FI-DGR).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Высокая скорость центрифуги (8000 мкг) | Berckman Coulter | Avanti J-20XP | |
| рН-метр, термометр и conductimeter | Afora | LPPC3003 | |
| Пластиковые трубы длиной 100-200 см | Deltalab | 350059 | |
| Стерильные окончил одноразовые пипетки | Labclinics | PN10E1 | |
| Стерильные пластиковые трубы в 1,5 и 10-15 мл (Эппендорф, Соколов и др.) | Afora | KA298/00 | |
| Центрифуга горшки (500 мл) | Fisher Scientific | SE5753512 | |
| Магнитные мешалки и магниты (по одному наобразца) | Fisher Scientific | 10510 | |
| Стеклянные или пластиковые контейнеры с плоским дном, чтобы разрешить использование магнитной мешалки | Deltalab | 191642 | |
| Перистальтического насоса для удаления надосадочной (или водоструйный вакуумный насос) | Watson-Marlow | 323E / D | |
| Таймер на отключение шевелясь после 8-10 часов | Deltalab | 900400 | |
| Соляная кислота (1н и 0,1) | Panreac | 141020.1611 | |
| Гидроксид натрия (1N) | Panreac | 131687.1211 | |
| Искусственные морской соли морской воды | Сигма | S9883 | |
| Обезжиренное молоко (SM) | Difco | 232100 | |
| Фосфатный буфер рН = 7, 5 | 1:02 об. / стерильных Na 2 HPO 4 0,2 М и NaH 2 PO 4 0,2 М при рН 7,5 | ||
| Тиосульфата | Panreac | 121879.1209 | Сделать 10% раствор в воде |
| QIAamp Вирусная РНК Mini Kit | Qiagen | 52904 | |
| 96-и оптические пластины реакции (500 единиц) | Applied Biosystems | 43426659 | |
| Оптический клей охватывает (100 единиц) | Applied Biosystems | 4311971 | |
| TaqMan Экологическая ПЦР Master Mix 2x | Applied Biosystems | 4396838 |
Ссылки
- Bofill-Mas, S., Clemente-Casares, P., Major, E. O., Curfman, B., Girones, R. Analysis of the excreted JC virus strains and their potential oral transmission. J. Neurovirol. 9 (4), 498-507 (2003).
- Bofill-Mas, S., Albinana-Gimenez, N., Clemente-Casares, P., Hundesa, A., Rodriguez-Manzano, J., Allard, A., Calvo, M., Girones, R. Quantification and stability of human adenoviruses and polyomavirus JCPyV in wastewater matrices. Appl. Environ. Microbiol. 72 (12), 7894-7896 (2006).
- Calgua, B., Mengewein, A., Grunert, A., Bofill-Mas, S., Clemente-Casares, P., Hundesa, A., Wyn-Jones, A. P., López-Pila, J. M., Girones, R. Development and application of a one-step low cost procedure to concentrate viruses from seawater samples. J. Virol. Methods. 153 (2), 79-83 (2008).
- Hernroth, B. E., Conden-Hansson, A. C., Rehnstam-Holm, A. S., Girones, R., Allard, A. K. Environmental factors influencing human viral pathogens and their potential indicator organisms in the blue mussel, Mytilus edulis: the first Scandinavian report. Appl. Environ. Microbiol. 68, 4523-4533 (2002).
- Hundesa, A., Bofill-Mas, S., de Motes, M. a. l. u. q. u. e. r., Rodriguez-Manzano, C., Bach, J., Casas, A., M, ., Girones, R. Development of a quantitative PCR assay for the quantitation of bovine polyomavirus as a microbial source-tracking tool. J. Virol. Methods. 163 (2), 385-389 (2010).
- Hundesa, A., de Motes, M. a. l. u. q. u. e. r., Albinana-Gimenez, C., Rodriguez-Manzano, N., Bofill-Mas, J., Suñen, S., E, ., Girones, R. Development of a qPCR assay for the quantification of porcine adenoviruses as an MST tool for swine fecal contamination in the environment. J. Virol. Methods. 158 (1-2), 130-135 (2009).
- Hundesa, A., de Motes, M. a. l. u. q. u. e. r., Bofill-Mas, C., Albinana-Gimenez, S., N, ., Girones, R. Identification of human and animal adenoviruses and polyomaviruses for determination of sources of fecal contamination in the environment. Appl. Environ. Microbiol. 72 (12), 7886-7893 (2006).
- Layton, B. A., Walters, S. P., Lam, L. H., Boehm, A. B. Enterococcus species distribution among human and animal hosts using multiplex PCR. J. Appl. Microbiol. 109, 539-547 (2010).
- de Motes, M. a. l. u. q. u. e. r., Clemente-Casares, C., Hundesa, P., Martín, M., Girones, R. Detection of bovine and porcine adenoviruses for tracing the source of fecal contamination. Appl. Environ. Microbiol. 70 (3), 1448-1454 (2004).
- Pal, A., Sirota, L., Maudru, T., Peden, K., Lewis, A. M. Real-time PCR assays for the detection of virus-specific DNA in simples with mixed populations of polyomaviruses. J. Virol. Methods. 135 (1), 32-42 (2006).
- Stapleton, C. M., Kay, D., Wyer, D. a. v. i. e. s., Watkins, C., Kay, J., McDonald, C., Porter, A. T., J, ., Gawler, A. Evaluating the operational utility of a Bacteroidales quantitative PCR-based MST approach in determining the source of faecal indicator organisms at a UK bathing water. Water Res. 43, 4888-4899 (2010).
- Wang, J., Horner, G. W., Keef, O., S, J. Detection and molecular characterization of bovine polyomavirus in bovine sera in New Zealand. N. Z. Vet. J. 53, 26-30 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены