Method Article
Трансдукция клеток человека с Полимер-комплекс Ecotropic лентивирус для работы с улучшенными биобезопасности
В этой статье
Резюме
Лентивирусов являются ценным исследовательским инструментом для изучения функции генов, однако, исследователи, возможно, пожелают, чтобы избежать производства пантропный кодирования лентивирус известных или подозреваемых онкогенов. В качестве альтернативы, мы представляем безопаснее протокол для использования ecotropic лентивирус на клетки человека изменен, чтобы выразить ecotropic mSlc7a1 рецепторов.
Аннотация
Stem and tumor cell biology studies often require viral transduction of human cells with known or suspected oncogenes, raising major safety issues for laboratory personnel. Pantropic lentiviruses, such as the commonly used VSV-G pseudotype, are a valuable tool for studying gene function because they can transduce many cell types, including non-dividing cells. However, researchers may wish to avoid production and centrifugation of pantropic viruses encoding oncogenes due to higher biosafety level handling requirements and safety issues. Several potent oncogenes, including c-Myc and SV40 large T antigen, are known to enhance production of induced pluripotent stem cells (iPSC). All other known iPSC-inducing genetic changes (OCT4, SOX2, KLF4, NANOG, LIN28, and p53 loss of function) also have links to cancer, making them of relatively high safety concern as well.
While these cancer-related viruses are useful in studying cellular reprogramming and pluripotency, they must be used safely. To address these biosafety issues, we demonstrate a method for transduction of human cells with ecotropic lentivirus, with additional emphasis on reduced cost and convenient handling. We have produced ecotropic lentivirus with sufficiently high titer to transduce greater than 90% of receptor-expressing human cells exposed to the virus, validating the efficacy of this approach.
Lentivirus is often concentrated by ultracentrifugation; however, this process takes several hours and can produce aerosols infectious to human biomedical researchers. As an alternative, viral particles can be more safely sedimented onto cells by complexation with chondroitin sulfate and polybrene (CS/PB). This technique increases the functional viral titer up to 3-fold in cells stably expressing murine retrovirus receptor, with negligible added time and cost. Transduction of human dermal fibroblasts (HDFs) is maximally enhanced using CS/PB concentrations approximately 4-fold lower than the optimal value previously reported for cancer cell lines, suggesting that polymer concentration should be titrated for the target cell type of interest. We therefore describe the use of methylthiazolyldiphenyl-tetrazolium bromide (MTT) to assay for polymer toxicity in a new cell type. We observe equivalent viability of HDFs after viral transduction using either polymer complexation or the standard dose of polybrene (PB, 6 μg/ml), indicating minimal acute toxicity.
In this protocol, we describe the use of ecotropic lentivirus for overexpression of oncogenes in human cells, reducing biosafety risks and increasing the transduction rate. We also demonstrate the use of polymer complexation to enhance transduction while avoiding aerosol-forming centrifugation of viral particles.
протокол
1. Lentivirus production, harvest, and freezing
- Consult your institutional safety official before beginning this protocol, and follow their recommended safety guidelines.
- Day 1. Start with healthy, rapidly growing 293T cells to produce virus. Plate the cells at 5 x 106 cells per 10 cm plate. Use antibiotic-free 293T medium (high-glucose DMEM with 10% FBS and 4 mM L-glutamine) for virus production.
- Day 2. In the late afternoon, transfect 293T cells as follows (numbers given are for one 10 cm plate). Let all reagents warm up to room temperature. Pipette 375 μl OptiMEM into a microcentrifuge tube, then add 25 μl Fugene HD. Do not allow undiluted Fugene to contact the surface of the tube.
- In a microcentrifuge tube, mix:
- 5 μg transfer plasmid (Slc7a1, target vector, or fluorescent control vector)
- 3.75 μg packaging plasmid (pCMV-dR8.91 or psPax2)
- 1.25 μg envelope plasmid (pMD2.G for pantropic, pHCMV-EcoEnv for ecotropic)
- serum-free OptiMEM to 100 μl
- Combine the two tubes and incubate the mixture 20-30 minutes at room temperature.
- Change the medium on the 293T cells to 10 ml fresh antibiotic-free 293T medium. Add the Fugene/plasmid mix drop-wise to the plate and incubate overnight at 37°C, 5% CO2.
- Day 3. Change medium on the 293T cells to 10 ml fresh antibiotic-free 293T medium. Be gentle, because 293T cells adhere only loosely and can slough off by media pipetted too forcefully onto the monolayer. Incubate for two days in a humidified incubator for virus production.
- Day 5. Harvest virus and filter with a 0.45 mm low protein binding filter. Use immediately or dispense into single-use aliquots and freeze at -80°C. Frozen pantropic and ecotropic virus should be re-titered after it has been stored for six months and one month, respectively.
- Titer the virus as follows, using cells that are relatively amenable to transduction. Transduce cells with fluorescent control virus overnight using serial dilutions (e.g. 1:10, 1:100, 1:1000) in fresh medium with 6 μg/ml PB. Change to fresh medium the next day. Allow the cells two days after transduction to begin expressing the fluorescent protein, then determine the fraction of transduced cells by FACS. Calculate the titer in transforming units (TU) per ml, based on dilutions that yield < 15% transduction to minimize multiple transduction events.

2. Transduction of human target cells with murine retrovirus receptor Slc7a1
- Select a multiplicity of infection (MOI) = 2 to ensure that most cells will be transduced. For target cells that are resistant to transduction such as HDFs, a higher MOI will be required; we dilute the viral supernatant only 1:2 to achieve transduction of a majority of the cells.
- Transduce target cells overnight with viral supernatant diluted in fresh culture medium with 6 μg/ml PB, which increases transduction by enhancing electrostatic interaction between the virus and target cell.1 Ideally one should use a minimal volume of virus, such as 1 ml for a 35 mm plate, because diffusion is a limiting factor in transduction efficiency.
- Culture cells for at least 48 hours after removing virus before transducing them with ecotropic virus, in order to ensure sufficient expression of the Slc7a1 receptor.
- (Optional) It is possible to use blasticidin to select for stably transduced cells expressing Slc7a1, if desired. A blasticidin kill curve should be generated in advance to determine the lowest effective concentration, generally between 2 – 10 μg/ml, that kills all untransduced target cells in 7 days. About 2 days after removing the Slc7a1 virus, switch the transduced cells to medium containing blasticidin. Culture the cells in blasticidin-containing medium for 7 days, at which point all remaining cells will stably express the retrovirus receptor at which point they can be transduced with ecotropic virus as well as banked for future use as a stable Slc7a1-expressing line.
3. Polymer complex titration to determine toxicity
- Day 1. Plate cells at 5000 cells/well in a 96-well plate, allowing at least triplicate wells for each experimental group. Include untransduced cells in complete medium to provide a baseline value for healthy cells, as well as samples consisting of cells in serum-free medium to induce growth arrest as a control. In parallel, plate cells in an appropriate format (such as a 24-well plate) for microscopic or FACS-based analysis of transduction efficiency in each experimental condition.
- Day 2. Transduce cells in plates set up for both the MTT and FACS analyses with virus encoding GFP, at an MOI of 0.5 to transduce ~40% of target cells. Test varied concentrations of CS/PB (e.g. 50, 100, 200, 400, 600, and 800 mg/ml of each component), as well as 6 μg/ml PB, to determine optimal amounts. Generate polymer complexes as described in Part 4, below.
- Day 3. Remove virus-containing medium and replace with fresh medium. Return the plates to a humidified incubator.
- Day 5. Analyze FACS plate to determine the transduction efficiency with each polymer concentration.
- Day 6. Remove the medium from all wells of the MTT plate and replace with 100 μl MTT solution (1 mg/ml MTT in complete medium). Culture for three hours in a humidified incubator to allow MTT to be reduced in the mitochondria of metabolically active cells.
- Remove MTT solution and replace with 200 ml MTT solvent (0.1 N HCl, 0.1% Igepal CA-630 in isopropanol).
- Incubate for two hours at room temperature or until all of the purple MTT formazan precipitate is dissolved. Read the absorbance on a microplate reader at 570 nm, subtracting the background reading at 690 nm.
- Select the optimal polymer concentration that produces maximum enhancement of transduction, as determined by FACS, with minimal effect on metabolic activity, as determined by MTT. For HDFs, we selected 100 μg/ml CS/PB based on the data shown in the Representative Results, below.
4. Ecotropic transduction with polymer complexation
- Prepare sterile-filtered stock solutions of PB and chondroitin sulfate at 20 mg/ml in water. Aliquot and store at -20°C.
- Pipette viral supernatant into a microcentrifuge tube and dilute to the desired final concentration (e.g. MOI of 2) with fresh culture medium. Add equal volumes of PB and chondroitin sulfate (concentrations determined in step 3 above) in succession, flicking the tube to mix after each addition. The viral mixture will immediately become cloudy as precipitates form. Incubate the viral mixture at room temperature for 5 minutes to allow complex formation.
- Remove media from the receptor-expressing target cells, replace with the viral mix, and incubate overnight at 37°C, 5% CO2. After removing the viral mix, wash the surface of the cells twice with PBS to aid in removing viral complexes. Complete removal is not necessary; we have observed no adverse effects on cell health from residual polymer complexes.
5. Verifying specificity of ecotropic transduction
- When producing ecotropic virus for the first time, it is prudent from a safety perspective to verify that the virus is unable to transduce unmodified human cells. Transduce human cells with ecotropic lentivirus at relatively high concentration (only a 1 to 2-fold dilution of viral supernatant in fresh medium) overnight with 6 μg/ml PB or optimized CS/PB concentration.
- Remove virus-containing medium and replace with fresh medium. After incubating cells for 2 days, validate transgene expression by FACS using fluorescent vectors and/or by RT-PCR with transgene-specific primers.
6. Representative results:
Fig. 1A shows the lentivirus production process, and Fig. 1B shows transduction of human cells with ecotropic lentivirus, including pre-transduction with murine retrovirus receptor Slc7a1. For titering virus, we use a human rhabdomyosarcoma cell line stably transduced with Slc7a1 (Slc-hRMS). When using fluorescent control vectors to monitor transduction efficiency, we routinely achieve > 90% transduction efficiency of Slc-hRMS with ecotropic virus, as shown in Fig. 2A and 2B. Transduction rates of HDFs are generally lower because the cells have not been blasticidin-selected for receptor expression (Fig. 2C). Titers of ecotropic lentivirus are generally 10-20% of VSV-pseudotyped virus when measured on Slc-hRMS (Fig. 2D).
One freeze-thaw cycle reduces titer of ecotropic virus by 16 - 3%, equal to titer loss during a single freeze-thaw cycle of VSV-pseudotyped virus (p > 0.05). Contrary to previous reports,2 we observe no positive effect on virus titer from flash freezing in dry ice. Rather, we achieve higher post-thaw titers of either pseudotype by simply placing tubes of virus into a -80°C freezer (data not shown).
The MTT viability assay allows sensitive detection of growth arrest in target cells. Transduction with virus plus concentrations of CS/PB up to 800 μg/ml has no effect on HDF metabolism (Fig. 3A). Exposure to CS/PB without virus also has no toxic effect on cells (data not shown). FACS analysis of HDFs transduced with virus plus various concentrations of CS/PB shows enhancement of transduction compared to PB alone (Fig. 3B). The maximum enhancement occurs at 100 μg/ml CS/PB (Fig. 3C), several-fold lower than previously reported values.3 Thus, it is important to optimize conditions for any given target cell type.
Complexation with CS/PB enhances the observed titer roughly 3-fold in Slc-hRMS (Fig. 4A, p < 0.01). In practice, this yields a greater effect on transduction efficiency at low virus concentrations than at higher concentrations (Fig. 4B), which is most likely due to multiply transduced cells and receptor saturation at higher virus concentrations.
Transduction with ecotropic virus is specific for cells expressing murine retrovirus receptor. When transducing unmodified human cells with ecotropic virus, we have not observed fluorescence greater than the untransduced background whether using PB or CS/PB, as shown in Fig. 5A. Microscopically, HDFs show no transduction in the absence of receptor (Fig. 5B) while pre-transduction with receptor results in fluorescent cells (Fig. 5C).
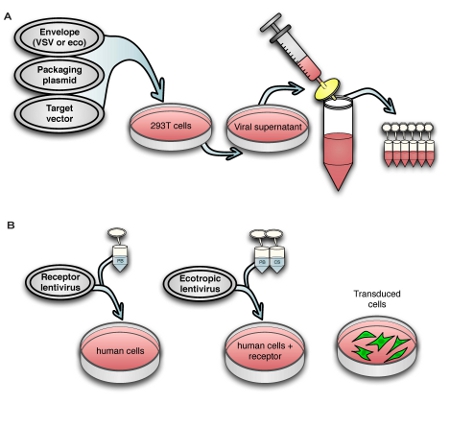
Figure 1. Schematic view of (A) the virus production process and (B) transduction of human cells with murine retrovirus receptor followed by ecotropic lentivirus.
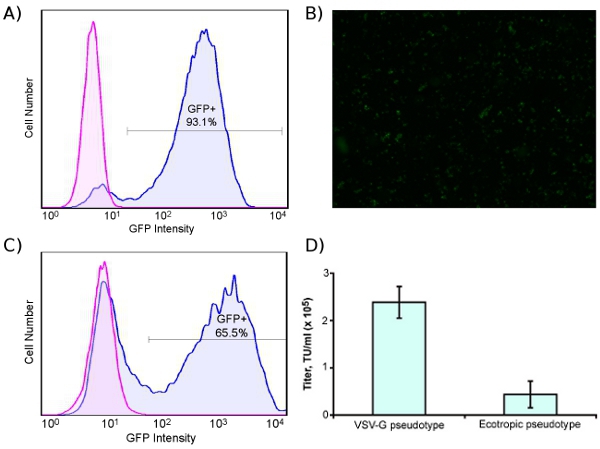
Figure 2. High-efficiency transduction of human cells with ecotropic lentivirus encoding GFP. Cells were pre-transduced with murine retrovirus receptor Slc7a1. (A) Human rhabdomyosarcoma cell line blasticidin-selected for Slc7a1 (Slc-hRMS), transduced (blue) or untransduced (pink) with GFP. (B) Fluorescent micrograph of ecotropic-transduced Slc-hRMS (4X). (C) HDFs transduced (blue) and untransduced (pink) with ecotropic GFP lentivirus; cells were transduced with Slc7a1 two days prior to ecotropic transduction. (D) Titer of VSV-G pseudotyped and ecotropic lentivirus, measured on Slc-hRMS.
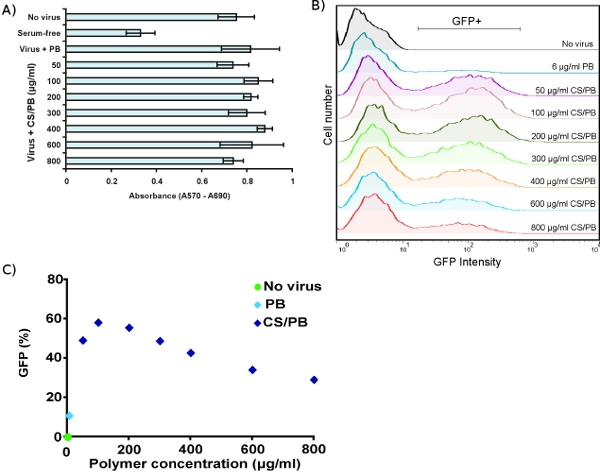
Figure 3. Optimizing chondroitin sulfate/polybrene (CS/PB) concentrations in human dermal fibroblasts. (A) Viability of HDFs measured by MTT assay after transduction in the presence of PB only or with varied concentrations of CS/PB. (B) Enhancement of transduction efficiency in HDFs by different concentrations of CS/PB, measured by FACS. (C) Quantification of transduction enhancement, showing that maximum transduction occurs at 100 μg/ml CS/PB.
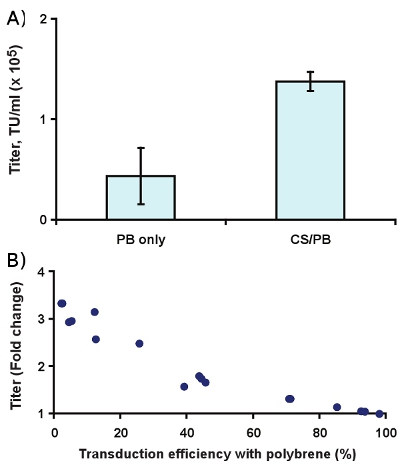
Figure 4. Effect of 400 μg/ml CS/PB on transduction of Slc-hRMS with ecotropic lentivirus. (A) Titer enhancement, and (B) fold change in transduction rate compared to 6 μg/ml polybrene alone.
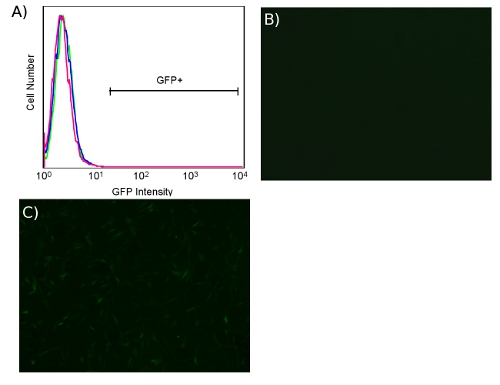
Figure 5. Lack of ecotropic transduction of HDFs in the absence of murine retrovirus receptor Slc7a1. (A) FACS plot of BJ human fibroblasts, untransduced (pink) or transduced (blue) with ecotropic GFP lentivirus in both cases in the absence of receptor Slc7a1. BJ human fibroblasts transduced with ecotropic GFP lentivirus, without (B) and with (C) pre-transduction with receptor Slc7a1 (4X).
Обсуждение
Рекомбинантный ecotropic gammaretrovirus на основе Молони мышиного вируса лейкоза (MLV) и его рецептор mSlc7a1 хорошо изучены и широко доступны, что оно использовалось более 20 лет для доставки трансгенов в мышиных клетках. Ecotropic gammaretrovirus также используется в последнее время для доставки онкогенов в клетках человека;. В контексте сотовых перепрограммирования, использование mSlc7a1, чтобы избежать поколения amphotropic вирус укрывательство человека онкогенов хорошо известна 4,5 Тем не менее, лентивирус обеспечивает значительные преимущества по сравнению с gammaretrovirus В трансдуцирующих огнеупорных клеточных популяций, 6, включая первичные клетки, которые часто желательно цели для перепрограммирования, так как лентивирусов предварительной интеграции комплекса позволяет трансдукции, не делящихся клеток. 7
Лентивирусов были произведены с десятками различных pseudotypes, в том числе MLV, в попытке изменить вирус тропизм, токсичность и другие свойства. 8 MLV-pseudotyped ecotropic лентивирус была использована для трансдукции клеток мыши, 9, но редко используется на клетки человека 10. Поэтому мы предлагаем использование MLV-pseudotyped ecotropic лентивирус как безопасный, экономичный и высокоэффективный автомобиль для доставки известных или подозреваемых онкогенов, в том числе сотовых перепрограммирования факторов, в клетках человека.
Важно отметить, что этот протокол не полностью избавляет от необходимости производить и использовать пантропный лентивирус, а, скорее, этот протокол отделяет онкоген (ы) из пантропный вирус, изоляционные исследователей из потенциальных самостоятельной прививки связанных с раком вирусов. MSlc7a1 белка и его гомолог человеческого hSlc7a1 являются повсеместно выразил аминокислоты перевозчиков кислоты, не известны туморогенность или способность даровать селективное преимущество роста на клетки-реципиенты, 11 решений mSlc7a1 сравнительно низким уровнем риска для включения в amphotropic вируса. Это добавило шаг может быть особенно полезным в лабораториях не хватает посвященный вирусу или объектов культуры тканей необходимого уровня биобезопасности.
В некоторых ситуациях это может быть возможным, чтобы полностью отказаться от использования пантропный вируса путем трансфекции плазмидой Slc7a1 непосредственно в клетки-мишени, однако многие клетки, которые были бы полезными целями этой техники также поддаются трансфекции. В качестве альтернативы, способность изолировать Slc7a1-трансдуцированных клеток выбор blasticidin означает, что VSV-G pseudotyped лентивирус может быть использован только один раз, чтобы создать запас рецепторами клеток, экспрессирующих, после чего ecotropic вирус может быть использован для трансдукции обычно эти клетки для многих экспериментов. Исследователи должны всегда следовать их институциональных правил техники безопасности при работе с любым лентивирус, независимо от его тропизм.
Титры ecotropic вируса достигнуты с этим протоколом умеренно ниже, чем VSV-pseudotyped вирус, как правило, 10-20% пантропный титр вируса, в соответствии с предыдущими исследованиями. 9 Эти титры были измерены в клетках человека стабильно трансдуцированных с Slc7a1, так что нижняя наблюдается титр для ecotropic вирус может быть частично обусловлено разнообразными экспрессии рецептора гена в клетки-мишени. Тем не менее, вирусные титры достигнута в наш протокол более чем достаточно для большинства приложений и привести к трансдукции большинства клеток, в некоторых случаях> 90% клеток.
Центрифугирование методы на основе широко используются для сконцентрироваться вирусных частиц. Тем не менее, центрифугирования требует нескольких часов, генерирует инфекционных аэрозолей, и может привести к значительной потере вирусных частиц. 12 В качестве альтернативы, комплексообразование с НЦБ / PB может быть использован для повышения трансдукции без изменения вирусной тропизм. 3 Этот метод быстрого (5 минут ) и недорогая ($ 0,03 за 10 мл вируса), в то время как примерно в три раза наблюдалось титр. Никакого специального оборудования или собственности реагенты необходимы, и мы наблюдали минимальную острую токсичность после воздействия HDFS для CS / PB, по согласованию с предыдущей работы в других клеточных линий. 13 Одним из потенциальных недостатков этого протокола является то, что некоторые микроскопически видимые полимерных комплексов придерживаться клетки в течение нескольких дней в культуре. Мы не можем исключить возможность того, что эти комплексы, а не открыто токсичны для клеток, может иметь более тонкие эффекты на клеточные процессы.
Здесь мы описали методологию безопасно и эффективно трансдуцирующих человеческие клетки с онкогенными факторами. Этот подход должен быть очень утилита для исследователей, изучающих онкогенов и биологии стволовых клеток, в том числе плюрипотентных клеток.
Раскрытие информации
Благодарности
Финансирование этого проекта была предоставлена Калифорнийского института регенеративной медицины.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
|---|---|---|---|
| pLenti6/UbC/mSlc7a1 | Addgene | 17224 | Мышей рецептор MLV |
| pMD2.G | Addgene | 12259 | VSV-G конверте |
| pCMV-dR8.91 | Д. Trono лаборатории 14 | Упаковка плазмиды (эквивалент плазмиды psPax2 можно получить Addgene, Кат. Количество 12260) | |
| pHCMV-EcoEnv | Addgene | 15802 | Ecotropic конверте |
| FUGW | Addgene | 14883 | GFP контроль плазмиды |
| OptiMEM | Invitrogen | 31985 | |
| Fugene HD | Roche | 04 709 705 001 | |
| Hexadimethrine бромид (Polybrene) | Sigma-Aldrich | H9268 | |
| Хондроитин сульфат натрия соли из акульего хряща | Sigma-Aldrich | C4384 | |
| Blasticidin S | Рыболов | ВР 2647100 | |
| Methylthiazolyldiphenyl-тетразолия бромид (МТТ) | Sigma-Aldrich | M2128 | |
| Igepal CA-630 | Sigma-Aldrich | I3021 |
Ссылки
- Davis, H. E., Rosinski, M., Morgan, J. R., Yarmush, M. L. Charged polymers modulate retrovirus transduction via membrane charge neutralization and virus aggregation. Biophys J. 86, 1234-1242 (2004).
- Marino, M. P., Luce, M. J., Reiser, J. Small- to large-scale production of lentivirus vectors. Methods Mol Biol. 229, 43-55 (2003).
- Landazuri, N., LeDoux, J. M. Complexation of retroviruses with charged polymers enhances gene transfer by increasing the rate that viruses are delivered to cells. J Gene Med. 6, 1304-1319 (2004).
- Ohnuki, M., Takahashi, K., Yamanaka, S. Generation and characterization of human induced pluripotent stem cells. Curr Protoc Stem Cell Biol. 4, 4A.2-4A.2 (2009).
- Hotta, A. EOS lentiviral vector selection system for human induced pluripotent stem cells. Nat Protoc. 4, 1828-1844 (2009).
- Reiser, J. Transduction of nondividing cells using pseudotyped defective high-titer HIV type 1 particles. Proc Natl Acad Sci U S A. 93, 15266-15271 (1996).
- Cullen, B. R. Journey to the center of the cell. Cell. 105, 697-700 (2001).
- Cronin, J., Zhang, X. Y., Reiser, J. Altering the tropism of lentiviral vectors through pseudotyping. Curr Gene Ther. 5, 387-398 (2005).
- Schambach, A. Lentiviral vectors pseudotyped with murine ecotropic envelope: increased biosafety and convenience in preclinical research. Exp Hematol. 34, 588-592 (2006).
- Koch, P., Siemen, H., Biegler, A., Itskovitz-Eldor, J., Brustle, O. Transduction of human embryonic stem cells by ecotropic retroviral vectors. Nucleic Acids Res. 34, e120-e120 (2006).
- Yoshimoto, T., Yoshimoto, E., Meruelo, D. Molecular cloning and characterization of a novel human gene homologous to the murine ecotropic retroviral receptor. Virology. 185, 10-17 (1991).
- Cepko, C. Large-scale preparation and concentration of retrovirus stocks. Curr Protoc Mol Biol. Chapter 9, Unit 9.12-Unit 9.12 (2001).
- Doux, J. M. L. e., Landazuri, N., Yarmush, M. L., Morgan, J. R. Complexation of retrovirus with cationic and anionic polymers increases the efficiency of gene transfer. Hum Gene Ther. 12, 1611-1621 (2001).
- Zufferey, R. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J Virol. 72, 9873-9880 (1998).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены