Method Article
Микроинъекция мыши ооцитов, созревание и Плоидность Оценка
В этой статье
Резюме
Ооциты склонны к анеуплоидии из-за ошибок в сегрегации хромосом во время мейоза созревания. Анеуплоидных яйца могут стать причиной бесплодия, выкидышей или отклонениями в развитии, как синдром Дауна. Здесь мы опишем методы представить материалы по выбору в ооциты и методы для изучения мейоза созревания и оценки плоидности.
Аннотация
Ошибки в сегрегации хромосом приводят к анеуплоидных клеток. В соматических клетках, анеуплоидии связано с раком, но в гаметах, анеуплоидии приводит к бесплодию, выкидышам или отклонениями в развитии, как синдром Дауна. Гаплоидное гамет форме через видоспецифические программ развития, которые связаны с мейоза. Первого деления мейоза (ИМ) является уникальным для мейоза, потому сестринские хроматиды остаются связанными в то время как гомологичные хромосомы отделяются. По причинам, не до конца понял, это разделение reductional склонен к ошибкам и чаще источником анеуплоидии, чем ошибки в мейозе II (MII) или ошибки, чем у мужчин 1,2 мейоза.
У млекопитающих, ооциты арест в профазе ИМ с крупных, нетронутых зародышевого пузырька (Г. В.; ядра), и только возобновление мейоза, когда они получают сигналы овуляции. После мейоза резюме, ооциты полный ИМ и пройти асимметричной деление клеток, арестовав снова в метафазе MII. Яйца не будет полным MII, пока они оплодотворяются спермой. Ооцитов также могут пройти мейоза созревания с использованием установленных в пробирке условия культивирования 3. Потому что поколение трансгенных и генно-целевых мутантов мыши является дорогостоящим и может занять длительное время, манипуляции с женской гамет в пробирке является более экономичным и экономии времени стратегии.
Здесь мы описываем методы, чтобы изолировать профазы арестован ооцитов от мышей и для микроинъекции. Любой материал, выбор может быть введен в яйцеклетку, а потому, meiotically-компетентных ооциты транскрипционно молчание 4,5 кРНК, а не ДНК, должен быть введен для внематочной исследования выражения. Для оценки плоидности, мы описываем наши условия для экстракорпорального созревания ооцитов в MII яйца. Исторически сложилось, что хромосомы распространяющихся методы используются для подсчета числа хромосом 6. Этот метод является технически сложным и ограничивается только выявление hyperploidies. Здесь мы опишем метод, чтобы определить гипо-и hyperploidies использованием нетронутыми яйца 7-8. Этот метод использует monastrol, кинезин-5 ингибитор, который разрушается шпинделя биполярного в монополярный шпинделя 9 отделяя хромосом, что отдельные кинетохоры может быть легко обнаружен и рассчитывал с помощью анти-CREST аутоиммунные сыворотки. Так как этот метод осуществляется в интактных яиц, хромосомы не потеряли из-за ошибки оператора.
протокол
1. Коллекция мышь ооцитов
- Чтобы максимально увеличить количество антральных фолликулов изолированы друг от мыши, внутрибрюшинно вводят половозрелой самки мышей (мы используем 6-недельных CF-1 мышей от Харлан) с 5 МЕ сыворотке беременной кобылы гонадотропин (PMSG).
- Подготовка коллекции среду (MEM / ПВП) (3 мл / мышь), добавив милринон до 2,5 мкМ и теплом при температуре 37 ° C. Милринон является ингибитор фосфодиэстеразы, которая поддерживает арест мейоза ооцитов раз удаляются из фолликулов. Кроме того, 3-изобутил-1-метилксантина (IBMX) (0,2 мм) или дибутирил-циклического аденозинмонофосфата (dbcAMP) (100 мкг / мл) могут быть использованы. Подготовка питательной среды путем добавления глутамина (1 мМ) и милринон (2,5 мкМ) по 1 мл CZB и дайте ему, чтобы уравновесить в инкубаторе по меньшей мере час. Настройка микрокапель каждого из них в чашку Петри и наложения с минеральным маслом. Блюдо CZB помещают в инкубатор при MEM / ПВП блюдо остается снаружи на слайд теплее. Другие коллекции и культуральной среды, которые являются коммерчески доступными (M2 и M16 из Специальные материалы или Sigma), также широко используется.
- Примерно через 48 ч после грунтования PMSG, жертвенность мыши, используя CO 2 седации следуют шейный дислокации, препарировать яичники и их размещение в препаратного стекла содержащие подогретого MEM / ПВП + милринон (MEM / ПВП + M).
- Использование 1 шприц инсулина мл, якорь яичников блюдо и отпустите антральных фолликулов от проколов их несколько раз с 27-калибра (или шитье) иглы, прочно скрепленных.
- Просматривая рассечение микроскопом, собираем кучево-ооцитов комплексов с использованием рта управлением пипетки стекла. Это полезно иметь микроскоп с большим контрастом. Кроме того, среда, содержащая ткани и клетки могут быть пипеткой на крышке пластиковой чашке Петри. Только собирать большие, антральных фолликулов и не меньше, предварительно антральных фолликулов или оголенных ооцитов. После сбора, передачи комплексов микрокапельной из MEM / ПВП + М, который находится на слайде теплее и под масло.
- С помощью небольшой пипеткой (чуть больше, чем диаметр ооцита), пипетку вверх и вниз комплексов отделить клетки кумулюса. Передача оголенный ооцитов с большим пипетки в микрокапельной из CZB + милринон (CZB + M) и поместить в инкубатор.
- Разрешить ооцитов для восстановления, по крайней мере 1 ч в инкубаторе до манипуляции.
2. Ооцитов микроинъекции
- Сделать инъекцию пипетки, потянув боросиликатного стекла капиллярных трубок в механическую съемника. Мы используем Flaming-Браун микропипетки съемник (модель P-97) со следующими параметрами: P = 500, тепло = 300, Pull = 150, Vel = 100, Время = 150.
- Подготовка микроинъекции платформы путем размещения 5 мкл капли MEM / ПВП + M как можно ближе к 0,5 мкл капли инъекции материалом выбора (например, миРНК, кРНК, морфолино олигонуклеотида и т.д.) на 1-камеры также слайд, который имеет средства массовой информации камере удалены. Крышка с минеральным маслом и поставьте на столик микроскопа (рис. 1).
- Место инъекции и проведения пипетки в держатели и положение в капле MEM / ПВП + M. Включите азота танки, которые подключены к picoinjector и антивибрационные таблице. Открытое кончике пипетки инъекций, осторожно нажав на него против проведения пипетки при заполнении его среде. Если отверстие слишком большое, среда будет входить и выходить быстро и иглы убьет клетки. Пипетки со слишком мал открытия часто забивать легко.
- Передача ооцитов (5-10) из инкубатора для MEM / ПВП + М упасть на платформу. До инъекций, установки picoinjector. Мы используем следующие параметры на нашем picoinjector (модель PLI-100 из Гарвардского аппарата): PBal = 2,5-3,5 МПа, PInj = 7,8 фунтов на квадратный дюйм, PClear = 10-12 фунтов на квадратный дюйм, время = 3 сек. Это приводит к инъекции объемом 5-10 рь.
- При нажатии кнопки CLEAR, двигаться инъекционной иглой, чтобы материал падение и заполнить. Верните его к среде капли.
- Используйте проведения пипетки, чтобы захватить яйцеклетку и выровнять инъекционной иглой, яйцеклетки и проведение пипетки вдоль оси абсцисс.
- Под большим увеличением, заранее инъекции через пипетку ооцитов будьте осторожны, чтобы избежать ядра. Как только плазматическая мембрана будет пробит, пресс Инжект. После инъекции снять иглу. Выпуск яйцеклетки и повторите упражнение. После того как все ооциты вводят внутривенно, вернуть их в инкубатор. Держите в CZB + M для желаемого количества времени, на этот раз, зависит от экспериментальных целях (например, миРНК и морфолино нокдауна (до 24 ч), гиперэкспрессия (3-12 ч)). Обратите внимание, что инкубация более 24 ч пойдет на компромисс мейоза созревания.
3. Созревания яйцеклетки
- После инкубации промыть ооциты через несколько капель CZB (созревание среды) и трансфер в микрокапельной созревания среды под маслом и поместить в инкубатор.
- Разрешить 16 ч для полного созревания т о метафазе мейоза II.
4. Плоидность анализ
- Подготовка CZB + monastrol (100 мкМ) и поместите 750 мкл в колодец блюдо органной культуры, что есть вода в наружном кольце.
- Мойте яйца через несколько капель CZB + monastrol и перенести их в блюдо органной культуры. Место в инкубаторе в течение 1 ч.
- Fix яйца путем передачи их в препаратного стекла, содержащего 2% параформальдегида в PBS в течение 20 минут при комнатной температуре. Перевод на другую препаратного стекла с блокирующим раствором. Это блюдо можно хранить при температуре 4 ° С, пока обрабатываются.
- Трансфер в пермеабилизации решение (PBS + 0,3% BSA + 0,1% TritonX-100 + 0,02% NaN 3) в препаратного стекла в течение 15 минут при комнатной температуре. Промойте через несколько больших объемов блокирующий раствор (PBS + 0,3% BSA + 0,01 Твин-20 + 0,02% NaN 3).
- Дальнейшая процедура выполняется на крышке 96-луночного планшета во влажной камере при комнатной температуре, которая защищена от воздействия света. Капли (~ 25 мкл) должны быть размещены внутри круговой углублений. Передача яйца блокирующий раствор на 15 минут.
- Чтобы пометить центромеры, передача яйца каплю раствора, содержащего блокирующий CREST анти-сыворотку в 1:40. Инкубируйте в течение 1 ч. Мойте по 3 капли блокирующим раствором, инкубации 15 минут в каждом.
- Передача яйца каплю раствора, содержащего блокирующий Cy5 или Alexa-фтор-594-сопряженных анти-человеческий IgG (1:200) и выдержать в течение 1 часа. Повторите промывание описанные выше действия, за исключением последнего шага, включают Sytox Зеленый (1:5000) в блокировке решение для обнаружения хромосом. Горы в 5 мкл Vectashield. Для предотвращения дробления яйца, положить 4 маленьких пятен вазелина в углах, где покровное будет. Место покровное на вершине и печать с лаком для ногтей. Хранить в слайд поле при температуре 4 ° С до обработки с помощью конфокальной микроскопии.
- Хотя изображения с 100X цели, захвата 0,4 мкм шаги в Z-плоскости и образ всей области метафазы шпинделя. Граф центромеры использовании для обработки изображений, такие как изображения J (NIH).
5. Представитель Результаты:
Рисунок 2 является Z-проекции из эуплоидных яйцо. В метафазе MII, яйца эуплоидных мыши содержат 20 пары хромосом и, следовательно, есть 40 центромеры. Иногда хромосомы не могут распространяться, несмотря на лечение monastrol. Такая ситуация затрудняет подсчет надежно центромеры и поэтому мы не включают эти яйца в наш анализ. Иногда это может быть сложно определить, является ли CREST-иммунореактивного «пятно» составляет 1 или 2 центромеры. Использование программ, таких как изображения J полезно, потому что можно проанализировать каждый Z-раздел, тщательно отмечая ориентации хромосом, количество секций, в которых «пятно» обнаруживается и интенсивности пикселей "пятна" есть. В зависимости где мейоза шпинделя позиционируется относительно полярного тельца, участки ДНК могут перекрываться, и эти образцы не должны быть включены в анализ.
Unmanipulated, в естественных условиях овуляция яйца из репродуктивно молодых мышей имеют низкие темпы анеуплоидии (~ 1-2%). Однако по причинам, не понял, микроинъекции и в процедурах пробирке созревание может увеличить этот показатель свыше 10%. Поэтому крайне важно, чтобы управление вводится ооцитов включены в любой микроинъекции исследования.

Рисунок 1. Микроинъекция блюдо создана. Камера слайд с 5 мкл капель MEM / ПВП + М чуть выше 0.5μl капель раствора для инъекций. Крышка с минеральным маслом. В этом примере Есть 3 капли для 3-х различных растворов и слайд сидит на стадии микроскоп. Слева находится игла микроинъекции и право проведения пипетки. Обратите внимание, что является отражением иглодержатели.
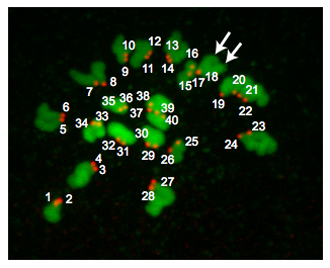
Рисунок 2. Плоидность результаты. Z-проекции эуплоидных яйцо метафазы II. ДНК окрашена в зеленый и кинетохоры окрашены в красный цвет. Стрелки указывают на 2 различных хроматид оружия о том, что кинетохоры (# 17 и # 18) совпадают. Эуплоидных яйца мыши содержат 20 кинетохор пар (40 всего "пятна"). Анеуплоидных яйцо будет содержать какой-либо вариация на это число. Если эта процедура проводились на метафазных ооцитов М. И., не было бы 40 кинетохор пар (80 общий «пятен»).
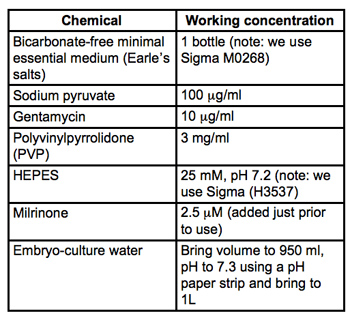
Таблица 1. Рецепт для средних сбора и микроинъекции (MEM / ПВП + M). Все материалы эмбриона-культуры классе и от Sigma-Aldrich. Фильтры стерилизовать через 0.22μm фильтры PVDF (мы используем Milipore Stericups) и хранить при 4 ° C.
iles/ftp_upload/2851/2851table2.jpg "ALT =" Таблица 2 "/>
Таблица 2. Рецепт для средних CZB. Все материалы эмбриона-культуры классе и от Sigma-Aldrich. Фильтры стерилизовать через 0.22μm фильтры PVDF (мы используем Milipore Stericups) и хранить при 4 ° C.
Обсуждение
Микроинъекция ооцитов является мощным средством для изучения механизмов, которые регулируют созревание мейоза 10,11, 12, 13. Этот метод обеспечивает экономичный способ проверки гипотез, до принятия больших инвестиций в развивающиеся трансгенных и целевых моделей мыши. Сбор яйцеклеток и микроинъекции методы требуют больше времени для освоения, чем обычные процедуры клеточной биологии. Конкретные препятствия в сборе часто включают в себя контроль рот пипеткой, потянув надлежащего размера пипетки стеклянные для сбора и удаления из соматических клеток и повышению скорости сбор чтобы свести к минимуму время, в котором ооциты находятся вне инкубатора. Мы рекомендуем практикующим много раз до делать эксперименты. Передача ооцитов между микрокапель при сохранении того же количества клеток является отличным способом привыкнуть к этому методу.
Гибель клеток обычно происходит во время обучения микроинъекции. Это могло произойти по ряду причин, в том числе введения слишком большой объем материала (то есть открытие инъекционной иглы слишком велик), попав ядра с инъекционной иглой, пирсинг противоположную сторону яйцеклетки или иной материал вводят является токсичным для яйцеклетки. Практика с потребителями инъекционных буфера в ооциты пока выживаемость составляет не менее 50% является ключом к освоению этой техники. Если ооцитов не в зрелом вполне вероятно, что милринон не разбавленный достаточно. Мы рекомендуем промывки ооцитов через многие крупные капли милринон без CZB до созревания.
Плоидности микроинъекции следующий анализ является одним из многих тестов для оценки мейоза созревания. Другие анализы рутины мы используем в лаборатории включают мониторинг кинетики которых ооциты прогресс через мейоз, иммунофлюоресценции, чтобы проанализировать формирование веретена и выравнивание хромосом и активация яйца или экстракорпоральное оплодотворение оценить последствия развития яйцеклетки манипуляции 14,15, 16, 17.
Раскрытие информации
Благодарности
Эта работа была проведена в лаборатории Ричарда М. Шульца 'ов. Авторы также хотели бы отметить Майкла Lampson для концептуализации центромеры учета анализа и доступ к его конфокальной микроскопии. Тереза Чан и Франческа Дункан помощь в оптимизации центромеры подсчета анализа. Паула Штайн поддерживается HD022681 (для RMS) и Карен Шиндлера поддерживается HD055822.
Материалы
Таблица специфических реагентов:
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
|---|---|---|---|
| Милринон | Sigma-Aldrich | M4659 | Ресуспендируют в ДМСО на 2,5 мм |
| Минеральное масло | Sigma-Aldrich | M5310 | Используйте только проверенные эмбрионов, стерильные фильтрацией |
| CREST autoserum | Immunovision | НСТ-0100 | |
| Sytox Зеленый | Invitrogen | 57020 | |
| Анти-Alexa 594 человека | Invitrogen | -11014 | |
| Vectashield | Vector Laboratories | H-100 | |
| Параформальдегид | Polysciences | 577773 | |
| Альбумин из бычьего сывороточного | Sigma-Aldrich | A3294 | |
| PMSG | Calbiochem | 367222 | |
| Monastrol | Sigma-Aldrich | M8515 | Ресуспендируют в ДМСО при 100mM |
| Твин-20 | Sigma-Aldrich | 274348 | |
| TritonX-100 | Sigma-Aldrich | X-100 |
Таблица специального оборудования:
| Наименование оборудования | Компания | Номер по каталогу | Комментарии |
|---|---|---|---|
| Мундштук | Biodiseno | MP-001-Y | |
| Препаратного стекла | Электронная микроскопия наук | 70543-30 | |
| Шприц | BD | 309623 | 1 мл, 27G 1 / 2 |
| 60 мм чашки Петри | Сокол | 351007 | |
| Стекло Пастера пипец | Fisher Scientific | 13-678-200 | |
| Сторона теплее | Fisher Scientific | Любая стандартная модель | |
| Препарирование микроскопом | Любая стандартная модель | ||
| Палата слайдов | Nunc | 177372 | |
| Капиллярная трубка | Драммонд | 1-000-0500 | microcaps |
| Внесите Puller | Flaming-Браун микропипетки съемник | Модель P-97 | |
| Инвертационный микроскоп | Nikon | Любая стандартная модель | |
| Микроманипуляторы | Эппендорф | Любая стандартная модель | |
| Picoinjector | Гарвардский аппарата | Модель PLI-100 | Любая стандартная модель |
| CO 2 танка | Для инкубатора | ||
| N2 бак | За столом и инжектор | ||
| Анти-вибростол | Технические Производство | Любая стандартная модель | |
| Инкубатор | Любая стандартная модель | ||
| Холдинг пипетки | Эппендорф | 930001015 | Vacutip |
| Конфокальной микроскопии | Leica | Любая стандартная модель | |
| Dissection инструменты | Изобразительных инструментов науки | Любая стандартная модель | |
| Влажной камере | Мы используем Tupperware | ||
| Крышка 96 ячейках | Nunc | 263339 | |
| Микроскоп слайдов | Fisher Scientific | 12-544-3 | |
| Покровные | Томас научных | 6663-F10 | Толщина варьируется для отдельных микроскопы |
| Центр также блюдо органной культуры | Fisher Scientific | 353037 | 60 X 15 мм |
Ссылки
- Hunt, P. A., Hassold, T. J. . Science. 296 (5576), 2181-2181 (2002).
- Hassold, T., Hall, H., Hunt, P. . Hum Mol Genet. 16 Spec No. 2, R203-R203 (2007).
- Chatot, C. L., Ziomek, C. A., Bavister, B. D. . Journal of reproduction and fertility. 86 (2), 679-679 (1989).
- Schultz, M. R. . Oogenesis and the control of meiotic maturation. , (1986).
- Moore, G. P., Lintern-Moore, S. . Biol Reprod. 18 (5), 865-865 (1978).
- Hodges, C. A., Hunt, P. A. . Chromosoma. 111 (3), 165-165 (2002).
- Schindler, K., Schultz, R. M. . Cell Cycle. 8 (7), 1090-1090 (2009).
- Chiang, T., Duncan, F. E., Schindler, K. . 20 (17), 1522-1522 (2010).
- Mayer, T. U., Kapoor, T. M., Haggarty, S. J. . Science. 286 (5441), 971-971 (1999).
- Stein, P. . Cold Spring Harbor protocols. 2009 (1), pdb prot5135-pdb prot5135 (2009).
- Stein, P. . Cold Spring Harbor protocols. 2009 (1), pdb prot5132-pdb prot5132 (2009).
- Reis, A., Chang, H. Y., Levasseur, M. . Nat Cell Biol. 8 (5), 539-539 (2006).
- Schuh, M., Ellenberg, J. . Cell. 130 (4), 484-484 (2007).
- Backs, J., Stein, P., Backs, T. . Proceedings of the National Academy of Sciences of the United States of America. 107 (1), 81-81 (2010).
- Schindler, K., Schultz, R. M. . Biol Reprod. 80 (4), 795-795 (2009).
- Kudo, N. R., Wassmann, K., Anger, M. . Cell. 126 (1), 135-135 (2006).
- Shoji, S., Yoshida, N., Amanai, M. . The EMBO Journal. 25 (4), 834-834 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены