Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Единый Drosophila Омматидия Препарирование и обработка изображений
В этой статье
Резюме
Ограничивающим фактором в использовании взрослых Drosophila Глаза на исследование нейродегенерации и клеточной биологии трудно визуализации внутриклеточных процессов. Мы описываем вскрытия одного омматидии генерировать добросовестных первичной культуры клеток нейронов, которые могут быть предметом лечения наркозависимости и Advanced Imaging.
Аннотация
Плодовой мушки дрозофилы сделал неоценимый вклад в неврологии исследования и широко используется в качестве образца для нейродегенеративных заболеваний из-за своей мощной генетике 1. Летать глаз, в частности, была органом выбор для нейродегенерации исследования, являясь самым доступным и жизни необязательной частью дрозофилы нервной системы. Однако основные предостережение интактных глаз трудности, из-за интенсивной флуоресценции от пигмента, в визуализации внутриклеточных событий, таких как аутофагии динамики 2, которые имеют огромное значение для понимания нейродегенерации.
Недавно мы использовали вскрытие и культура одного омматидии 3, что имеет огромное значение для нашего понимания autophagic нарушений в летают модель Dentatorubro-Pallidoluysian Атрофия (DRPLA) 3, 4.
Теперь отчет с подробным описанием этого метода (рис. 1), адаптированных с электрофизиологических исследований 5, который, скорее всего, значительного расширения возможности летать модели нейродегенерации. Этот метод может быть адаптирован к изображению живой субклеточных событий и следить за эффективным приемом препаратов на клетки фоторецепторов (рис. 2). При использовании в сочетании с мозаикой методов 6-8, ответы генетически различных клеток может быть проанализированы параллельно (рис. 2).
протокол
1. Препарирование сетчатки дрозофил
- Заполните одну лунку 3-Ну стекло с фосфатным буферным раствором (PBS 1X), а затем анестезию пролетает CO 2. И мужчины и женщины могут быть использованы для этого эксперимента.
- Как только мухи под наркозом, забрать одну лету с помощью щипцов и поместите его в блюдце с PBS.
- Под рассекает сферу, щепотка хоботок щипцами, а затем отделить голову от тела разрыва шею, используя второй набор щипцов.
- Холдинг лететь головы от хоботок, разрезанные на половинки по левой / правой средней линии летать голову microscissors выявить мозга.
- Используйте кончик пипетки вырезать, чтобы забрать сетчатке, и трансфер второй скважины на 3-Ну стекло заполнено средой Шнайдер.
- Во-первых, удаляйте большинство из головы кутикулы, а затем удалить мозг щипцами. Держите сетчатки зажатой между пластинкой и роговицы.
- Далее, передача сетчатки на каплю (50 мкл) свежей среды Schnieder размещаются непосредственно на стекле.
2. Препарирование омматидии
- В зависимости от конечной целью вскрытия (как немедленной визуализации или культуры) и на оптику флуоресцентного микроскопа (прямой или инвертированный), этот шаг может иметь место либо на предметное стекло или в 24-луночного планшета. Для конечной целью этого вскрытия, омматидии будет расчлененный непосредственно на стекло.
- Возьмите любой самый спинной или нижним концом сетчатки щипцами. Использование microscissors, вырезать сетчатки пополам вдоль спины / вентральной срединной линии подвергать омматидиев в середине глаза.
- Продолжить понять сетчатки, что роговица вниз, а пластинка вверх. Использование тонкой иглой вольфрама, отделить омматидиев от пластинки и роговицы.
- Одноместный омматидиев и группы омматидиев будет собирать на дне колодца или слайд. Удалите все больше мусора, которые могут иметь собранные перед началом работы.
3. Лечение, окрашивания и обработки изображений
- Для анализа аутофагии, разбавленных 1:1000 Lysotracker в раскрывающемся Шнайдер (первый разбавленным 1:10 в Шнейдера, а затем добавить 0,5 мкл до падения на слайде), перемешайте и подождите 10 секунд.
- Удаление избыточной жидкости из слайдов, стараясь оставить омматидии позади. Это делается лучше всего с тонкой наконечником загрузке геля.
- Добавить каплю Vectashield для покрытия омматидиев, применять покровное и печать с nailpolish.
4. Представитель Результаты:
Хорошее исполнение протокола должны оставить число единичных омматидиев и малых групп омматидиев хранится вместе фрагментами пластинки, но красиво разделены на роговице стороны. Они могут быть отображены как в этом примере наглядно Atg8: GFP и Lysotracker, показывая autophagosomes, лизосомы и autophagolysosomes (рис. 3). Метод может быть использован для живого изображения, однако в этом случае следует отметить, что аутофлюоресценция среднего Шнайдера будет трудно отличить низкой интенсивности флуоресцентных сигналов. Дополнительного выпуска является то, что пигментные гранулы, которые остаются прикрепленными к фоторецепторов интенсивно люминесцентные, особенно в красном канале. Картина светлого может потребоваться, чтобы отличить их от подлинных органелл.
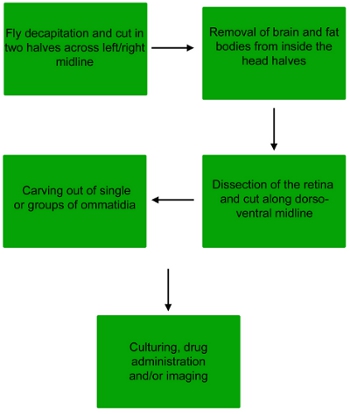
Рисунок 1. Блок-схема вскрытия процедура получения одного омматидия или небольшие группы омматидиев от летают сетчатки.
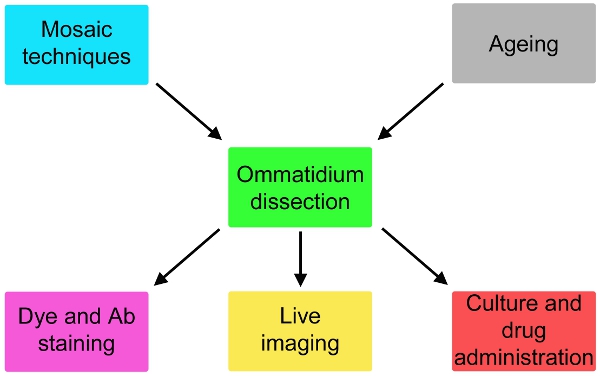
Рисунок 2. Возможные вариации простой протокол здесь описывать, которые включают летать генетики старения и вверх по течению от вскрытия и окрашивание или культивирование в течение 24 часов и введения препарата ниже по течению от вскрытия.
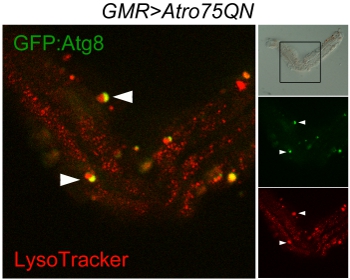
Рисунок 3 конфокальной проверки autophagosomes и лизосом в одном омматидия расчлененный от AW; GMR-Gal4, UAS-Atro75QN; UAS-GFP.:: Atg8 / + летают, выражая полиглутаминовых Atrophin мутанта и в возрасте 12 дней при температуре 29 ° C. Панель светлого (вверху справа) показывает почти нетронутыми структуры омматидия и кадров указывает сканируемой области. Красный знаки Лизосомы, зеленый autophagosomes, авто-лизосом, в результате чего в результате слияния двух органелл, появляются желтые. Стрелки указывают на двух текущих событий слияние autophagosomes и лизосомы.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Одно рассечение омматидия представленные здесь коллекции позволяет более глубокой биологической ячейки информацию о процессах, как нейродегенеративные, когда моделируется в глазу дрозофилы. Фоторецепторных нейронов более доступной, чем в других нейронов и их цитоплазме особен...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим Бернар Charroux для дискуссий. Эта работа финансировалась KCL биомедицинских школы.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (необязательно) |
|---|---|---|---|
| Портативный CO2 диспенсер | Flystuff | 59-150 | Вкладыши также доступны |
| ДЮМОН Пинцет № 5 | Агар Научно | T5034 | |
| 3-Ну предметное стекло | EMS | 71561-01 | |
| Micro ножницы | VWR | HAMMHSB516-09 | |
| Шнайдера среднего | VWR | 733-1663 | |
| LysoTracker Красной DND-99 | Invitrogen | L7528 | |
| SuperFrost Слайды | VWR | 631-0108 | |
| Vectashield с DAPI | Векторные Labs | H-1200 | |
| Покровные | VWR | 631-1336 |
Ссылки
- Marsh, J. L., Thompson, L. M. Drosophila in the study of neurodegenerative disease. Neuron. 52, 169-178 (2006).
- Mizushima, N., Levine, B., Cuervo, A. M., Klionsky, D. J. Autophagy fights disease through cellular self-digestion. Nature. 451, 1069-1075 (2008).
- Nisoli, I. Neurodegeneration by polyglutamine Atrophin is not rescued by induction of autophagy. Cell Death Differ. 17, 1577-1587 (2010).
- Charroux, B., Fanto, M. The fine line between waste disposal and recycling: DRPLA fly models illustrate the importance of completing the autophagy cycle for rescuing neurodegeneration. Autophagy. 6, 667-669 (2010).
- Hardie, R. C. Voltage-sensitive potassium channels in Drosophila photoreceptors. J Neurosci. 11, 3079-3095 (1991).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker (MARCM) for Drosophila neural development. Trends in neurosciences. 24, 251-254 (2001).
- Xu, T., Rubin, G. M. Analysis of genetic mosaics in developing and adult Drosophila tissues. Development. 117, 1223-1237 (1993).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Dev Biol. 351, 128-1234 (2011).
- Napoletano, F. Polyglutamine Atrophin provokes neurodegeneration in Drosophila by repressing fat. The EMBO journal. 30, 945-958 (2011).
- Ravikumar, B. Inhibition of mTOR induces autophagy and reduces toxicity of polyglutamine expansions in fly and mouse models of Huntington disease. Nature. 36, 585-595 (2004).
- Zou, S., Meadows, S., Sharp, L., Jan, L. Y., Jan, Y. N. Genome-wide study of aging and oxidative stress response in Drosophila melanogaster. Proceedings of the National Academy of Sciences of the United States of America. 97, 13726-13731 (2000).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены