Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
In Vitro Система по изучению опухолей покоя и Переключить на рост метастазов
В этой статье
Резюме
Изменение 3-D в пробирке система представлена в которых рост характеристики нескольких опухолевых клеточных линий в разведенной базальной мембраны коррелирует с спящих или пролиферативного поведения опухолевых клеток при метастатической вторичный узел В естественных условиях.
Аннотация
Recurrence of breast cancer often follows a long latent period in which there are no signs of cancer, and metastases may not become clinically apparent until many years after removal of the primary tumor and adjuvant therapy. A likely explanation of this phenomenon is that tumor cells have seeded metastatic sites, are resistant to conventional therapies, and remain dormant for long periods of time 1-4.
The existence of dormant cancer cells at secondary sites has been described previously as quiescent solitary cells that neither proliferate nor undergo apoptosis 5-7. Moreover, these solitary cells has been shown to disseminate from the primary tumor at an early stage of disease progression 8-10 and reside growth-arrested in the patients' bone marrow, blood and lymph nodes 1,4,11. Therefore, understanding mechanisms that regulate dormancy or the switch to a proliferative state is critical for discovering novel targets and interventions to prevent disease recurrence. However, unraveling the mechanisms regulating the switch from tumor dormancy to metastatic growth has been hampered by the lack of available model systems.
in vivo and ex vivo model systems to study metastatic progression of tumor cells have been described previously 1,12-14. However these model systems have not provided in real time and in a high throughput manner mechanistic insights into what triggers the emergence of solitary dormant tumor cells to proliferate as metastatic disease. We have recently developed a 3D in vitro system to model the in vivo growth characteristics of cells that exhibit either dormant (D2.OR, MCF7, K7M2-AS.46) or proliferative (D2A1, MDA-MB-231, K7M2) metastatic behavior in vivo . We demonstrated that tumor cells that exhibit dormancy in vivo at a metastatic site remain quiescent when cultured in a 3-dimension (3D) basement membrane extract (BME), whereas cells highly metastatic in vivo readily proliferate in 3D culture after variable, but relatively short periods of quiescence. Importantly by utilizing the 3D in vitro model system we demonstrated for the first time that the ECM composition plays an important role in regulating whether dormant tumor cells will switch to a proliferative state and have confirmed this in in vivo studies15-17. Hence, the model system described in this report provides an in vitro method to model tumor dormancy and study the transition to proliferative growth induced by the microenvironment.
протокол
1. Клеточные культуры поддержание покоя и метастатических опухолевых клеточных линий
- Расти неактивные (D2OR / MCF7/K7M2-AS.46) и метастатических опухолевых клеток (D2A1 / MDA-MB-231 / K7M2) в 10 см культуры чашки, содержащие Средний Дульбеко изменения Орла (DMEM) высокий уровень глюкозы и 10% эмбриональной телячьей сыворотки ( FBS) и антибиотики. Как только клетки достигают 70-80% слияния, переходите к следующей анализов.
2. Пролиферации клеток анализа покоящихся (в состоянии покоя) и метастатические (пролиферирующих) опухолевые клетки культивировали в 3D-BME системы
Культивирование спящие / метастатических клеток в 3D-системе
- Оттепель Cultrex фактор роста снижение базальной мембраны экстракт (BME) в 4 ° C холодильнике ночь перед проведением анализа. Обратите внимание, BME должны решаться на льду во все времена.
- На следующий день, место 96 ячейках на подносе льда внутри ламинарного капотом. Пальто каждую лунку с 50-100 мкл ледяной BME использовании дозатора с помощью шприца. Убедитесь в отсутствии пузырьков образуются в скважинах. Место 96-луночного планшета покрыта BME в увлажненной инкубаторе с 5% CO 2 при 37 ° С в течение 30 минут.
- В то же время аспирации средств массовой информации из спящих и или метастатическим опухолевым клеткам (подготовлен в разделе 1). Промыть культуры пластин с 10 мл физраствора с фосфатным буфером, рН 7,4 (PBS). Аспирируйте PBS и добавьте 2 мл трипсина предварительно нагревают при 37 ° С, к культуре пластин. Инкубируйте пластин в увлажненной 5% CO 2 при 37 ° С, в течение 5 мин.
- Передача клетки 15 мл коническую трубку с 5 мл DMEM высокий уровень глюкозы с добавлением 10% FCS и антибиотиков и подсчет клеток.
- Спином вниз общего числа клеток, чтобы быть культурными в центрифуге культуры ткани со скоростью 1500 г, при комнатной температуре в течение 5 мин. В наших тестах мы готовим 2-10 3 клеток / лунку для каждой клеточной линии или момент времени на обследование. Однако, это может варьироваться в зависимости от клеточных линий используются.
- Тщательно аспирата супернатант. Обратите внимание, что в большинстве случаев гранулы не видно. Таким образом, оставить некоторые СМИ позади. Нажмите внизу 15мл коническую трубку пальцами, чтобы приостановление отдельных клеток получается. Повторное приостановить гранул с DMEM низкий уровень глюкозы с помощью антибиотиков с добавлением 2% FCS + 2% BME (анализ СМИ). 100 мкл анализа СМИ должны быть добавлены для каждого 2x10 3 клетки. Измельченного в порошок клетках много раз с 5 мл пипетки, чтобы суспензии отдельных клеток сохраняется.
- Пластина 100 мкл Смесь клеток на лунку в верхней части 96-BME покрытием пластины. Для оценки фона (в разделе 2.8) знаке, помимо 100 мкл на лунку только анализ средств массовой информации на вершине 96-BME покрытием пластины. Инкубируйте культурный 96-луночных в увлажненной 5% CO 2 инкубаторе при температуре 37 ° C. Клетки должны быть повторно подается каждые 4 дня с анализа СМИ.
Распространение анализа:
- Распространение анализа клеток: добавить в скважинах в заданное время точках 20 мкл сотовый Титр 96 Водные одно решение сотовый комплект анализа распространения. Инкубируйте в увлажненной 5% CO 2 инкубаторе при температуре 37 ° С в течение 2 часов. Использование чтения ИФА записи абсорбции при 490nm. Для оценки фона и вычитание, добавить 20 мкл сотовый Титр 96 Водные одно решение сотовый комплект анализа распространения в лунки предварительно покрытых BME и только обложил анализа СМИ. Использование чтения ИФА рекорд оптической плотности при 490 нм.
3. Иммунофлуоресцентного окрашивания для сотовых сигнальных молекул в латентной (в состоянии покоя) опухолевых клеток и / или метастатическим (пролиферирующих) опухолевых клеток
Культивирование спящие / метастатических клеток в 3D-система для окрашивания immunfluorescence
* Следующий протокол является модификацией 3D протокол культуры опубликованные Debnath J и др. 18.
- Подготовка BME, как описано в разделе 2.1. На следующий день: место 8-камера стекло системы на подносе льда внутри ламинарного капотом. Пальто каждую лунку с 50ul ледяной BME использовании 200 мкл pipetman. Убедитесь в том, BME распространяется равномерно и без пузырьков образуются в скважинах. Место 8 камеры стекло с покрытием BME в увлажненной 5% CO 2 при 37 ° С в течение 20 мин.
- Урожай покоя и метастатических клеток или из раздела 1 и подготовиться к культуре, как описано в разделе 2.3-2.4. Сбор общее количество ячеек, которые будут культивироваться в 15 мл коническую трубку. Мы готовим 5 х10 3 клеток / лунку для каждой клеточной линии и момент времени для анализа. Спином вниз клеток в культуре ткани центрифуги со скоростью 1500 г, при комнатной температуре в течение 5 мин. Аспирируйте supernate тщательно. Обратите внимание, что шарик не видно, поэтому оставить некоторые СМИ позади. Нажмите внизу 15мл коническую трубку пальцами, чтобы суспензии отдельных клеток получается.Повторное приостановить гранул с анализа СМИ. 400μl из анализа СМИ должны быть добавлены для каждого 5x10 3 клетки. Измельченного в порошок клетках много раз с 5 мл пипетки. Этот шаг очень важно обеспечить, чтобы суспензии отдельных клеток сохраняется.
- Пластина 400μl ячейки смеси в каждую лунку на вершине каждого из 8 камер покрыты BME. Инкубируйте культурный 8 камер стекло системы в увлажненной 5% CO 2 инкубаторе при температуре 37 ° C. Клетки должны быть повторно подается каждые 4 дня с анализа СМИ.
Иммунофлуоресценции окрашивания:
- В нужном моменты времени, аспирация верхний слой медиа и добавьте 200 мкл фиксатором, содержащий 4% Параформальдегид (PFA), 5% сахарозы и 0,1% Тритон Х-100 и инкубировать при комнатной температуре в течение 5 минут. Аспирируйте фиксатором и добавить 200 мкл 4% PFA, содержащий 5% сахарозы и инкубировать при комнатной температуре в течение 25 минут.
- Аспирируйте фиксатором, добавить 400 мкл фосфатно-солевым буфером (PBS) в каждую лунку. Инкубируйте в течение 10 минут при комнатной температуре. Аспирируйте PBS и добавьте 400 μ PBS, содержащем 0,05% Твин-20 в течение 10 минут при комнатной температуре.
- Блок фиксированных клетках при комнатной температуре с 200 мкл или 10% осла сыворотки или с 3% BSA в 1 час (блокирование решения, которое будет использоваться, должны быть определены эмпирически для каждого первичного антитела).
- Аспирируйте блокирующий раствор и добавляют 200 мкл первичных антител (разведение определяется эмпирически для каждого первичного антитела, которые будут использоваться). Развести первичных антител в 10% сыворотки осла, если 10% сыворотки осла была использована для блокирования или разбавленный первичных антител в 3% BSA, если 3% BSA блокирующий раствор был использован. Инкубируйте с первичным антителом течение ночи при 4 ° C.
- Аспирируйте антител, мыть скважин с 400μl PBS в течение 15 минут и повторите дважды. Аспирируйте PBS и добавьте 200 мкл осла против соответствующего-IgG конъюгированных с родамин красный (разведение определяется эмпирически), крышка камеры 8 слайд с алюминиевой фольгой и инкубировать в течение 1 часа при комнатной температуре.
- Вымойте скважин с 400μl PBS (3x15 минут каждого мытья). Аспирируйте PBS. Крепится VECTASHIELD монтажа среде с DAPI. Сухой слайды в течение 40 минут при комнатной температуре в темноте. Слайды могут храниться в течение 1 недели при температуре 4 ° C. Хранить слайды в темноте. Изображение слайды с помощью конфокальной микроскопии.
4. Представитель Результаты:
Примером распространения анализ спящие D2.0R и метастатических опухолевых клеток D2A1 в 3D культура показана на рисунке 1А. D2.0R клетки находятся в состоянии покоя (в состоянии покоя) в течение всего экспериментального периода 14 день, в то время как культура высокой метастатической D2A1 спящие клетки остаются только в течение четырех-шести дней, после чего они начинают размножаться. Во время начальной фазы спящие, многие клетки остаются одиночные, на 3-D культуре (рис. 1Б; 4-й день), тогда как другие не пролиферирующие клетки образуются многоклеточные сфероидов. Переход D2A1 клетками спящих на пролиферативные состояния в 3-D культуре (рис. 1В, день 12) связано с драматическим изменениям в морфологии клеток. Таким образом, этот анализ может быть использован для тестирования какой фактор / с может спровоцировать спящие клетки D2.0R выйти из их состоянии покоя и то, что фактор / с может предотвратить D2A1 клетки к переходу от их состояния покоя. Рисунок 2 является примером агента предотвращение D2A1 клетки к переходу из покоящихся на пролиферативные состояния. Как показано на рисунке 2, лечения D2A1 клетки специфического ингибитора легких цепей миозина киназы (ML-7) поддерживать D2A1 клетки в состоянии покоя.
Сотовые сигнализации в состоянии покоя и пролиферирующие опухолевые клетки культивировали в 3D-системе могут быть изучены с помощью иммунофлуоресценции окрашивания для сотовых сигнальных молекул. Как показано на рисунке 3 значительному увеличению фосфорилирования миозина легкой цепи в D2A1 клеток (красное окрашивание) с последующей реорганизацией F-актиновых филаментов актина формирования стресс волокон (зеленая окраска) происходит во время их перехода из состояния покоя (1-4 дней) Распространение (день 7). Тем не менее, блокирование легких цепей миозина активности киназы в клетках D2A1 shRNA или конкретного препарата (ML-7) сохраняет D2A1 клетки в состоянии покоя и в результате ингибирования фосфорилирования миозина свет цепи и F-актин стресс волокна организации (рис. 4).
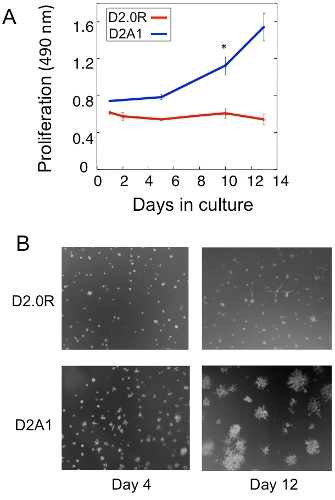
Рисунок 1. В пробирке модель для изучения одиночной покоя опухолевых клеток и переход к метастазирования. ) Распространение спящие D2.0R и метастатического D2A1 в 3-D Cultrex BME, п = 8 (среднее ± SE). Представитель результаты трех экспериментов (* р ≤ 0,05). Б) Свет изображений микроскопии D2.0R и D2A1 клетки культивировали в 3-D x20 Cultrex BME увеличения.Рис редактировался Баркан и др. 17.
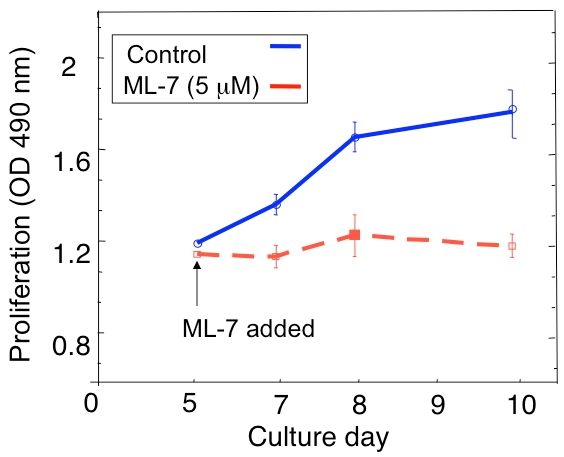
Рисунок 2. Предотвращение выключатель D2A1 клетки из состояния покоя (покоя) для распространения в 3D-системе культуры путем ингибирования легких цепей миозина киназы (MLCK). Время хода D2A1 пролиферации клеток культивировали в 3-D Cultrex BME, п = 8 (среднее ± SE). Клетки необработанных (контроль), или обработать специфический ингибитор MLCK (ML-7, 5 мкМ) в течение 48 часов начиная с 5-й день культуры. Рис редактировался Баркан и др. 17.
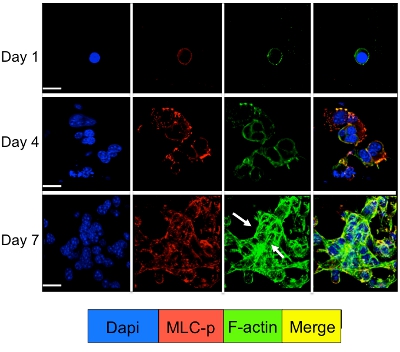
Рисунок 3. Миозин света фосфорилирования цепи следует F-актин реорганизации во время переключения из D2A1 клетки из состояния покоя и пролиферативной роста. D2A1 клетки культивировали в 3-D Cultrex BME на 8 предметное стекло камеры. Клетки фиксировали и окрашивали DAPI (синий) для ядерной локализации, фаллоидином (зеленый) для F-актин и с антителами против фосфорилированных форме легких цепей миозина (MLC-р) (красный), как указано в различные моменты времени. Слияние F-актин, а MLC-р окрашивания (желтый). Выражение MLC-р была увеличена при переходе D2A1 клетки из состояния покоя (days1-4) для пролиферативной роста (7-й день) с последующим актина стресс формования волокна (стрелки). Конфокальной микроскопии, увеличение x63. Белый бар равен 20 микрон. Рис редактировался Баркан и др. 17.
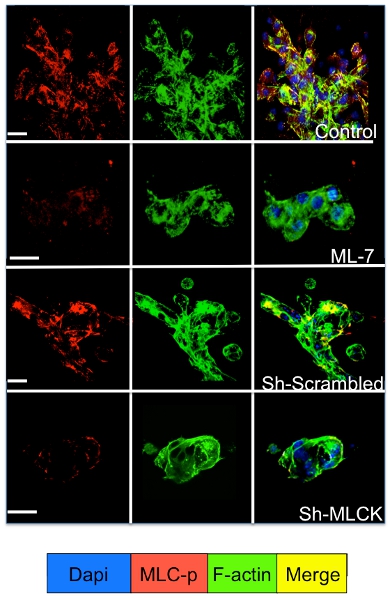
Рисунок 4. . Ингибирование легких цепей миозина киназы (MLCK) опосредованы F-актин стресс волокна образования в D2A1 клетки D2A1 Клетки необработанных (контроль), или лечение с ингибитором для MLCK (ML-7, 5 мкМ), в течение 48 часов начиная с культурой день 5, или лечение с яичницей или MLCK shRNA и витражей для фосфорилированных форме легких цепей миозина (MLC-р) (красный), F-актин (зеленый), и ядра (синий). Слияние F-актин, а MLC-р окрашивания (желтый). Конфокальной микроскопии, увеличение x63. Белый бар равен 20 микрон.
Обсуждение
Основные механизмы, которые поддерживают распространяются опухолевые клетки в состоянии покоя или привести к их переходу к метастатического роста остаются малоизвестными. Это явление было чрезвычайно трудно учиться в человеческих пациентов 4,12 и несколько доклинических модел?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Работа выполнена при частичной поддержке Внутренние программы исследований Национального института рака.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
|---|---|---|---|
| DMEM высокий уровень глюкозы в | Invitrogen | 11965-118 | |
| DMEM низкий уровень глюкозы | Invitrogen | 11885-092 | |
| Фетальной телячьей сыворотки (FBS) | Invitrogen | 10091-148 | |
| Фактор роста снижается 3-D Cultrex базальной мембраны Извлечение | Trevigen ООО | Концентрация белка между 14-15mg/ml | |
| D2.0R и D2A1 клеточных линий | 5,19 | ||
| K7M2 и K7M2AS1.46 клетки | 20 | ||
| MCF-7 и MDA-MB-231 клеток рака молочной железы | АТСС | ||
| 8 камеры стекло системе | (Лаборатория-ТЭК, Thermo Scientific) | 177402 | |
| Сотовые Титр 96 Водные одно решение пролиферации клеток анализа комплект | Promega | G3580 | |
| VECTASHIELD монтажа среде с DAPI | Векторные Laboratories, Inc | H-1200 | |
| Нормальная осла сыворотке | Джексон ImmunoResearch | 017-000-121 | |
| Elisa ридер | Bio-Tec | Запись 490nm | |
| Конфокальной микроскопии | Цейсс-LSM-510 | Увеличение x63 |
Ссылки
- Aguirre-Ghiso, J. A. Models, mechanisms and clinical evidence for cancer dormancy. Nat Rev Cancer. 7, 834-846 (2007).
- Pantel, K., Woelfle, U. Micrometastasis in breast cancer and other solid tumors. J Biol Regul Homeost Agents. 18, 120-125 (2004).
- Naumov, G. N. Ineffectiveness of doxorubicin treatment on solitary dormant mammary carcinoma cells or late-developing metastases. Breast Cancer Res Treat. 82, 199-206 (2003).
- Klein, C. A. Framework models of tumor dormancy from patient-derived observations. Curr Opin Genet Dev. , (2010).
- Naumov, G. N. Persistence of solitary mammary carcinoma cells in a secondary site: a possible contributor to dormancy. Cancer Res. 62, 2162-2168 (2002).
- Townson, J. L., Chambers, A. F. Dormancy of solitary metastatic cells. Cell Cycle. 5, 1744-1750 (2006).
- Chambers, A. F., Groom, A. C., MacDonald, I. C. Dissemination and growth of cancer cells in metastatic sites. Nat Rev Cancer. 2, 563-572 (2002).
- Pantel, K. Differential expression of proliferation-associated molecules in individual micrometastatic carcinoma cells. J Natl Cancer Inst. 85, 1419-1424 (1993).
- Demicheli, R. Tumour dormancy: findings and hypotheses from clinical research on breast cancer. Semin Cancer Biol. 11, 297-306 (2001).
- Braun, S. A pooled analysis of bone marrow micrometastasis in breast cancer. N Engl J Med. 353, 793-802 (2005).
- Pantel, K., Alix-Panabieres, C., Riethdorf, S. Cancer micrometastases. Nat Rev Clin Oncol. 6, 339-351 (2009).
- Goss, P. E., Chambers, A. F. Does tumour dormancy offer a therapeutic target. Nat Rev Cancer. 10, 871-877 (2010).
- Mendoza, A. Modeling metastasis biology and therapy in real time in the mouse lung. J Clin Invest. 120, 2979-2988 (2010).
- Naumov, G. N. A model of human tumor dormancy: an angiogenic switch from the nonangiogenic phenotype. J Natl Cancer Inst. 98, 316-325 (2006).
- Barkan, D. Metastatic growth from dormant cells induced by a col-I-enriched fibrotic environment. Cancer Res. 70, 5706-5716 (2010).
- Barkan, D., Green, J. E., Chambers, A. F. Extracellular matrix: A gatekeeper in the transition from dormancy to metastatic growth. Eur J Cancer. , (2010).
- Barkan, D. Inhibition of metastatic outgrowth from single dormant tumor cells by targeting the cytoskeleton. Cancer Res. 68, 6241-6250 (2008).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30, 256-268 (2003).
- Morris, V. L. Mammary carcinoma cell lines of high and low metastatic potential differ not in extravasation but in subsequent migration and growth. Clin Exp Metastasis. 12, 357-367 (1994).
- Khanna, C. The membrane-cytoskeleton linker ezrin is necessary for osteosarcoma metastasis. Nat Med. 10, 182-186 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены