Method Article
Использование прав Периваскулярная стволовых клеток для регенерации костной
* Эти авторы внесли равный вклад
В этой статье
Резюме
Периваскулярных человека стволовые клетки (ЭСК) представляют собой клетки роман стволовых класс для регенерации тканей скелета похожа на мезенхимальные стволовые клетки (МСК). ЭСК могут быть выделены путем FACS (флуоресценция активированный сортировки клеток) из жировой ткани, закупаемых в стандартной процедуры липосакции, то в сочетании с остеоиндуктивных лесов для достижения формирования костей В естественных условиях.
Аннотация
Периваскулярных человека стволовые клетки (ЭСК) могут быть выделены в достаточном количестве из различных тканей для целей скелетных тканевой инженерии 1-3. ЭСК являются FACS-отсортированы населения "перицитов (CD146 + CD34-CD45-) и« адвентиции клеток (CD146-CD34 + CD45-), каждый из которых мы уже сообщали, чтобы иметь свойства мезенхимальных стволовых клеток. ЭСК, как МСК, могут пройти остеогенной дифференцировки, а также выделять про-остеогенной цитокинов 1,2. В настоящее время протокол, мы демонстрируем osteogenicity ЦПФ в нескольких моделях животных, включая имплантацию мышц сумка в SCID (тяжелые комбинированные иммунодефицитные) мышей SCID мышей свода дефектов и бедра сегментарный дефект (ФСД) в бестимусных крыс. Сумка мышцу бедра модель используется для оценки внематочной формирования костей. Свода дефекты сосредоточены на теменной кости и стандартно 4 мм в диаметре (критический размер) 8. FSDs являются bicortical и стабилизироваласьбар полиэтилена и K-провода 4. FSD описаны также является важным размера дефекта, который не оказывает существенного заживать сама по себе 4. С другой стороны, если стволовые клетки или факторы роста будут добавлены в дефект сайта, значительная регенерации кости могут быть оценены. Общая цель xenografting PSC является демонстрация возможностей остеогенной этого типа клеток в обоих внематочной и ортотопической модели регенерации кости.
протокол
1. Периваскулярная Выделение стволовых клеток
Это подробно описано в соседней статье "Очистка Периваскулярная стволовых клеток человека из белой жировой ткани", М. Corselli соавт.
2. Создание лесов
- Строительные леса на заказ в ранее опубликованных протоколов из поли (молочной-со-гликолевой кислоты) (PLGA, Burmingham полимер) с покрытием 4-6 гидроксиапатита. Апатит покрытием PLGA леса изготавливаются из 85/15 PLGA растворителем литья и процесс выщелачивания частиц. Строительные леса, создаются в сферической формы (2 мм в диаметре) для мышечной сумке имплантации, дискоидная формы (диаметром 4 мм) для свода имплантации, или цилиндрических (диаметром 4 мм, 6 мм в длину) для бедренных сегментарных дефектов.
- Короче говоря, PLGA / хлороформ решения смешанной с сахарозой (полимер / сахароза соотношение 5/95, в / в) подаются в 200-300-мкм в диаметре тефлоновые формы для создания заказных минусытракте. После сублимационной сушки в течение ночи, леса удаляют из формы тефлон и погружается в DDH 2 O растворить сахарозу. Леса дезинфицируют путем погружения в 70% этаноле в течение 30 мин, затем три полоскания в DDH 2 O.
- Для апатита покрытия, моделирование жидкости организма (SBF) раствор готовят последовательным растворением 2 CaCl, MgCl 2 • 6H 2 O, NaHCO 3, K 2 HPO 4 • 3H 2 O в DDH 2 O. Решение рН снижается до 6, добавив 1М соляной кислоты для увеличения растворимости. Na 2 SO 4, KCl, NaCl и добавляются и окончательное рН доводят до 6,5 (SBF 1).
- Mg 2 + и HCO 3 - бесплатно SBF (SBF 2) получают путем добавления CaCl 2 и K 2 HPO 4 • 3H 2 O в DDH 2 O и рН снижается до 6. KCl и NaCl добавляется и окончательное рН доводят до 6,8. Все решения являются стерильными фильтруют через 0,22 мкм PES membrANE (Nalgene). Непосредственно перед началом процесса нанесения покрытия, сухие строительные леса PLGA подвергаются тлеющем разряде аргона плазменного травления (Harrick Научно) для улучшения смачивания и покрытия единообразия.
- Гравированный леса, затем инкубировали в SBF 1 за 12 ч и перешли на Mg 2 + и HCO 3 - бесплатно SBF 2 еще 12 ч при температуре 37 ° С при легком помешивании. Покрытые лесом промывают DDH 2 O, чтобы удалить избыток ионов и лиофилизируют до дальнейших исследований.
3. Модель мышц Чехол имплантации
- 100 мкл суспензии PSC в PBS (фосфатный буферный раствор) мягко упала на сферической PLGA основе имплантата непосредственно перед имплантацией. Клетки были предварительно помечены лентивирусов вставки Светлячок люциферазы, с тем чтобы обеспечить в естественных условиях отслеживания после имплантации. Сотовые плотностью 2,5 · 10 5 на имплантат.
- SCID (тяжелым комбинированным иммунодефицитом) мышей используются в возрасте 6 недель. Животные ANESthetized по ИФ вдыхании и premedicated с бупренорфин (Bedford Labs). После стандартного препарата Бетадин, двусторонних разрезов в задних конечностей производятся (продольных и 2 мм в длину).
- Карманы режутся в двуглавой мышцы бедра на тупое рассечение параллельно на мышечное волокно длинной оси. Для каждой мыши, PLGA основе имплантата с СРП установлена, и фасции покрывающей мышцы зашивается с 5-0 Викрил (Ethicon).
- Кожа следующий закрыта с 5-0 Викрил в подкожный картины. Животные лечатся после операции с бупренорфин в течение 48 часов и TMP / SMX (триметоприм / сульфаметоксазол, QualiTest) в течение 10 дней.
4. Имплантация свода модели дефектов
- После ИФ анестезии SCID мышей (12-14 недель), волосы обрезаются и дезинфицируют кожу бетадин в протокол.
- 8-мм разрез кожи производится по средней сагиттальной шва черепа мыши. Далее, CalvArial надкостница осторожно удалить Q-Tip приложения.
- Далее, используя алмазный трепана бит в высокоскоростной бормашины, 4 мм дефект теменной кости создается. Дефект полной толщины - Однако внимание уделяется не повредить основной твердой мозговой оболочки.
- Заказ PLGA основе имплантата с насаждаемое ЭСК помещается мягко дефекта сайта. Сотовые плотностью 2,5 · 10 5 на имплантат. Наконец, кожа зашивается с 6-0 Викрил. Животные лечатся после операции с бупренорфин в течение 48 часов и TMP / SMX течение 10 дней.
5. Бедренной Сегментные Имплантация модели дефектов
- Бестимусных крыс (12-14 недель) анестезируют под ИФ ингаляции. Бедра промывается и готовые в стандартный протокол с бетадин (рис. 1).
- 27-30-мм продольный надрез на переднебоковой бедренной кости. Бедренной кости затем подвергаются путем разделения широкая мышца бедра латeralis и двуглавой мышцы бедра мышцы (рис. 2).
- Для обеспечения максимальной согласованности регенерации кости, надкостница покрывающих бедра дефект полностью удаляется с удаленной бедренного сегмента.
- Полиэтилен пластиной (длина 23 мм, ширина 4 мм, высота 4 мм) находится на переднебоковой поверхности бедра. Пластина состоит из шести предварительно просверленные отверстия для размещения диаметром 0,9 мм с резьбой провода Киршнер (Zimmer). Принимая пластину в качестве шаблона, шесть резьбовых провода Киршнер бурятся через пластину и так коры (рис. 3).
- Далее, с небольшим осциллирующей пилы (Stryker, MI), 6-мм середине диафизарных дефектов создается. Сегментные дефекты затем обрабатывают путем введения PLGA основе имплантатов, которые были нагруженные клетки, в соответствии с протоколом (рис. 4).
- Вышележащие мышцы и фасции закрыты 4-0 Викрил рассасывающиеся швы, чтобы обеспечить имплантат на месте, а кожа зашивается.
6. В Vivo оценки
- Рентгенологические оценки выполняются в продольном способом, как высокое разрешение и XR с высоким разрешением μCT (микро компьютерная томография) анализа. Для μCT анализа (Skyscan 1172F), изображения будут отсканированы с разрешением 19,73 мкм (100 кВ и 100 мА источника излучения, с помощью 0,5 мм алюминиевый фильтр). Изображения анализировали с помощью DataViewer, Recon, CTAN, и CTVol программного обеспечения.
- Биолюминесценция изображений производится также в сериале образом для оценки приживления клетки, жизнеспособность, пролиферацию и миграцию исключить из имплантата. Биолюминесценция изображений осуществляется с помощью ИВИС Lumina II устройство (суппорт Life Sciences). Свет выходы количественно, используя программное обеспечение жизни изображения (Xenogen). Общий объем свет отражается в фотонов / сек / см / стерадиан.
- Гистологическое и гистоморфометрическое анализ проводится посмертно. Обычные пятна использованы, включают трехцветного Массона, анилин синий, рentachrome и Picrosirius красный. Гистоморфометрическое анализ выполняется легко с любой анилин синий или pentachrome пятна, в котором остеоида появляется темно-синий и желтый, соответственно. Пиксели на высокой мощности поля рассчитывается по волшебной палочкой в Adobe Photoshop.
7. Представитель Результаты
Так как оба свода черепа и бедренной дефекты критического размера, без существенных исцеления следует ожидать без лечения с факторами роста или экзогенных стволовых клеток.
С точки зрения хирургических маневров, рассечение мышц сумка должна быть вдоль фасциальных самолетов и, таким образом минимальное кровотечение должно возникнуть. Хотя модель мышцы сумка осуществляется двусторонней основе, мышь должна ходить с легкостью на день после операции 1. Для свода дефект, кровотечения встречается, но может быть пропитана Q-Tip. Экстремальные следует позаботиться, чтобы не повредить основной твердой мозговой оболочки - как это будет мешатьс нормального заживления. Для FSD модели, приняты меры, чтобы не повредить крупные кровеносные сосуды, чтобы не вызвать кровотечения или бедренного нерва для предотвращения неврологических повреждений. Киршнер провода сверлят с легким нажимом, чтобы не повредить кортикальной кости в этом процессе.

Рисунок 1. Предоперационная подготовка к бедренной сегментных дефектов (ФУР) в бестимусных крыс. Самцов крыс (12-14 недель) анестезируют под ИФ ингаляции. Бедра промывается и нацелен на стандартный протокол с бетадин.

Рисунок 2. Хирургическое воздействие на бедренной сегментных дефектов (ФУР) творчества. 27-30 мм, продольный надрез на переднебоковой бедренной кости. Латеральной поверхности бедренной кости затем подвергаются путем разделения широкая мышца бедра латеральнойи двуглавой мышцы бедра мышцы.
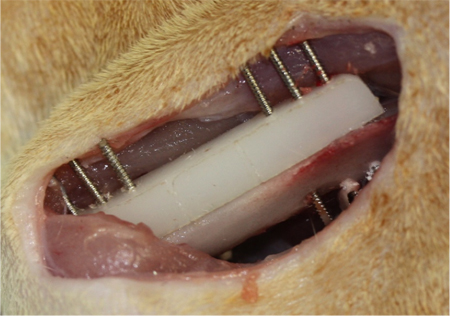
Рисунок 3. Фиксация на бедренной сегментных дефектов (ФУР) творчества. Полиэтилен пластиной (длина 23 мм, ширина 4 мм, высота 4 мм) находится на переднебоковой поверхности бедра. Пластина состоит из шести предварительно просверленные отверстия для размещения диаметром 0,9 мм с резьбой провода Киршнер. Принимая пластину в качестве шаблона, шесть резьбовых провода Киршнер бурятся через пластину и так коры. Далее, на 6 мм в середине диафизарных дефектов создается. Как только это будет выполнено, заказные леса напрямую вставляется который точно соответствует дефект сайта (не показано).

Рисунок 4. Пример свода дефект послеоперационной. 4 мм, круговой дефект свода создается в правой теменной кости в бестимусных мышей. Отображаемого здесь дефект сайт имплантировалиЭСК на 8 недель послеоперационного. Обратите внимание на наличие новой кости в дефект сайта.
Обсуждение
Выделение ЭСК хорошо описаны в других 1-3, в том числе представлены отдельно Юпитер публикации непосредственно касающихся ОАО изоляции протоколов и методов. Конкретная цель этой статьи заключается в описании и демонстрации 3 протокола для PSC в естественных условиях применение для формирования костей / регенерации. SCID сумка мышцы мыши обычно описывается моделью для внематочной формирования человеческого костного 7. Важные различия между внематочной и ортотопической (дефекта) модели для костей, в том числе паракринной взаимодействие с принимающими кости клеток, образующих 8, а также обилие остеогенной факторов сигнализации присутствует в костной микросреде дефекта. Два дефекты, представленные здесь, свода черепа и бедренной defect8 сегментарных дефектов 4. Оба они хорошо документированы, чтобы быть критической величины (то есть не заживают самостоятельно).
Интересные различия между свода черепа и бедренной дефектов. Во-первых,клетка: клетка взаимодействия xenografted ЭСК и эндогенных клеток сильно отличается. С точки зрения свода дефектов, ЭСК взаимодействовать с основной мозговой оболочки (внешний слой мозговых оболочек), а также те, остеобластов и клеток надкостницы описывающая дефект сайта. Важно отметить, что взаимодействие между имплантированными клетками и окружающей остеобластов 8, или имплантированные клетки и лежащих в основе оболочки (Леви и др.., В печати) имеют решающее значение для нормального стволовых клеток опосредованно остеогенез, чтобы продолжить. С точки зрения бедра сегментарный дефект (FSD), xenografted ЭСК подвергаются очень разных клеток и цитокинов окружающей среды. Например, FSD сайт состоит из костного мозга и сопутствующих мезенхимальных стволовых клеток, а также эндосту, надкостницы и длинных костей остеобластов. Теоретически, каждая клетка имеет свою собственную реакцию на травму, и каждый может иметь ячейки: ячейка взаимодействия с ксенотрансплантаты PSC.
Другие четкие различия существуют между сводаи бедренных дефектов. Кости свода черепа изначально сформировать через intramembranous окостенения, а длинные кости образуют через промежуточный хрящ (эндохондральный окостенения). Кроме того, процесс репаративной после травмы также имитирует эти развитии происхождения. После FSD, хрящей каллусообразования наблюдается, в то время не хрящ промежуточных формируется в дефект теменной кости. Наконец, эмбрионального происхождения черепа может отличаться от длинных костей. Большая часть черепа (в том числе периваскулярных клеток - перицитов - в регионе в целом голове) происходит от нервного гребня (mesectoderm), а аппендикулярного скелета параксиальной мезодермы выводе 9. Все эти различия могут привести к существенным различиям в условиях PSC-опосредованной костной ремонта.
Использование СРП имеет ряд преимуществ по сравнению с традиционными жировых производных стромальных клеток (ИСС). ЭСК не требует культуры и очищенный бее клеточной популяциич не включает другие стромальные клетки, которые не участвуют в - и даже может негативно регулировать - остеогенной дифференцировки, такие как эндотелиальные клетки 10. В отличие, например, клонального анализа ИСС показывают, что только субпопуляции способны подвергаться остеогенной дифференцировки в пробирке 11. В конечном счете, скелетных усилия тканевой инженерии, скорее всего, включать osteocompetent стволовых клеток (например, ЭСК) с экзогенными факторами роста и остеокондуктивные леса (например, HA-PLGA, используемые в настоящее время методы) так, чтобы максимально исцелить скелетные дефекты.
Раскрытие информации
KT, BP, и CS являются изобретателями периваскулярных стволовых клеток, связанных патентных заявок, поданных в Лос-Анджелесе. Др. KT, и CS являются учредителями шрамов лаборатории Инк который сублицензии периваскулярных стволовых клеток патентов, связанных с UC регентов. Д-р Су Цзя также офицер шрамов Laboratories, Inc
Благодарности
Эта работа была поддержана CIRM Рано трансляционных исследований II премия TR2-01821, NIH / NIDCR (гранты R21 DE0177711 и RO1 DE01607), UC Discovery грант 07-10677, AWJ и РКС имеют T32 стипендий, премий (5T32DE007296-14), JNZ имеет CIRM стипендии, подготовка кадров (TG2-01169).
Ссылки
- Crisan, M. A perivascular origin for mesenchymal stem cells in multiple human organs. Cell Stem Cell. 3, 01-13 (2008).
- Chen, C. W. Perivascular multi-lineage progenitor cells in human organs: regenerative units, cytokine sources or both. Cytokine Growth Factor Rev. 20, 429-434 (2009).
- Corselli, M., Chen, C. W., Crisan, M., Lazzari, L., Peault, B. Perivascular ancestors of adult multipotent stem cells. Arterioscler. Thromb Vasc. Biol. 30, 1104-1104 (2010).
- Zara, J. Nell-1 enhances bone regeneration in a rat critical sized femoral segmental defect model. Plast. Reconstr. Surg. , Forthcoming (2010).
- James, A. W. Deleterious Effects of Freezing on Osteogenic Differentiation of Human Adipose-Derived Stromal Cells In Vitro and In Vivo. Stem Cells Dev. 20, 427-439 (2011).
- Lee, M., Chen, T. T., Iruela-Arispeb, M. L., Wu, B. M., Dunn, J. C. Y. Modulation of protein delivery from modular polymer scaffolds. Biomaterials. 28, 1862-1870 (2007).
- Aghaloo, T. A study of the role of nell-1 gene modified goat bone marrow stromal cells in promoting new bone formation. Mol. Ther. 15, 1872-1880 (2007).
- Levi, B. Human Adipose-Derived Stromal Cells Stimulate Autogenous Skeletal Repair via Paracrine Hedgehog Signaling with Calvarial Osteoblasts. Stem Cells Dev. 20, 243-257 (2011).
- Leucht, P. Embryonic origin and Hox status determine progenitor cell fate during adult bone regeneration. Development. 135, 2845-2854 (2008).
- Rajashekhar, G. IFATS collection: Adipose stromal cell differentiation is reduced by endothelial cell contact and paracrine communication: role of canonical Wnt signaling. Stem Cells. 26, 2674-2681 (2008).
- Zuk, P. A. Human adipose tissue is a source of multipotent stem cells. Mol Biol Cell. 13, 4279-4295 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены