Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Усиление и Количественная РНК ВИЧ-1 у ВИЧ-инфицированных с вирусной нагрузки ниже предела обнаружения стандартными клиническими Анализы
В этой статье
Резюме
Количественная уровней РНК ВИЧ-1 в плазме крови и последовательности одного ВИЧ-1 генома от лиц с вирусной нагрузки ниже предела обнаружения (50-75 копий / мл) трудно. Здесь мы опишем, как извлечь и количественной вирусной РНК с помощью ПЦР в реальном времени анализ, который надежно измеряет РНК ВИЧ-1 до 0,3 копий / мл и как усилить вирусных геномов путем секвенирования генома одного из образцов с очень низкой вирусной нагрузкой.
Аннотация
Усиление вирусных генов и количественной оценки РНК ВИЧ-1 у ВИЧ-1-инфицированных пациентов с вирусной нагрузкой ниже предела обнаружения стандартные анализы (ниже 50-75 копий / мл) необходимо, чтобы разобраться с вирусной динамики и взаимодействия вируса принимающей у пациентов, которые Естественно борьбы с этой инфекцией, и те, которые находятся на комбинированной антиретровирусной терапии (ВОЗ).
Здесь мы опишем, как для усиления вирусных геномов одиночными секвенирование генома (SGS протокола) 13, 19 и, как точно количественно РНК ВИЧ-1 у пациентов с низкой вирусной нагрузки (одной копией анализа (SCA) протокол) 12, 20.
Одной копии анализа является ПЦР в реальном времени анализа с чувствительностью в зависимости от объема плазмы быть проанализированы. Если одного генома вирус обнаружен в 7 мл плазмы, то количество РНК копия, как сообщается, 0,3 копий / мл. Анализ имеет внутреннее тестирование для контроля эффективности добычи РНК, а также контроль за возможным усилением из ДНК или загрязнения. Образцы пациентов измеряются в трех экземплярах.
Одной секвенирование генома анализа (SGS), теперь широко используется и считается без трудоемких 3, 7, 12, 14, 15, предельного разбавления пробы, в которых конечная точка разбавленный кДНК продукт распространяется на 96-луночного пластины. Согласно распределению Пуассона, когда менее чем 1 / 3 от скважины дают продукт, существует 80% вероятности продукт ПЦР будучи равнодействующей усиления из одной молекулы кДНК. SGS имеет преимущество по сравнению с клонированием не подвергается передискретизации, а не в предвзятости при помощи ПЦР введенные рекомбинации 19. Тем не менее, усиление успех SCA и SGS зависит от грунтовки дизайна. Оба были разработаны анализы на ВИЧ-1 подтипа Б, но могут быть адаптированы для других подтипов и других регионов генома, изменяя грунтовки, зонды, и стандартами.
протокол
1. Добыча РНК из больших объемов плазмы
Обзор одного анализа копию (SCA) и одного секвенирование генома (SGS) протокола предоставляются на рисунках 1 и 2.
- Чтобы получить 7 мл плазмы, спин примерно 14 мл крови, собранных в 15 мл ЭДТА (не гепарин) сбор труб при 2600 мкг в течение 15 минут без торможения. Внесите плазмы (убедившись, чтобы избежать слой лейкомассы) в 15 мл пробирки.
- Если РНК добывается для одного анализа копию (SCA), шипованные плазмы с 30 000 копий вируса саркомы Рауса внутренних вириона управления (разъемы RCA). Вирус RCAs готова до выполнения SCA, как описано ранее (20). Короче говоря, разъемы RCA вируса от клетки супернатант культуры можно измерить с помощью деятельности РТ, разбавляют до конечной концентрации 30 000 вирионов на 200 ул, разбавленных в средствах массовой информации RPMI культуре ткани с 5% ЭТС, и хранится при температуре -80 ° С в одной порции использования. Вирус ОРК не должна быть замороженной / размороженной до использования в анализе. ОРК с шипами в плазме пациента для контроля эффективности добычи РНК и за точность количественной ПЦР. Более подробную информацию о RCAs можно найти по следующей ссылке: http://home.ncifcrf.gov/hivdrp/RCAS/ .
- "Pre-спина» плазмы, в 15 мл конические пробирки центрифуги, в 2600 мкг в течение 15 минут, чтобы выделить какой-либо липидов и распада клеток, которые могут мешать точную количественную РНК.
- Этикетка Сетон Easy-печать пробирок с постоянным маркером для определения числа образцов и место, где гранулы образуют в трубке. После предварительной спина, передача плазмы Сетон Easy-уплотнение трубы центрифуги с помощью пипетки плазмы и избегая распада клеток и / или липидов на поверхности. Запись входных объема плазмы.
- Добавить Трис-буферного раствора (TBS), чтобы заполнить оставшиеся объемы Сетон-Легкая печать трубки к нижней части резьбовой втулкой. Будьте уверены, что никаких пузырей присутствуют в трубку или трубки рухнет в ультрацентрифуге. Убедитесь, что отпечаток на трубок наружу при размещении труб в роторе.
- Печать с повторного использования колпачков и место образцов в предварительно охлажденный Sorval T1270 ротора и центрифуги в Sorval 90SE ультрацентрифуге на 170 000 мкг (50 000 оборотов в минуту) при 4 ° С в течение 30 мин.
- После центрифугирования супернатант удалить и добавить 90 ул молекулярной воды класса и 10 мкл протеиназы-К (20 мг / мл) для вирусных гранул (это не будет видно).
- Место труб в 55 ° С водяной бане и инкубировать в течение 30 минут. Убедитесь, что трубы установлены под углом так, чтобы сторона с шарик опускают в протеиназы-К и водной смеси.
- После инкубации, вскоре спина трубки в центрифуге столешницы, чтобы собрать все жидкости в нижней части трубки (около 5 секунд) и добавить 315 мкл 6М раствор роданида гуанидиний и 10 мкл 20 мг / мл гликогена (Примечание: Следуйте соответствующим распоряжении руководящие принципы для такого опасного вещества; не путать с отбеливателем или кислот и распоряжаться в отдельный контейнер).
- Vortex слегка и спина вскоре (в течение приблизительно 5 секунд). Инкубируйте в течение 10 минут при комнатной температуре, а затем передать содержимое каждой пробирки на вновь помечены 1,5 мл РНКазы Бесплатный трубы центрифуги.
- Добавить 495 мкл молекулярной класса изопропилового спирта в каждую пробирку, вихревые в течение 10 секунд и центрифуге при 21 000 мкг в течение 30 минут при комнатной температуре.
- Удалите супернатант и добавить 500 мкл 70% этанола.
- Vortex на 10 секунд и центрифуге при 21 000 мкг в течение 15 минут при комнатной температуре. Удалить этанола с передачей пипетки. Спиновые снова и удалить остатки этанола с пипеткой. Воздух сухой в течение 10 минут. (Для SGS протокол растворяются РНК в 40 мкл 5 мМ Трис-HCl, рН 8,0, и продолжать с протоколом SGS).
- Растворите гранулы в 55 мкл РНК-буфера. РНК-буфера получается путем добавления 10 мкл 100 мМ ДТТ и 25 мкл 40 U / ул Rnasin до 965 ул Трис-HCl (рН 8,0, 5 мм). Место на льду.
2. Одноместный анализа копирования
96-луночного планшета занимает 8 образцов пациентов в том числе и ВИЧ, и ОРК стандартов и контроля. Этот протокол будет описывать настройку одной пластине.
- Начните с подготовки 2 порции по 1 мл РНК-буфера, в которых РНК ВИЧ-1 и ОРК РНК-транскрипты будет разбавляться для РНК кривые стандарта. РНК-буфера описано в разделе 1.13.
- Подготовка разведения на льду в 2 мл пробирок центрифуги. Сделать половину журнала разведения ВИЧ-1 транскриптов РНК в РНК-буфера, добавляя 25 мкл РНК ВИЧ-1 акции (1х10 6 копий / мкл) до 54 ул РНК-буфера дает 3х10 5 копий / ул.
- Продолжить путем последовательных полу-журнал разведения (25 мкл + 54 мкл) до 0,3 копий в 10 мкл (Примечание: 0,3, 1 и 3 разведения не будет частью стандартной кривой при анализе этих используются в качестве экстраполяции значений и должен быть установлен в мажор неизвестныхING анализ). ОРК транскрипты держать на 1х10 6 копий / ул. Точно так же подготовить половины журналов разведения стенограммы ОРК в РНК-буфера, но до 100 экземпляров на 10, ул.
- Подготовка коктейль РТ для синтеза кДНК, которые перечислены в таблице 1. Подготовка РТ и НЗТ реакций, перечисленных в таблице 1, имея в виду, составить небольшую дополнительную к ответственности за любые убытки, которые могут возникнуть в процессе передачи. Примечание: для коктейля НЗТ, фермент РТ заменяется водой управления для усиления из ДНК.
Примечание: Этот шаг был недавно автоматизирован в дополнение к пластине установлен на Qiagen Робот (первоначально Корбетт). - Настройка оптический 96-луночного планшета (как показано на рисунке 3), путем добавления 20 мкл реакционной смеси РТ в каждую лунку. В 8 скважин с надписью "НЗТ", добавить коктейль без обратной транскриптазы (НЗТ реакционной смеси). После добавления коктейли на тарелку, добавить 10 мкл воды к скважинам с надписью "Нет шаблонов управления (НТЦ)". Добавьте 10 мкл стенограммы ВИЧ скважин с надписью "ВИЧ" в концентрациях показано на рисунке 3. Добавьте 10 мкл стенограммы разъемы RCA для скважин с надписью "ОРК" в соответствии концентрациях. Добавьте 10 мкл образца пациента в 3 смежных скважин с надписью "Образец" на тарелку диаграмме. Добавьте 10 мкл элюировали образца скважин с надписью "НЗТ". Добавьте 5 мкл того же образца и 5 мкл воды в скважинах с надписью "внутреннего контроля".
- Печать пластины и запустить на амплификаторе по адресу: 25 ° С в течение 15 минут, 42 ° С в течение 40 минут, 85 ° С в течение 10 минут, 25 ° С в течение 30 минут и 5 ° C удержания.
- Подготовка ПЦР мастер смешивает в соответствии с таблицей 2.
- Когда синтеза кДНК завершения перехода на площадь, предназначенная для использования кДНК. В этом обозначенном районе, добавить 20 мкл смеси мастер ПЦР в каждую лунку кДНК пластина для ВИЧ и разъемы RCA. Важно, чтобы выполнить этот шаг в указанном месте, чтобы избежать возможного заражения.
- Спиновые пластины, печать с ABI или Рош Оптические покрытия и покрытия с оптическими одеяло (одеяло только необходимые для ABI 7700). Запустить на Рош 480 или ABI 7700. ПЦР Условия: 95 ° С в течение 10 минут, затем 45 циклов 95 ° C в течение 15 секунд, 60 ° С в течение 1 мин. Отдельный анализ необходим для ОРК и ВИЧ. Примеры результаты показаны на рисунке 4. Наклон калибровочной кривой будет зависеть от нормального распределения Пуассона низкой стенограммы числа копий. В целях обеспечения наиболее точного склон для стандартной кривой, это низкий уровень числа копий (0,3, 1 и 3-х экземплярах) устанавливаются как "неизвестные" 17.
3. Одноместный секвенированию генома
- кДНК синтеза. Добавьте 5 мкл 10 мМ дНТФ и 5 мкл 2 мМ ген-специфического праймера (пол или ENV), чтобы хорошо в 96-ПЦР пластины (Biorad). Добавить 40 мкл извлеченные РНК. Печать пластины.
- Денатурации РНК-смеси в амплификаторе при 65 ° С в течение 10 мин.
- Смешайте реагенты для синтеза кДНК, перечисленных в таблице 3. После денатурации шаг, место ПЦР пластины на льду, добавить 50 мкл кДНК смеси каждого образца.
- Запуск ПЦР пластину на амплификаторе: 45 ° C в течение 50 минут, 85 ° С в течение 10 мин и 4 ° C удержания.
- Первая ПЦР 10 мкл реакции. Подготовьте смесь ПЦР-реакции реагента лоток с использованием либо праймеров для первого раунда амплификации p6-RT или ENV (реагентов приведены в таблице 3, грунтовки, перечисленных в таблице 5).
- Использование многоканальной пипетки обойтись 8,0 мкл ПЦР-смеси до 73 скважин на 96-ПЦР пластины (70 образцов и 3 отрицательных контролей).
- После синтеза кДНК завершения двигаться кДНК и ПЦР пластины, содержащей ПЦР реакционную смесь на площадь, предназначенная для использования кДНК. В указанном месте, добавить 40 мкл Трис-HCl, рН 8,0 до каждого образца кДНК чего конечный объем до 140, ул. Добавить 2,0 мкл кДНК, к каждому из 70 скважин и 2,0 мкл воды для каждого из отрицательных контролей. Печать ПЦР пластины. Запустить на амплификаторе, программа в таблице 4.
- Вложенные ПЦР - 20 мкл реакции. Смешайте реагентов для ПЦР в реагент лоток (реагентов приведены в таблице 3, грунтовки, перечисленных в таблице 5).
- Добавить 18 мкл ПЦР-смеси, вложенных до 73 скважин на 96-луночный планшет ПЦР, по многоканальной пипетки
- Развести первой ПЦР 1:5 и добавляют 2 мкл первого раунда ПЦР для ПЦР. Запуск ПЦР-реакции на амплификаторе, на условиях, указанных в таблице 4.
- Запуск образцов на 1% агарозном геле. Чтобы убедиться, что большинство продуктов ПЦР являются результатом одной молекулы кДНК, не более 30% скважин должен быть положительным. Процесса была автоматизирована с использованием Beckman Coulter Biomek FM-робот для загрузки содержимого пластин ПЦР на 1%, 96 лунок E-гель (Invitrogen). E-гели выполняются в течение 7 минут на E-базы. Последовательность продукции с использованием праймеров, перечисленных в таблице 5.
4. Представитель результаты:
SCA:
Все элементы управления должны пройти, чтобы рассмотреть РНК ВИЧ-1 измерения правильны. Если отрицательные управления positiве, работать следует сбрасывать со счетов из-за возможного загрязнения. В целях контроля за убытки РНК в процессе добычи шаг, по крайней мере 50% RCAs шипами в плазме должны быть восстановлены. Если средний RCAs составляет <15 000 копий, и образец не следует сбрасывать со счетов, поскольку значительное количество РНК могли быть потеряны при добыче или других шагов протокола. Это происходит примерно в 10% всех пациентов протестированных образцов вероятно, из-за высоких липидов в плазме крови 6. Восстановление вируса разъемы RCA предназначен для контроля качества добычи и эффективность синтеза кДНК и ПЦР-амплификации. Он не используется для коррекции ВИЧ восстановления с ВИЧ, скорее всего, связан с иммуноглобулинов и других белков человека делает его немного отличается от вируса, выделенного из тканевой культуры. Восстановление ОРК в нашей лаборатории было в среднем 25 716 + / - 4057 копий / реакционной смеси, или около 95% + / -15% от RCAs РНК добавлены 17. НЗТ (без обратной транскриптазы) контроль выполняется параллельно для того, чтобы проверить на усиление из ДНК. Значение НЗТ вычитается из каждой из трех ВИЧ-1 значения РНК, то средняя рассчитывается и если это число меньше нуля (амплификации ДНК превышает усиления РНК), результат был бы неудачу и должны приниматься во внимание, поскольку риска усиления от ДНК, а не РНК. Если РНК ВИЧ-1 только усиливается от 1 / 3 скважины, повторные испытания образец рекомендуется обеспечить усиление самое относится и к фактической пробы анализировали и не из-за возможного загрязнения.
Если все элементы управления проходят, средняя РНК ВИЧ-1 число копий в плазме может быть вычислена.
Пример 1: Если средняя ВИЧ-1 копия число равно нулю, предел обнаружения рассчитывается исходя из объема плазмы анализировали. В качестве примера, скажем, 7 мл плазмы определяли. Наименьшее количество РНК, которые могли быть обнаружены при этом анализе было бы 1 экземпляр в одной из скважин и 0 экземпляров на двух других скважинах дает в среднем 0,33 копий на лунку. Среднее число копия затем должна быть умножена на коэффициент 5,5, чтобы добраться до общего количества копий в элюции РНК (есть 10 мкл в каждую лунку, но общий объем элюирования составляла 55 мкл). Нижний предел обнаружения, то: 5,5 х 0,33 копии делится на 7 мл = 1,83 / 7 = 0,3 копий / мл. Концентрации РНК ВИЧ-1 в плазме крови в данном примере была <0,3 копий / мл.
Пример 2: РНК ВИЧ-1 может быть обнаружено. РНК выделяли из 7 мл плазмы. Среднее число копий РНК ВИЧ-1 на лунку рассчитывается как 2,0 копий на лунку. Тогда среднее число копий на мл плазмы составляет 5,5 х 2,0 копий / 7 мл = 1,6 РНК ВИЧ-1 / мл плазмы.
Шаблона листа Excel используется для расчета копировать номера может быть недоступен загружен с веб-сайта.
SGS:
Если один из отрицательных контролей положительно запустить следует сбрасывать со счетов из-за возможного загрязнения. Число продукт от каждого запуска будет зависеть от вирусной нагрузки в каждом образце и состояние образца. По нашему опыту много липидов или клеток в плазме снизит шансы на получение продукта. Условия хранения и предыдущие замораживания и оттаивания образцов будет также влиять на восстановление РНК значительно. В целом, при работе с образцами с вирусной нагрузки ниже 50 копий / мл, продукт (полос на гель) следует ожидать в течение 1 / 3 -1 / 2 от образцы обрабатываются. В зависимости от вышеперечисленных факторов, 1-5 полос на чашку следует считать хорошим результатом из-за низкой вирусной нагрузки у этих пациентов.
| синтеза кДНК (RT Коктейль / кДНК реакции) | 1 реакция | Нет обратной транскриптазы (НЗТ) коктейль / кДНК реакции (1 реакция) |
| Молекулярная класса H 2 O | 8,1 уль | 8,2 уль |
| 25 мМ MgCl 2 | 6 ул | 6 ул |
| 25 мМ дНТФ | 0,6 уль | 0,6 уль |
| 100 мМ DTT | 0,2 уль | 0,2 уль |
| Случайные гексамеров (0,1 мкг / мкл) | 1,5 уль | 1,5 уль |
| 10X Буфер TaqMan | 3,0 уль | 3,0 уль |
| Rnasin (40 ед / мкл) | 0,5 уль | 0,5 уль |
| Strategene РТ (200 ед / мкл) | 0,1 уль | Не добавляйте |
| Общий | 20 мкл | 20 мкл |
| Пример РНК | 10 мкл | 10 мкл |
| Общий объем | 30 ул | 30 ул |
Таблица 1. Реакция микстUres для синтеза кДНК в одиночном Пробирной Копировать.
| PCR Master Mix | 1 реакция | Грунтовки |
| H 2 O | 15,1 уль | ВИЧ прямого праймера 5'-CATGTTTTCAGCATTATCAGAAGGA-3 ' |
| 10X Золотой ПЦР-буфера | 2,0 уль | ВИЧ обратный праймер 5'-TGCTTGATGTCCCCCCACT-3 ' |
| 25 мМ MgCl 2 | 2,0 уль | ВИЧ-Probe5'FAM CCACCCCACAAGATTTAAACACCATGCTAA-TAMRA 3 ' |
| * Форвард Primer (100 мкм) | 0,3 уль | |
| * Обратное Primer (100 мкм) | 0,3 уль | ОРК Вперед Primer5'-GTCAATAGAGAGAGGGATGGACAAA-3 ' |
| * Зонд (100 мкм) | 0,05 уль | ОРК Обратный Primer5'-TCCACAAGTGTAGCAGAGCCC-3 ' |
| TaqGold (5 ед / мкл) | 0,25 уль | ОРК Зонд 5'FAM-TGGGTCGGGTGGTCGTGCC-TAMRA 3 ' |
| Общий | 20,0 уль |
Таблица 2. ПЦР мастер смеси и грунтовки для одиночных Пробирной Копировать.
| кДНК коктейль / кДНК реакции | 1 РНК образца | Первый коктейль ПЦР | 1 пластина (75 реакций) | Вложенные коктейль ПЦР | 1 пластина (75 реакций) |
| 10X РТ буфера (Invitrogen) | 10 мкл | 10х ПЦР буфер (Invitrogen) | 75 ул | 10X буфера ПЦР | 150 ул |
| 25 мМ MgCl 2 | 20 мкл | 50 мМ MgSO 4 | 30 ул | 50 мМ MgSO 4 | 60 ул |
| 0,1 М ДТТ | 1 мкл | 10 мМ дНТФ | 15 ул | 10 мМ дНТФ | 30 ул |
| РНКазы без воды | 17,5 уль | 50 мкМ праймеров (шт) | 3 ул | 50 мкМ праймеров (шт) | 6 ул |
| РНКазы-Out (Invitrogen) | 1 мкл | Платиновый Taq Привет Fi ферментов (Invitrogen) | 6 ул | Платиновый Taq Привет Fi ферментов (Invitrogen) | 12 ул |
| Надстрочный III (200 ед / мкл) (Invitrogen) | 0,5 уль | Молекулярно-класса воды | 468 ул | Молекулярно-класса воды | 1086 уль |
Таблица 1. КДНК и ПЦР-смесей для одиночных секвенирования генома.
| P6-RT 1 ПЦР программы | Env 1 ПЦР программы |
| 1. 94 ° С в течение 2 минут | 1. 94 ° С в течение 2 минут |
| 2. 94 ° С в течение 30 секунд | 2 0,94 ° C в течение 30 секунд |
| 2 0,94 ° C в течение 30 секунд | 3. 52 ° С в течение 30 секунд |
| 4. 72 ° С в течение 1 минуты 30 секунд | 4. 72 ° С в течение 1 минуты |
| 5. К № 2, 44 циклов | 5. К № 2, 44 циклов |
| 6. 72 ° С в течение 3 минут | 6. 72 ° С в течение 3 минут |
| 7. 4 ° C держать | 7. 4 ° C держать |
| P6-RT 2 ПЦР программы | Env 2 ПЦР программы |
| 1. 94 ° С в течение 2 минут | 1. 94 ° С в течение 2 минут |
| 2. 94 ° С в течение 30 секунд | 2. 94 ° С в течение 30 секунд |
| 3. 55 ° С в течение 30 секунд | 3. 56 ° С в течение 30 секунд |
| 4. 72 ° С в течение 1 минуты | 4. 72 ° C в течение 45 секунд |
| 5. К № 1, 40 (41 циклов общего числа) | 5. К № 1, 40 (41 циклов общего числа) |
| 6. 72 ° С в течение 3 минут | 6. 72 ° С в течение 3 минут |
| 7. 4 ° C держать | 7. 4 ° C держать |
Таблица 4. Термоциклер условий для введения единой Пробирной Секвенирование генома.
| Реакция | Грунтовка | Последовательность |
| P6-RT кДНК | 3500 - | 5 'CTATTAAGTATTTTGATGGGTCATAA 3' |
| ENV кДНК | E115- | 5'AGAAAAATTCCCCTCCACAATTAA 3 ' |
| P6-RT 1. ПЦР | 3500 - | 5 'CTATTAAGTATTTTGATGGGTCATAA 3' |
| P6-RT 1. ПЦР | 1849 + | 5 'GATGACAGCATGTCAGGGAG 3' |
| P6-RT2.PCR | 1870 + | 5 'GAGTTTTGGCTGAGGCAATGAG 3' |
| P6-RT 2.PCR | 3410 - | 5 'CAGTTAGTGGTATTACTTCTGTTAGTGCTT 3' |
| ENV 1. ПЦР | E115- | 5'AGAAAAATTCCCCTCCACAATTAA 3 ' |
| ENV 1. ПЦР | E20 + | 5'GGGCCACACATGCCTGTGTACCCACAG 3 ' |
| ENV 2. ПЦР | E30 + | 5'GTGTACCCACAGACCCCAGCCCACAAG3 ' |
| ENV 2. ПЦР | E125- | 5'CAATTTCTGGGTCCCCTCCTGAGG 3 ' |
| P6-RT секвенирования | 2030 + | 5'TGTTGGAAATGTGGAAAGGAAGGAC 3 ' |
| P6-RT секвенирования | 2600 + | 5'ATGGCCCAAAAGTTAAACAATGGC3 ' |
| P6-RT секвенирования | 2610 - | 5'TTCTTCTGTCAATGGCCATTGTTTAAC3 ' |
| P6-RT секвенирования | 3330 - | 5'TTGCCCAATTCAATTTTCCCACTAA 3 ' |
| ENV секвенирования | E30 + | 5'GTGTACCCACAGACCCCAGCCCACAAG3 ' |
| ENV секвенирования | E125- | 5'CAATTTCTGGGTCCCCTCCTGAGG 3 ' |
Таблица 5. Праймеры для Одноместный Пробирной Секвенирование генома.
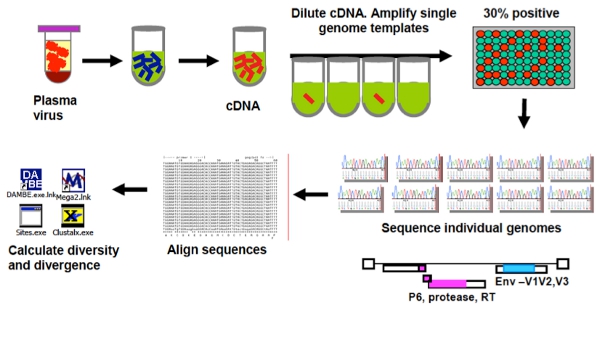
Рисунок 1. Обзор Геном Паленый Секвенирование анализ (SGS).
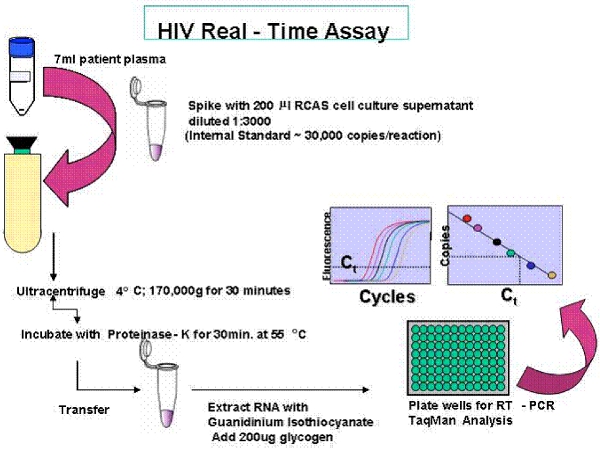
Рисунок 2. Обзор Одноместный Пробирной Copy (SCA).
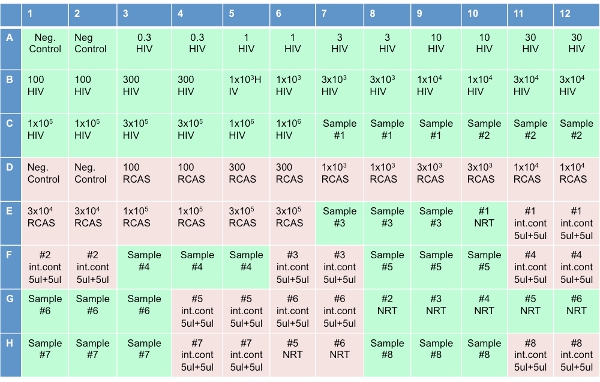
Рисунок 3. Пластина установки для Одноместный Пробирной Копировать.
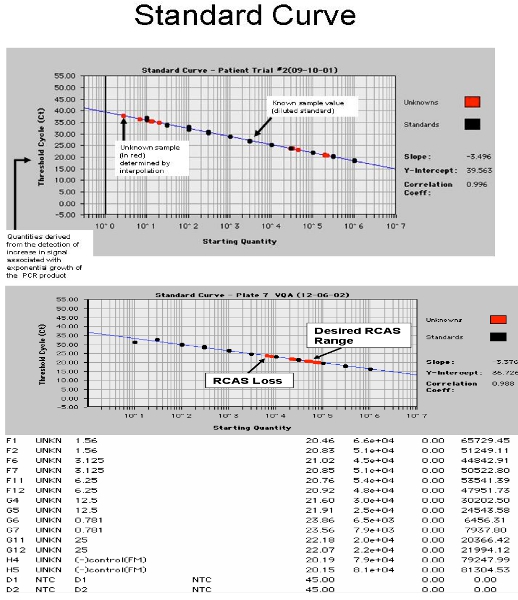
Рисунок 4. Снимок из ABI 7700. А. показывает РНК ВИЧ-1 стандартной кривой образцов пациентов и Б. показывает RCAs стандартной кривой с шипами образцы пациента.
Обсуждение
ВИЧ-1-инфицированных лиц на комбинированной антиретровирусной терапии (ВОЗ), или которые, естественно, контроль инфекции имеют очень низкую вирусную нагрузку, как правило, около 1 экземпляру на каждый мл 4 плазмы, 11, 12, 17, 18. Вирусная нагрузка у пациентов с естественным контролем, час...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы признают, пациенты, которые принимали участие в многих исследованиях ВИЧ-1.
СВК был профессор-исследователь из Американского онкологического общества при поддержке FM Кирби Foundation.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
| Случайные гексамеров (500 мкг / мл) | Promega | C118A | |
| Taqman буфер | Applied Biosystems | 4304441 | |
| RNAsin (40 ед / мкл) | Promega | N211B | |
| RT фермента (200 ед / мкл) | Strategene | 600107-51 | |
| AmpliTaq Золотой ДНК-полимеразы | Applied Biosystems | 4311814 | 6-пакет |
| AmpliTaq 10XGold ПЦР буфер II | Applied Biosystems | 4311814 | поставляется с ферментом |
| Magnesiumcloride 25 мМ | Applied Biosystems | 4311814 | поставляется с ферментом |
| 1М Трис-HCl буфере, рН 8,0, 5 мМ | Invitrogen | AM9855G | |
| Надстрочный III фермента обратной транскриптазы, 200 U / UL | Invitrogen | 18080-044 | |
| Надстрочный III 10X буфера | Invitrogen | поставляется с ферментом | |
| 100 мМ DTT | Invitrogen | поставляется с ферментом | |
| Платиновый Taq ДНК-полимеразы High Fidelity 5 U / UL | Invitrogen | 11304-102 | |
| 10Х High Fidelity ПЦР-буфера | Invitrogen | 11304-102 | поставляется с ферментом |
| Протеиназы-К 20 мг / мл | Амбион | 2546 | |
| Гуанидиний тиоцианатов решение 6M | FlukaBiochemica | 50983 | |
| Гликоген 20 мг / мл | Roche | 10901393001 | |
| Изопропанол | Sigma-Aldrich | 19516 | |
| Этанол 70% | Sigma-Aldrich | E702-3 | |
| Молекулярная класса воды | Gibco / Invitrogen | 10977-015 | |
| дНТФ (25 ммоль каждого) | Биолайн | BIO-39025 |
| Название датчик | Компания | Номер в каталоге | Комментарии |
| Легкая печать Центрифуга Tubes (16x73mm) | Ситон Научные | 6041 | |
| Белый Delrin крон | Ситон Научные | 4020 | Шапочки для Легкое Трубы печать |
| Стеллаж для труб Optiseal Белл-Top Трубы, 8,9 мл | Бекман | 361642 | |
| Шестигранный вороток ½ вкл открытия | Ситон Научные | 4013 | |
| крышка удаления Тупе | Ситон Научные | 4014 | |
| 5 мл серологических пипеток | Costar | 4051 | |
| Pipetboy | любой | ||
| 15 мл пипетки Трансфер | ISC Bioexpress | P-5005-7 | |
| 5,8 мл Dispossable пипетки передачи, тонкой наконечником | VWR | 14670-329 | |
| 15 мл центрифужные пробирки | Сокол | ||
| 1 мл пробирок центрифуги | любой | ||
| Трис буфер Saline таблетки | Sigma-Aldrich | T5030-100TAB | |
| Ультрацентрифуге и ротора | Sorval | 90SE и Т-1270 | |
| 96-луночных ПЦР пластины | Biorad | HSS-9601 | |
| 50 мл реагента водохранилище | Costar | 4870 | |
| МкА оптический 96-луночного планшета реакции | Applied Biosystems | N801-0560 | |
| Оптические пластины охватывает | Applied Biosystems | 4333183 | |
| МкА Оптический Pad сжатия | Applied Biosystems | 4312639 | |
| MicrosealФильм | Biorad | MSA-5001 | |
| 2 мл пробирок центрифуги | Любой | ||
| 1% агарозном геле (E-гель, Invitrogen) | Invitrogen | G-7008-01 | |
| E-базы (Invitrogen) | Invitrogen | EB-M03 |
ЭДТА Коллекция труб любой марки
Ссылки
- Amara, R. R., Villinger, F., Altman, J. D., Lydy, S. L., O'Neil, S. P., Staprans, S. I., Montefiori, D. C., Xu, Y., Herndon, J. G., Wyatt, L. S. Control of a mucosal challenge and prevention of AIDS by a multiprotein DNA/MVA vaccine. Vaccine. 20, 1949-1955 (2002).
- Dinoso, J., Kim, S., Blankson, J., Siliciano, R. F. Viral Dynamics of Elite Suppressors in HIV-1 Infection. Conference on Retroviruses and Opportunistic Infections. , (2008).
- Dinoso, J. B., Kim, S. Y., Wiegand, A. M., Palmer, S. E., Gange, S. J., Cranmer, L., O'Shea, A., Callender, M., Spivak, A., Brennan, T., Kearney, . Treatment intensification does not reduce residual HIV-1 viremia in patients on highly active antiretroviral therapy. Proc. Natl. Acad. Sci. U.S.A. 106, 9403-9408 (2009).
- Doria-Rose, N. A., Klein, R. M., Manion, M. M., O'Dell, S., Phogat, A., Chakrabarti, B., Hallahan, C. W., Migueles, S. A., Wrammert, J., Ahmed, R., Nason, M., Wyatt, R. T., Mascola, J. R., Connors, M. Frequency and phenotype of human immunodeficiency virus envelope-specific B cells from patients with broadly cross-neutralizing antibodies. J. Virol. 83, 188-199 (2009).
- Dornadula, G., Zhang, H., Uitert, B. V. a. n., Stern, J., Livornese, L., Ingerman, M. J., Witek, J., Kedanis, R. J., Natkin, J., DeSimone, J., Pomerantz, R. J. Residual HIV-1 RNA in blood plasma of patients taking suppressive highly active antiretroviral therapy. JAMA. 282, 1627-1632 (1999).
- Gandhi, R. T., Zheng, L., Bosch, R. J., Chan, E. S., Margolis, D. M., Read, S., Kallungal, B., Palmer, S., Medvik, K., Lederman, M. M., Alatrakchi, N., Jacobson, J. M., Wiegand, A., Kearney, M., Coffin, J. M., Mellors, J. W., Eron, J. J. The effect of raltegravir intensification on low-level residual viremia in HIV-infected patients on antiretroviral therapy: a randomized controlled trial. PLoS medicine. 7, (2010).
- Gay, C., Dibben, O., Anderson, J. A., Stacey, A., Mayo, A. J., Norris, P. J., Kuruc, J. D., Salazar-Gonzalez, J. F., Li, H., Keele, B. F., Hicks, C., Margolis, D., Ferrari, G., Haynes, B., Swanstrom, R. Cross-sectional detection of acute HIV infection: timing of transmission, inflammation and antiretroviral therapy. PLoS One. 6, 19617-19617 (2011).
- Hatano, H., Delwart, E. L., Norris, P. J., Lee, T. H., Dunn-Williams, J., Hunt, P. W., Hoh, R., Stramer, S. L., Linnen, J. M., McCune, J. M., Martin, J. N., Busch, M. P., Deeks, S. G. Evidence for persistent low-level viremia in individuals who control human immunodeficiency virus in the absence of antiretroviral therapy. J. Virol. 83, 329-335 (2009).
- Havlir, D. V., Bassett, R., Levitan, D., Gilbert, P., Tebas, P., Collier, A. C., Hirsch, M. S., Ignacio, C., Condra, J., Gunthard, H. F., Richman, D. D., Wong, J. K. Prevalence and predictive value of intermittent viremia with combination hiv therapy. JAMA. 286, 171-179 (2001).
- Jordan, M. R., Kearney, M., Palmer, S., Shao, W., Maldarelli, F., Coakley, E. P., Chappey, C., Wanke, C., Coffin, J. M. Comparison of standard PCR/cloning to single genome sequencing for analysis of HIV-1 populations. J Virol Methods. 168, 114-120 (2010).
- Kaufmann, D. E., Kavanagh, D. G., Pereyra, F., Zaunders, J. J., Mackey, E. W., Miura, T., Palmer, S., Brockman, M., Rathod, A., Piechocka-Trocha, A., Baker, B., Zhu, B., Gall, S. L. e., Waring, M. T., Ahern, R., Moss, K., Kelleher, A. D. Upregulation of CTLA-4 by HIV-specific CD4+ T cells correlates with disease progression and defines a reversible immune dysfunction. Nat Immunol. 8, 1246-1254 (2007).
- Kearney, M., Maldarelli, F., Shao, W., Margolick, J. B., Daar, E. S., Mellors, J. W., Rao, V., Coffin, J. M., Palmer, S. HIV-1 Population Genetics and Adaptation in Newly Infected Individuals. J. Virol. 83, 2715-2727 (2008).
- Kearney, M., Palmer, S., Maldarelli, F., Shao, W., Polis, M. A., Mican, J., Rock-Kress, D., Margolick, J. B., Coffin, J. M., Mellors, J. W. Frequent polymorphism at drug resistance sites in HIV-1 protease and reverse transcriptase. AIDS. 22, 497-501 (2008).
- Kearney, M., Spindler, J., Shao, W., Maldarelli, F., Palmer, S., Hu, S. L., Lifson, J. D., Kewal Ramani, V. N., Mellors, J. W., Coffin, J. M., Ambrose, Z. Genetic diversity of simian immunodeficiency virus encoding HIV-1 reverse transcriptase persists in macaques despite antiretroviral therapy. Journal of Virology. 85, 1067-1076 (2011).
- Keele, B. F., Giorgi, E. E., Salazar-Gonzalez, J. F., Decker, J. M., Pham, K. T., Salazar, M. G., Sun, C., Grayson, T., Wang, S., Li, H., Wei, X., Jiang, C., Kirchherr, J. L., Gao, F., Anderson, J. A., Ping, L. H., Swanstrom, R. Identification and characterization of transmitted and early founder virus envelopes in primary HIV-1 infection. Proc. Natl. Acad. Sci. U.S.A. , 105-7552 (2008).
- Liu, S. L., Rodrigo, A. G., Shankarappa, R. G., Learn, H., Hsu, L., Davidov, O., Zhao, L. P., Mullins, J. I. HIV quasispecies and resampling. Science. 273, 415-416 (1996).
- Mahalanabis, M., Jayaraman, P., Miura, T., Pereyra, F., Chester, E. M., Richardson, B., Walker, B., Haigwood, N. L. Continuous viral escape and selection by autologous neutralizing antibodies in drug-naive human immunodeficiency virus controllers. J. Virol. 83, 662-672 (2009).
- Migueles, S. A., Connors, M. The Role of CD4(+) and CD8(+) T Cells in Controlling HIV Infection. Curr. Infect. Dis. Rep. 4, 461-467 (2002).
- Palmer, S., Kearney, M., Maldarelli, F., Halvas, E. K., Bixby, C. J., Bazmi, H., Rock, D., Falloon, J., Davey, R. T., Dewar, R. L., Metcalf, J. A., Hammer, S., Mellors, J. W., Coffin, J. M. Multiple, linked human immunodeficiency virus type 1 drug resistance mutations in treatment-experienced patients are missed by standard genotype analysis. J. Clin. Microbiol. 43, 406-413 (2005).
- Palmer, S., Wiegand, A. P., Maldarelli, F., Bazmi, H., Mican, J. M., Polis, M., Dewar, R. L., Planta, A., Liu, S., Metcalf, J. A., Mellors, J. W., Coffin, J. M. New real-time reverse transcriptase-initiated PCR assay with single-copy sensitivity for human immunodeficiency virus type 1 RNA in plasma. J. Clin. Microbiol. 41, 4531-4536 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены