Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Биохимические Восстановление стероидных рецепторов • Hsp90 белковые комплексы и Реактивация связывания лигандов
В этой статье
Резюме
В пробирке Способ получения функциональных глюкокортикоидных рецепторов (ГР) • Hsp90 белковых комплексов из очищенных белков и клеточных лизатов описано. Метод использует иммуноадсорбции рекомбинантных GR следует соли зачистки и восстановления белкового комплекса. Важность кофакторов и буферных условия обсуждаются, равно как и потенциальные области применения метода.
Аннотация
Hsp90 is an essential and highly abundant molecular chaperone protein that has been found to regulate more than 150 eukaryotic signaling proteins, including transcription factors (e.g. nuclear receptors, p53) and protein kinases (e.g. Src, Raf, Akt kinase) involved in cell cycling, tumorigenesis, apoptosis, and multiple eukaryotic signaling pathways 1,2. Of these many 'client' proteins for hsp90, the assembly of steroid receptor•hsp90 complexes is the best defined (Figure 1). We present here an adaptable glucocorticoid receptor (GR) immunoprecipitation assay and in vitro GR•hsp90 reconstitution method that may be readily used to probe eukaryotic hsp90 functional activity, hsp90-mediated steroid receptor ligand binding, and molecular chaperone cofactor requirements. For example, this assay can be used to test hsp90 cofactor requirements and the effects of adding exogenous compounds to the reconstitution process.
The GR has been a particularly useful system for studying hsp90 because the receptor must be bound to hsp90 to have an open ligand binding cleft that is accessible to steroid 3. Endogenous, unliganded GR is present in the cytoplasm of mammalian cells noncovalently bound to hsp90. As found in the endogenous GR•hsp90 heterocomplex, the GR ligand binding cleft is open and capable of binding steroid. If hsp90 dissociates from the GR or if its function is inhibited, the receptor is unable to bind steroid and requires reconstitution of the GR•hsp90 heterocomplex before steroid binding activity is restored 4 . GR can be immunoprecipitated from cell cytosol using a monoclonal antibody, and proteins such as hsp90 complexed to the GR can be assayed by western blot. Steroid binding activity of the immunoprecipitated GR can be determined by incubating the immunopellet with [3H]steroid.
Previous experiments have shown hsp90-mediated opening of the GR ligand binding cleft requires hsp70, a second molecular chaperone also essential for eukaryotic cell viability. Biochemical activity of hsp90 and hsp70 are catalyzed by co-chaperone proteins Hop, hsp40, and p23 5. A multiprotein chaperone machinery containing hsp90, hsp70, Hop, and hsp40 are endogenously present in eukaryotic cell cytoplasm, and reticulocyte lysate provides a chaperone-rich protein source 6.
In the method presented, GR is immunoadsorbed from cell cytosol and stripped of the endogenous hsp90/hsp70 chaperone machinery using mild salt conditions. The salt-stripped GR is then incubated with reticulocyte lysate, ATP, and K+, which results in the reconstitution of the GR•hsp90 heterocomplex and reactivation of steroid binding activity 7. This method can be utilized to test the effects of various chaperone cofactors, novel proteins, and experimental hsp90 or GR inhibitors in order to determine their functional significance on hsp90-mediated steroid binding 8-11.
протокол
1. Подготовка цитозоле клеток, содержащих функциональные GR
- Техническое примечание: Все буферы должны храниться в холодильнике, и каждый шаг этого протокола, в том числе центрифугирования и инкубации, должны быть выполнены на льду или при температуре 4 ° С, если не указано иное. Низкой температуры имеет важное значение для предотвращения деградации GR и белковых комплексов.
- Использование центрифуга с охлаждением, получать ~ 1-5 мл гранулы клеток, из которых выражает высокую концентрацию функциональных GR. Примеры клеточных источников богата GR включают мыши фибробластов L929 клеток, которые выражают высокую концентрацию эндогенных GR и Sf9 клетки, которые были инфицированы рекомбинантным GR бакуловирус (например p2Bac-MGR бакуловирус 12). Примерно 15-20 мл упакованных клеток получается один литр Sf9 культуре клеток бакуловирус. Клетки должны быть растет в геометрической прогрессии до уборки урожая. Центрифуга клеточной суспензии при 5000 х г в течение 5 мин.
- Промыть осадок клеток в три раза с 15 мл буферного солевого раствора Хэнкса. Между моет, мягко ресуспендирования гранул, а затем путем центрифугирования при 5000 х г в течение 5 мин. После последней стирки, полностью удалить надосадочную жидкость.
- Подготовка 7,5 мл буфера, содержащего гомогенизации HEM буфера (10 мМ HEPES, 1 мМ EDTA, 20 мМ молибдата натрия, рН 7,4), 1 мМ phenylmethylsulfonyl фторида (PMSF) и 3 земле таблетки Complete-Мини ингибитор протеазы. PMSF и Complete-мини таблетки предотвращения протеолиза от происходить в течение последующих шагов. Полное-Mini таблетки могут быть легко землю в мелкий порошок с помощью ступки и пестика. Добавить 1,5 объемами буфера для гомогенизации осадок клеток.
- Разрыв клеток Dounce гомогенизации (50 ударов) или замораживания / оттаивания (3 цикла) технику. Dounce гомогенизации может поддерживать улучшение эндогенного GR • Hsp90 белковых комплексов и быстрее, чтобы закончить. Замораживания / оттаивания предоставляет исследователю возможность приостановить протокола на этот шаг и продолжить на более позднее время. Dounce гомогенизации должна быть выполнена с гомогенизатор в ведерке со льдом, чтобы предотвратить деградацию белка. Замораживания / оттаивания может быть достигнуто путем замораживания центрифуге трубки, содержащей осадок клеток-гомогенизации буферной смеси с жидким азотом, сухим льдом, или -20 ° С инкубационный, после оттаивания в 30 ° С водяной бане.
- Отдельные GR-содержащих цитозоле от разрыва твердых частиц ячейки ультрацентрифугирования. Передача гомогената к долгосрочным труб ультрацентрифуге, баланс труб по массе в парах, и центрифуге при 100000 х г в течение 30 минут.
- Удалить цитозоле (супернатант) и хранят при температуре -20 ° C в 500 мкл аликвоты в 1,5 мл микроцентрифужных трубы для длительного хранения. Чтобы сохранить максимальную функциональную активность GR, флэш-заморозить порциями в жидком азоте или инкубировать 30 секунд в метанол-сухой ледяной бане перед хранением. Будьте осторожны, чтобы избежать прямого контакта кожи с охлаждением реагента.
2. Иммуноадсорбции ОТО от цитозоле клетки
- Техническое примечание: На рисунке 2 представлен схематический обзор Шаги 2-5 настоящего протокола.
- Подготовка смеси иммуноадсорбции содержащие моноклональные иммуноглобулина G (IgG) антитела, выдвинутых против г до immunoadsorb рецепторов подготовлен в шаге 1. В 1,5 трубки микроцентрифужных мл, смешайте 100 мкл талой GR-содержащих цитозоле, 200 мкл буфера TEGM (8 мм ТЭС, 4 мМ EDTA, 50 мМ NaCl, 20 мМ молибдата, 10% (объем / объем) глицерин, рН 7,6) , 100 мкл 20% белков-сефарозой (PAS) шлам (об. /, подготовленная в буфер TEGM) и 5 мкг анти-GR моноклональных антител IgG (например, BuGR2). Молибдата входит в TEGM буфером для того, чтобы помочь стабилизировать GR-Hsp90 heterocomplex, которая может быть полезна для анализа эндогенных стероидных heterocomplex связывающей активности 13.
- Анти-GR антител является коммерчески доступным как очищенный белок. Кроме того, он может быть получен путем добавления 10 мкл анти-GR IgG-содержащих асцит к смеси иммуноадсорбции. Асцит производится мышам вводили анти-GR гибридомных клеток (например, FiGR клетки гибридомы 14), а также приблизительную концентрацию антител, полученных из асцита и используемые в этих экспериментах составляла 0,5 мкг / мкл, измеренная с помощью анализа Брэдфорда.
- Подготовка отрицательный пример управления с использованием GR-содержащих цитозоле, TEGM буфер, и PAS (как описано выше), и 5 мкг IgG, которая не признает Г.Р., Hsp90, или другие белки шаперонов (именуемые "неиммунной" антитела).
- Из-за относительно большой размер PAS бисером, использование сократить P-200 наконечник пипетки при передаче PAS от 20% суспензии для пробирок с образцами. Советы Cut пипетки готовы, нарезая 2-3 мм от конца коммерчески доступных P-200 советов, тем самым увеличивая отверстие пипетки чаевые.
- Место образцов на вертикальных вращающихся колес и инкубировать в течение минимум 2-х часов при постоянном вращении. Образцы могутинкубируют в течение 8 часов без потери активности.
- По окончании инкубационного иммуноадсорбции, удаления несвязанных белков антителами PAS гранул ("immunopellet") с помощью центрифугирования. Отдельные супернатантах от immunopellets центрифугированием использованием охлажденного центрифуги запрограммирована в течение 1 минуты при 10000 × г, а затем промыть в два раза с 1 мл буфера TEGM и вихря. После центрифугирования, а также между мойками, отказаться от надосадочной быть осторожным, чтобы не беспокоить гранул.
- Удалите все супернатант при заключении второго стирки. Для того чтобы обеспечить ни один из гранул по неосторожности атмосферный, использование гофрированной P-200 наконечник пипетки для окончательного супернатант аспирации. Гофрированные советы пипетки готовятся уплощение коммерчески доступных P-200 советов использованием щипцов.
3. Диссоциация эндогенного Hsp90 из GR immunopellet ("Salt зачистки")
- Чтобы мыть immunopellet подготовлен в шаге 2, добавить 355 мкл буфера ТЭГ (TEGM буфера без натрия молибдата) и 45 мкл 5 М NaCl (конечная концентрация NaCl = 0,5 М).
- Место образцов на вертикальных вращающихся колес и инкубировать в течение 1,5 часа при постоянном вращении. Образцы могут быть инкубировали в течение до 2 часов, однако, больше инкубации может привести к снижению восстановления белков и нижней функциональной активности.
- Удаление несвязанных белков из immunopellet центрифугированием. Спиновые образцы в течение 1 минуты при 10000 × g. Вымойте раз с 1 мл TEG буфера и один раз с 1 мл 10 мМ HEPES буфере, рН 7,4.
- Удалите все супернатант при заключении второго мыть, стараясь не мешать immunopellet, с помощью гофрированной P-200 пипетки чаевые.
4. Восстановление ОТО • Hsp90 heterocomplex помощью молекулярных шаперонов, кофакторов и АТФ
- Техническое примечание: множество экспериментальных условиях может быть проверена путем включения дополнительных белков, кофакторов, активаторы или ингибиторы интерес в восстановлении смеси, приготовленной ниже. Общий объем разведения смеси должна быть <120 мкл.
- Для каждой соли лишил immunopellet подготовлен в шаге 3, добавьте восстановления смеси, содержащей 50 мкл источника молекулярного шаперона и 5 мкл АТФ-порождающая система (10 мМ HEPES, 50 мМ АТФ, 250 мМ креатинфосфата, 20 мМ ацетат магния , 100 ед / мл креатинфосфокиназы, рН 7,4).
- Восстановление реакции может быть увеличена путем дополнения восстановления смеси с 50 мкл HKD буфера (10 мМ HEPES, 100 мМ KCl, 5 мМ дитиотреитол (DTT), рН 7,4), и дополнительные 5 мкл АТФ генерирующей системы. Этот шаг может быть опущен, если достаточное восстановлению и стероидных обязательными не наблюдается. KCl увеличивает hsp70 активность АТФ-азы и DTT защищает цистеин-содержащие белки от окисления 9.
- Рекомендуется источника молекулярного шаперона является коммерчески доступным лизата ретикулоцитов кролика. Индивидуальные молекулярных шаперонов очищенный от ретикулоцитов лизата или рекомбинантно выражена (например, 15 мкг Hsp90, 15 мкг hsp70, 0,6 мкг-хоп, 6 мкг p23, и 0,125 мкг hsp40 в HKD буфера), также могут быть использованы.
- Инкубируйте образцы в 30 ° С на водяной бане ровно 20 минут. Флик трубы через каждые 1-2 минут, чтобы мягко беспокоить гранул и смешать восстановления решения.
- Добавить 1 мл TEGM буфера, вихрь, и центрифуге при 10000 х г в течение 1 минуты. Удалить супернатант и отказаться тем, чтобы не мешать гранул. Повторите эти действия для всего три стирок. Полностью удалите супернатант при заключении окончательного смойте гофрированные P-200 пипетки чаевые.
5. Анализ восстановленные комплексы белков и лигандов деятельности
- Белки в восстановленной immunopellet можно определить по обычным денатурирующих электрофореза в полиакриламидном геле (SDS-PAGE), микрожидкостных электрофореза (например, Bio-Rad Experion), и западной промокательной (рис. 3). Техническое примечание: Отлично протоколов описания SDS-PAGE 15 и западной промокательной 16 в настоящее время доступны, любезно другими исследователями.
- Добавить 50 мкл SDS-PAGE образец буфера, содержащего β-меркаптоэтанола и вихря. Конкретные рецепты буфера образца различаются. Выберите один основанный на рекомендации производителя электрофореза систему, которая будет занято.
- Инкубировать в течение 5 минут в кипящей водяной бане или 100 ° С электронным блоком тепло.
- Центрифуга на 10000 х г в течение 1 минуты. Immunoadsorbing антител, GR, и белки в комплексе с GR будет рассматриваться в отрыве друг от друга и выпущены в надосадочной буфера образца.
- Передача супернатант в новую пробирку микроцентрифужных использованием гофрированных наконечник P-200 пипетки чаевые. Откажитесь от гранул. Образца в настоящее время подготовлен для анализа с использованием коммерчески доступных SDS-PAGE или микрожидкостных систем электрофореза. Полное либо технику еосле инструкциям производителя.
- Вестерн-блот анализ следующих SDS-PAGE позволяет для окончательного определения immunoadsorbed GR и молекулярных шаперонов в комплексе с GR следующие восстановления инкубации. Использование моноклональных антител, первичная против GR (BuGR2), Hsp90 (AC88), hsp70 (N27F3-4) и со-шаперонов белков для выявления основных компонентов GR • Hsp90 белкового комплекса.
- Функциональные активации соли лишил GR следующие восстановление GR • Hsp90 белковый комплекс может быть идентифицирована путем анализа стероидных обязательным деятельности с использованием [3 H] стероидов (рис. 4). В течение оставшейся части протокола, следуйте необходимые меры предосторожности для безопасной обработки тритий образцов и отходов.
- Для восстановленного immunopellet, добавьте 47,5 мкл буфера HEM и 2,5 мкл 2 мкМ [3 H] дексаметазоном (конечная концентрация стероидных = 100 нм).
- Аккуратно перемешайте гранулы стараясь свести к минимуму количество образца перемещенных к стене микроцентрифужных трубки.
- Инкубируйте ночь на льду. Не стоит повернуть или смесь пробирок с образцами в течение этого инкубации.
- Добавить 1 мл TEGM буфера, аккуратно перемешать и центрифуге при 10000 х г в течение 1 минуты. Отменить супернатанта, вспоминая она содержит несвязанные [3 H] стероид. Повторите эти действия для в общей сложности 3 смывает с буфером TEGM.
- Полностью удалите супернатант при заключении окончательного смойте гофрированные P-200 пипетки чаевые. Гранула содержит Г.Р., Hsp90 и других молекулярных шаперонов в комплексе с GR, и [3 H] стероидных специфически связывается с рецептором. Неспецифическое связывание можно вычислить, в том числе 1000-кратного избытка не-тритием дексаметазона в ночь смесь инкубации. В качестве альтернативного отрицательный контроль, анти-GR immunoadsorbing антител добавили в шаге 2,2 могут быть заменены без GR-immunoadsorbing антител (NI).
- Приостановить мыть immunopellets в 200 мкл буфера TEGM и передачи до 10 мл сцинтилляционного флаконах использованием сократить P-200 пипетки чаевые.
- Добавить 4,8 мл сцинтилляционного коктейля флаконов и вихря.
- Количества [3 H] стероидных привязки к восстановленной GR • Hsp90 белковый комплекс может быть проанализированы с использованием жидкого сцинтилляционной спектрометрии.
6. Представитель Результаты:
Представитель SDS-PAGE и западной данных пятно, представлены на рисунке 3. Эндогенных GR • Hsp90 heterocomplex является immunoadsorbed от цитозоле клетки с использованием анти-GR антител и индивидуальных белков, которые совместно с immunoadsorb ОТО визуализируется Кумасси окрашивания (рис. 3А). Подтверждение белка личность какого-либо компонента immunopellet на любом этапе восстановления анализа могут быть сделаны SDS-PAGE расчета молекулярной массы и западных промокательной с использованием моноклональных антител, против белок.
Восстановленный GR • Hsp90 гетерокомплексов представлены с использованием электрофореза Experion микрожидкостных данных (рис. 3C и 3D) и западной блот-анализа (рис. 3В). Специфика GR иммуноадсорбции подтверждается замене immunoadsorbing анти-GR антитела с неиммунной антител (рис. 3, Н. И. IgG дорожек). Даже тогда, когда чрезмерное количество неиммунной антитела используются, нет GR или молекулярных шаперонов являются иммунопреципитации (см. на рис. 3C, GR, Hsp90 и hsp70 белковых полос, присутствующих в анти-GR полосы иммуноадсорбции с отсутствием группы наблюдались в Н. И. IgG дорожек). Точно так же можно утверждать, диссоциация Hsp90 и других белков шаперонов из соли лишил GR по-блот-анализ западных (рис. 3b) раздели и восстановленные immunopellets. Тяжелой цепи immunoadsorbing антител (HC) можно обнаружить как Кумасси пятно промокательной и западных, и это служит подтверждением равные по размеру immunopellets настоящее время визуализируется в каждом переулке.
Стероиды связывающей активности immunoadsorbed GR могут быть проанализированы на всех условий испытания, а также представитель стероидных обязательные данные представлены на рисунке 4. Эндогенные GR • Hsp90 гетерокомплексов являются immunoadsorbed, соль-раздевают, и восстановлена. Используя либо ретикулоцитов лизата или очищенных белков, стероидные связывающей активности восстановленного GR • Hsp90 heterocomplex обычно возвращается к 75-100% от эндогенных GR • Hsp90 уровня связывания деятельности. Как и электрофореза данных, неиммунной антител (NI), могут быть использованы вместо анти-GR антител (I) для того, чтобы служить в качестве отрицательного контроля и в качестве меры неспецифической [3 H] стероидных обязательными.
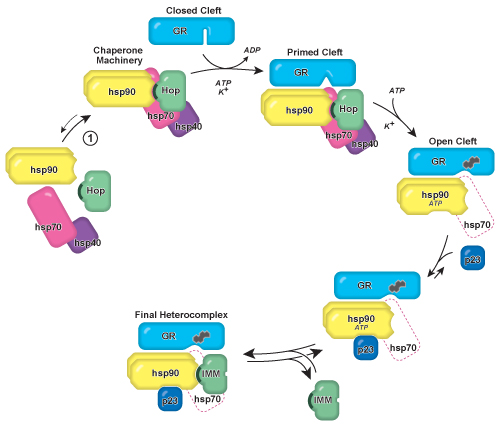
Рисунок 1. Модель GR • Hsp90 сборки heterocomplex и GR стероидных обязательным расщелина открытия. Hsp90/hsp70-based техники шаперона преобразует GR лиганд-связывающий домен из следуюДед конформации, в которых стероидные обязательным щель закрыта и недоступна для гормона открытых расщелина конформации которые могут быть доступны (иллюстрируется гетероциклические стероидных значок). Сопровождающих машин собранном в клетке и спонтанно образуются, когда очищенная Hsp90, Hsp70, и хоп смешиваются в растворе (реакция 1). Хоп содержит 34 аминокислот повторить tetratricopeptide кислоты (TPR) домена (показан в виде темных полумесяца), и впоследствии заменены в процессе созревания heterocomplex по TPR домена содержащих immunophilin белка. Техники открывает стероидных обязательным расщелина в ATP-и K +-зависимым способом, после чего хоп, и большинство из hsp70 и hsp40 в конечном итоге оставить комплекс (показан в виде пунктирной значок). Механистически, hsp70 взаимодействует с GR до Hsp90 и простых рецептором для Hsp90 и последующего открытия расщелины. Экспериментально, стероидные обязательными и GR расщелина открывания увеличивается, если Hsp90 и hsp70 одновременно присутствуют. Heterocomplex стабилизируется вступления Hsp90 совместно шаперона p23, который поддерживает Hsp90 в АТФ-связанной конформации. После выхода хоп, высоким молекулярным весом immunophilin (IMM) могут связываться Hsp90, образуя окончательное heterocomplex как он оправился от клетки. По материалам Пратт и Тофт 1.
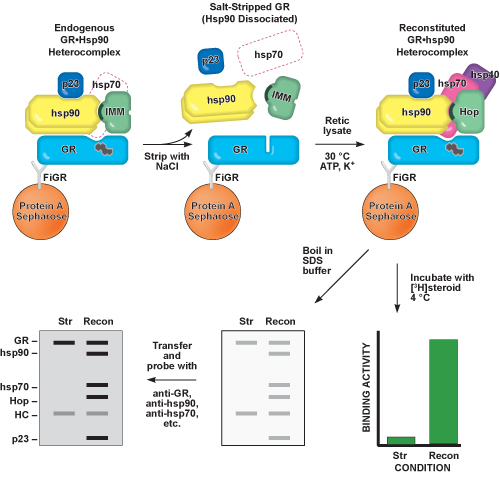
Рисунок 2. Схематическое изображение Шаги 2-5 настоящего протокола. ОТО immunoadsorbed от цитозоле клетки использованием моноклональных антител, выдвигаемые против GR (FiGR), связанные с гранулы белка-сефарозой. Hsp90 и других белков, присутствующих в шаперона эндогенных GR • Hsp90 heterocomplex являются со-immunoadsorbed с GR и GR способен связываться с стероид. Hsp90 является отделена от GR используя мягкое лечение солью, называют соли зачистки (СТО). Стероидных обязательным расселине соли лишил GR закрывается, делая его неспособным связываться с стероид. Промежуточные GR • Hsp90 гетерокомплексов содержащие hsp70, hsp40, и хоп, которые способны связывать стероидные, может быть восстановлена (Recon) путем инкубации соли лишил GR с очищенными белками или ретикулоцитов лизат (Retic лизат) и кофакторов. Стероидных связывающей активности и immunopellet содержание белка в каждый шаг может быть идентифицирован ночь [3 H] стероидных инкубации и западных промокательной, соответственно.
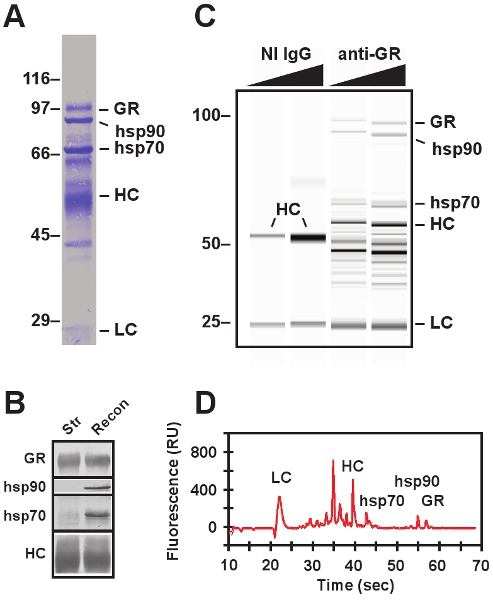
Рисунок 3. Электрофоретический анализ белка immunoadsorbed комплексов. , SDS-PAGE восстановленного GR • Hsp90 heterocomplex отображаемого использованием обычной системы электрофореза следует электропереноса и Кумасси окрашивания. В дополнение к GR, Hsp90 и Hsp70, тяжелой цепью (НС) и легкой цепи (LC) антител визуализируются. Миграция маркеры молекулярного веса (в кДа) указаны на левой. B, иммуноблоттинга из immunopellets содержащие соли лишил GR (Str) и восстановленного GR • Hsp90 heterocomplex (Recon). С виртуальными гель восстановленного GR • Hsp90 heterocomplex создан с помощью электрофореза Experion микрожидкостных системы. Два разных концентрациях неиммунной (Н. И. IgG) и иммунные (анти-GR) immunoadsorbing антител включены. Н. И. IgGs служить отрицательные контроли. D, electropherogram восстановленного GR • Hsp90 heterocomplex получена из Experion микрожидкостных электрофорез образца, показанного на третьем ряду панелей Преимущества Б. из микрожидкостных электрофореза включать требование для небольших объемов проб, снижение наливных и после выполнения очистки, улучшение количественных и существенно короче пример работает.

Рисунок 4. Стероиды связывающей активности immunopellets следующие иммуноадсорбции эндогенных GR (Enodg), соль-раздели GR (ул), а также восстановленные GR • Hsp90 heterocomplex (Recon). В дополнение к immunoadsorbing GR с моноклональными анти-GR immunoadsorbing антител (I), отрицательные контрольные образцы для каждого условия были приготовлены с использованием неиммунной иммуноглобулина (NI).
Обсуждение
Анализа, описанного выше, может быть адаптирована для проверки множества условий, влияющих на действия шаперонов hsp90/hsp70-based техники шаперона а также GR стероидных обязательными. Она является модификацией ранее сообщалось методы 4,8,9,17 и предназначен, чтобы воспользоваться последн?...
Раскрытие информации
Выберите электрофореза реагенты и программное обеспечение для анализа изображений были предоставлены Bio-Rad.
Благодарности
Эта работа финансировалась Национальным институтом здоровья грант GM086822, Надежда института сердца фундаментальных наук награду, и MJ Мердок Благотворительный фонд колледжа науки исследовательской программы. Выберите электрофореза реагенты и программное обеспечение для анализа изображений щедро предоставляемые Bio-Rad.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
|---|---|---|---|
| Sf9 клетках насекомых | Invitrogen | бакуловирус для экспрессии рекомбинантных GR мыши | |
| Клеток L929 | АТСС | CRL-2173 | для эндогенных мыши GR цитозоле подготовки (альтернатива бакуловирус выражение) |
| FiGR клетки гибридомы | АТСС | CRL-2173 | для подготовки асцит содержащие анти-GR моноклональных антител (альтернатива очищенной BuGR2 антитела) |
| Полное-Mini ингибитор протеазы, ЭДТА без | Roche Applied Science | 11836170001 | |
| белок-сефарозой | Sigma-Aldrich | P3391 | |
| ретикулоцитов кролика лизат | Зеленый Га (штат Орегон, WI) | богатым источником эндогенной hsp90/hsp70 техники шаперона | |
| креатинфосфокиназы | Sigma-Aldrich | C3755 | для АТФ-система регенерации |
| фосфокреатина | Sigma-Aldrich | P7936 | для АТФ-система регенерации |
| анти-GR мышиных моноклональных антител (BuGR2) | Пирс / Thermo Scientific | MA1-510 | используется для GR иммуноадсорбции и как первичных антител в западных промокательной |
| анти-Hsp90 мышиных моноклональных антител (AC88) | Энцо наук о жизни | ADI-SPA-830 | используются в качестве первичных антител в западных промокательной |
| анти-hsp70 мышиных моноклональных антител (N27F3-4) | Энцо наук о жизни | ADI-SPA-820 | используются в качестве первичных антител в западных промокательной |
| IgG в сыворотке мыши | Sigma-Aldrich | 038K7690 | используется в качестве неиммунной антител для отрицательного контроля иммуноадсорбции |
| анти-мышиных IgG-пероксидазы сопряженным | Sigma-Aldrich | A4416 | использованы в качестве вторичных антител в западных промокательной |
| Experion микрожидкостных электрофореза системы | Bio-Rad | 7007001 | альтернативой традиционным SDS-PAGE |
| [1,2,4,6,7 - 3 H] дексаметазон | PerkinElmer | NET1192001MC | следовать технике безопасности |
Ссылки
- Pratt, W. B., Toft, D. O. Regulation of signaling protein function and trafficking by the hsp90/hsp70-based chaperone machinery. Exp. Biol. Med. 228, 111-133 (2003).
- Murphy, P. J. M. Regulation of glucocorticoid receptor steroid binding and trafficking by the hsp90/hsp70-based chaperone machinery: implications for clinical intervention. Leukemia. 19, 710-712 (2005).
- Pratt, W. B., Morishima, Y., Osawa, Y. The Hsp90 chaperone machinery regulates signaling by modulating ligand binding clefts. J. Biol. Chem. 283, 22885-22889 (2008).
- Dittmar, K. D., Hutchison, K. A., Owens-Grillo, J. K., Pratt, W. B. Reconstitution of the steroid receptor•hsp90 heterocomplex assembly system of rabbit reticulocyte lysate. J. Biol. Chem. 271, 12833-12839 (1996).
- Morishima, Y. The Hsp organizer protein hop enhances the rate of but is not essential for glucocorticoid receptor folding by the multiprotein Hsp90-based chaperone system. J. Biol. Chem. 275, 6894-6900 (2000).
- Murphy, P. J. M., Kanelakis, K. C., Galigniana, M. D., Morishima, Y., Pratt, W. B. Stoichiometry, abundance, and functional significance of the hsp90/hsp70-based multiprotein chaperone machinery in reticulocyte lysate. J. Biol. Chem. 276, 30092-30098 (2001).
- Dittmar, K. D., Pratt, W. B. Folding of the glucocorticoid receptor by the reconstituted Hsp90-based chaperone machinery. The initial hsp90.p60.hsp70-dependent step is sufficient for creating the steroid binding conformation. J. Biol. Chem. 272, 13047-13054 (1997).
- Kanelakis, K. C. Differential effects of the hsp70-binding protein BAG-1 on glucocorticoid receptor folding by the hsp90-based chaperone machinery. J. Biol. Chem. 274, 34134-34140 (1999).
- Morishima, Y., Kanelakis, K. C., Murphy, P. J. M., Shewach, D. S., Pratt, W. B. Evidence for iterative ratcheting of receptor-bound hsp70 between its ATP and ADP conformations during assembly of glucocorticoid receptor.hsp90 heterocomplexes. Biochemistry. 40, 1109-1116 (2001).
- Murphy, P. J. M. Pifithrin-alpha inhibits p53 signaling after interaction of the tumor suppressor protein with hsp90 and its nuclear translocation. J. Biol. Chem. 279, 30195-30201 (2004).
- Murphy, P. J. M., Morishima, Y., Kovacs, J. J., Yao, T. P., Pratt, W. B. Regulation of the dynamics of hsp90 action on the glucocorticoid receptor by acetylation/deacetylation of the chaperone. J. Biol. Chem. 280, 33792-33799 (2005).
- Morishima, Y., Murphy, P. J. M., Li, D. P., Sanchez, E. R., Pratt, W. B. Stepwise assembly of a glucocorticoid receptor•hsp90 heterocomplex resolves two sequential ATP-dependent events involving first hsp70 and then hsp90 in opening of the steroid binding pocket. J. Biol. Chem. 275, 18054-18060 (2000).
- Pratt, W. B., Toft, D. O. Steroid receptor interactions with heat shock protein and immunophilin chaperones. Endocr. Rev. 18, 306-360 (1997).
- Bodwell, J. E. Identification of phosphorylated sites in the mouse glucocorticoid receptor. J. Biol. Chem. 266, 7549-7555 (1991).
- Penna, A., Cahalan, M. W. e. s. t. e. r. n. Blotting using the Invitrogen NuPage Novex Bis Tris minigels. J. Vis. Exp. (7), e264-e264 (2007).
- Choo, Y. S., Zhang, Z. Detection of Protein Ubiquitination. J. Vis. Exp. (30), e1293-e1293 (2009).
- Murphy, P. J. M. Visualization and mechanism of assembly of a glucocorticoid receptor•Hsp70 complex that is primed for subsequent Hsp90-dependent opening of the steroid binding cleft. J. Biol. Chem. 278, 34764-34773 (2003).
- Schrum, A. G. High-sensitivity detection and quantitative analysis of native protein-protein interactions and multiprotein complexes by flow cytometry. Sci STKE. 389, pl2-pl2 (2007).
- Davis, T. R., Schrum, A. G. IP-FCM: Immunoprecipitation Detected by Flow Cytometry. J. Vis. Exp. (46), e2066-e2066 (2010).
- Felts, S. J., Karnitz, L. M., Toft, D. O. Functioning of the Hsp90 machine in chaperoning checkpoint kinase I (Chk1) and the progesterone receptor (PR). Cell Stress Chaperones. 12, 353-363 (2007).
- Cintron, N. S., Toft, D. Defining the requirements for Hsp40 and Hsp70 in the Hsp90 chaperone pathway. J. Biol. Chem. 281, 26235-26244 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены