Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Изображений G-белком рецептор (GPCR)-опосредованной сигнализации События, управления хемотаксис Dictyostelium Discoideum
В этой статье
Резюме
Здесь мы описываем подробные изображения живой клетки методы исследования хемотаксиса. Мы представляем флуоресценции микроскопических методов контроля пространственно-временной динамике сигнальных событий в мигрирующих клетках. Измерение сигнальных событий позволяет нам понять, как дальше GPCR-сети сигнализации достигает градиент зондирования хемоаттрактантов и контролирует направленного миграции эукариотических клеток.
Аннотация
Многие эукариотических клетках может обнаружить градиенты химических сигналов в своей среде и мигрировать соответственно 1. Это руководствоваться миграции клеток называется как хемотаксис, что очень важно для различных клеток для выполнения своих функций, таких как торговля иммунных клеток и структурирование нервных клеток 2, 3. Большое семейство G-белком рецепторы (GPCR) обнаруживает переменную небольшие пептиды, известные как хемокины, направить миграции клеток в естественных условиях 4. Конечной целью исследования хемотаксиса чтобы понять, как машины GPCR чувств хемокинов градиенты и контроля сигнализации событий, приведших к хемотаксис. С этой целью мы используем методы визуализации для мониторинга в режиме реального времени, пространственно-временной концентрации хемоаттрактантов, сотовые движения в градиенте хемоаттрактант, GPCR опосредованной активации гетеротримерные G-белком, и внутриклеточных сигнальных событий, участвующих в хемотаксис клеток эукариот 5-8 . Простой эукариотических организмов, Dictyostelium discoideum, отображает chemotaxic поведения, которые аналогичны тем, лейкоцитов и D. discoideum является ключевым модельной системой для изучения эукариотических хемотаксис. Как свободно живущих амеб, Д. discoideum клетки делятся в богатой среде. После голода, клетки вступают программа развития, в котором они совокупный через цАМФ-опосредованной хемотаксис сформировать multicullular структур. Многие компоненты, участвующие в хемотаксис в лагерь были определены в D. discoideum. Связывание цАМФ с GPCR (car1) индуцирует диссоциации гетеротримерные G-белков в Gγ и Gβγ подразделения 7, 9, 10. Gβγ подразделения активировать Ras, который, в свою очередь, активирует PI3K, превращая PIP PIP 2 в 3 на клеточной мембране 11-13. PIP 3 служат сайты связывания белков с pleckstrin Гомология (PH) доменов, таким образом, набор этих белков с мембраной, 14, 15. Активация рецепторов car1 также контролирует мембраны объединений PTEN, который dephosphorylates PIP PIP 3 до 2 16, 17. Молекулярные механизмы эволюционно консервативных в хемокинов GPCR-опосредованной хемотаксис клеток человека, такие как нейтрофилы 18. Мы представляем следующие методы исследования хемотаксиса D. discoideum клеток. 1. Подготовка хемотаксиса клетки компонента. 2. Изображений хемотаксис клеток в цАМФ градиента. 3. Мониторинг GPCR индуцированной активации гетеротримерные G-белка в одном живых клеток. 4. Изображений хемоаттрактант запускаемой динамических PIP 3 ответов в одном живых клеток в реальном времени. Наши разработанные методы визуализации могут быть применены для изучения хемотаксиса лейкоцитов человека.
протокол
1. Подготовка хемотаксиса компетентные клетки discoideum Dictyostelium
- Для создания Д. discoideum клетки, которые хемотаксиса к хемоаттрактант цАМФ, урожай клеток, растущих в D3-T мультимедийных от тряски культуры при 22 ° C.
- Вымойте клетки дважды в непитательных развития буфера (DB буфера, содержащего 5 мМ Na 2 HPO 4, 5 мМ KH 2 PO 4, 2 мМ MgCl 2 и 0,1 мМ CaCl 2).
- Повторное приостановить клеток в DB буфера при плотности 2х10 7 клеток / мл.
- Встряхните 10 мл клеток в 250 мл колбу на 100 оборотов в минуту при 22 ° С в течение одного часа.
- Доставить по 100 мкл 7,5 фондовом цАМФ мкМ до 10 мл клетки каждые шесть минут в течение 6 часов, чтобы достичь конечной концентрации 75 нМ цАМФ, процесс обозначается как цАМФ пульсирующий лечения. Через 5-6 часа цАМФ пульсирующий лечения, Д. discoideum клетки становятся хемотаксиса компетентных к цАМФ градиента.
- Сбор клетки центрифугированием при 200 г в течение 5 мин, а затем ресуспендирования клеток с буфера БД, содержащей 2,5 мМ кофеином, и встряхнуть при 200 оборотов в минуту при 22 ° С в течение 20 мин до basolate ячейки хемотаксиса ситуации.
2. Изображений chemotaxing клеток в видимом и манипулировать хемоаттрактант градиент
- Засыпка микропипетки со свежеприготовленным 30 мкл раствора 1 мкМ цАМФ и Alexa 594 в 0.1μg/μl в буфер DB.
- Прикрепите к Femtotip микропипетки держателя и подключить трубку к аппарата давление подачи, Эппендорф FemtoJet системы.
- Прикрепить микропипетки сборки микроманипулятора (Eppendorf TransferMan NK2) моторизованные микроманипулятора обеспечить постоянное давление с целью установления стабильного градиента.
- Гора одна и LabTek камере, наполненной 6 мл буфера БД более 40х объектив нефти на конфокальной микроскопии и использовать яркие оптики, центр Femtotip в поле зрения.
- Включите давление питания и установить компенсации давления (PC) на 70 гПа установить градиент цАМФ / Alexa 594 смеси.
- Визуализируйте цАМФ градиент, мониторинг смесь требуемой концентрации цАМФ и Alexa 594 флуоресценции с помощью возбуждения с лазерной линии 543 нм.
- Использование автоматического позиционирования функции микроманипулятора поставить микропипетки в желаемых местах и установить их как положение 1, положение 2, и позиция 3 манипулировать градиент к какой ячейке подвергаются.
3. Неподвижный неполяризованного системы клетки облегчает изображений сигнальных событий, участвующих в цАМФ градиент зондирования
- После кофеином, удалить аликвоту клеток и центрифуге при 500g в течение 3 мин.
- Удалить буфер и разбавленных клетки до 5х10 5 клеток / мл свежего буфера БД, содержащей 2,5 мМ кофеина.
- Нанести 1 мл клеточной суспензии для одного хорошо камере или 0,4 мл в каждую лунку четыре хорошо камере.
- Разрешить клетки придерживаться в течение 10 мин, тщательно пипетки с буфером для удаления одинокие клетки и заменить с тем же объемом.
- Найдите нужный клетки под микроскопом и начать съемки.
- Для эксперимента, предназначенная для контроля динамики сигнализации компонентов в клетках подвергая на устойчивый градиент, лечения клеток с 5,0 мкм (конечная концентрация) Latrunculin В течение 10 мин до начала экспериментов.
4. Одновременный мониторинг гетеротримерные G активация белка и PIP 3 производства
- цАМФ пульсирующие клетки разработки совместного выражения и GαCFP YFPGβ (G клеток) и клеток, экспрессирующих PIP 3 показатель PH-GFP (PH клетки) 7.
- Смешайте эти два типа клеток с соотношении 1:1 и пластины их в одной скважины или 4-х и камер.
- Создание и сохранение выбросов отпечатков пальцев ссылкой кривой CFP, YFP и GFP с помощью лямбда-стека Приобретение режиме в спектральном диапазоне от 464 до 624 нм с шириной 10 нм.
- Одновременно образ G белка активации в клетках G и PIP 3 производства в PH клетки, используя при том же режиме стека Приобретение Lambda в спектральном диапазоне от 464 до 544 нм с шагом 10 нм.
- Применить Линейная функция Unmixing программного обеспечения Zeiss 510META использованием сохранены CFPand YFP и излучение отпечатки пальцев для математически вычислить вклад каждого флуорофора в стек Lambda отделить CFP и YFP интенсивности в отдельных каналов в группе G.
- С той же стратегии, применяются линейные функции Unmixing использованием GFP сохранены отпечатки пальцев и фонового излучения математически вычислить интенсивность в GFP PH клеток.
5. Представитель результаты:
- Отличная система модели Д. discoideum для GPCR опосредованной хемотаксис. социальные амебы, Д. discoideum экспонатов поразительно хемотаксис в течение жизненного цикла. Из-за своей генетической и биохимической преимущества, Д. г обеспечивает мощный ыystem для изучения хемотаксиса.
- Хемотаксис клеток под видимым и манипулировать chemoattract полей. Здесь мы впервые показать простую методологию для получения линейной зависимости между концентрацией цАМФ и интенсивность флуоресцентного красителя Alexa 594 от разбавления серии 2 мкМ цАМФ смешивали с 10 мкг / мл Alexa 594 (рис. 2). Далее, мы предлагаем простой способ визуализировать градиент, кроме того, установить количественные измерения концентрации цАМФ из градиент, интенсивность Alexa 594 (рис. рис. 2B).
- Сотовые подвижность несвязанных с поляризацией клеток и направленного зондирования. Ингибитор полимеризации актина устраняет уже существующие морфологические полярности, а также предотвращает движения клетки при сохранении клеток возможность направленного зондирования (рис. 3А). Занятость видимых и манипулировать цАМФ стимуляции гарантии ввода, например единообразно применяться стимуляции или градиент. Этот метод позволяет количественного анализа цАМФ-индуцированной перераспределение ключевых компонентов сигнализации в градиенте зондирования техники. Измеренные пространственно-временной динамике этих сигнальных компоненты позволяют нам понять, как сети сигнализации достигается адаптация к единому стимуляции при создании поляризованных биохимических ответы на градиентов (рис. 3б).
- Системная измерения кинетики chemosensing сети сигнализации при воздействии устойчивый градиент. Чрезвычайно важно для измерения динамики / Кинетика направленного зондирования сигнализации компоненты, чтобы понять, как каждый компонент вносит свой вклад в создание внутриклеточной поляризации, когда клетки опыт первого градиента. Применение живого изображения клетки с высоким темпом пространственное разрешение, покажем сначала, двухфазный PIP3 производства ячейки, которая подвергается постоянным градиентом цАМФ (рис. 4A-C). Применение жить изображений клетки, мы систематически измерять динамику направленности зондирования конкретных сети сигнализации из лагеря стимуляции PIP3 производства (рис. 4, Е).
- Одновременный мониторинг гетеротримерные белка G активации и PIP 3 производства по ровным слоем цАМФ стимуляцией. Ферстер резонанс передачи энергии (сокращенно FRET) обеспечивает эффективный подход к мониторингу гетеротримерные белка G активации (диссоциации) на цАМФ стимуляции. Здесь мы описали удобный простой внедрять систему для одновременного измерения гетеротримерные белка G активации и PIP 3 производства путем мониторинга FRET изменения и мембраны транслокации PIP 3 зонд, PH-GFP в С и рН клеток соответственно (рис. 5 ). Единообразно применяться цАМФ стимуляция вызывает стойкие белка G в то время как активация которых вызывает переходные PIP 3 производства.
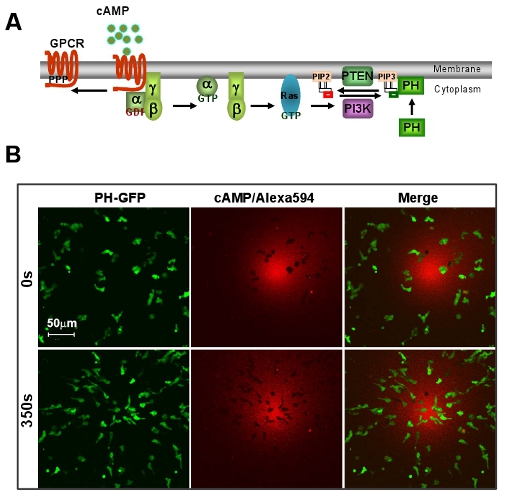
Рисунок 1: отличная система модели Д. discoideum для хемотаксиса GPCR опосредованной. А. Схема показывает краткую сигнального пути направленного зондирования. Б. цАМФ градиент вызывает быстрое хемотаксис D. discoideum клеток. Клетки выразить PIP 3 зонд, PH-GFP (зеленый). Градиент (красный) визуализируется Alexa 594. Шкала бар = 50 мкм.
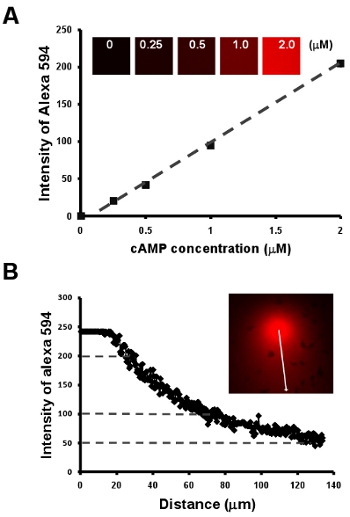
Рисунок 2: хемотаксис клеток под видимым и манипулировать chemoattract полей. А. На графике показана линейная зависимость между концентрацией цАМФ и интенсивность флуоресцентного красителя Alexa 594 от разбавления серии 2 мкМ цАМФ смешивали с 10 мкг / мл Alexa 594. Б. Количественное измерение концентрации цАМФ градиент линейной зависимости концентрации цАМФ и интенсивности флуоресцентного красителя Alexa 594 в A.

Рисунок 3: Сотовый подвижность несвязанных с поляризацией клеток и направленного зондирования. А. На рисунке показано, что неподвижный клеток лечения ингибитора полимеризации актина Latrunculin B поддержания способности направленного зондирования. Клетки выразить PIP 3 зонд, PH-GFP (зеленый). Градиент (красный) визуализируется Alexa 594. Б. манипулировать цАМФ стимуляции и неподвижные клеточной системы позволяет для решения ключевых вопросов, направленных зондирования. Шкала бар = 10 мкм.

Рисунок 4: Системная измерения кинетики chemosensing сети сигнализации при воздействии устойчивый градиент. А. Монтаж показывает двухфазный PIP 3 производства (Green) из клетки, которая подвергается постоянным градиентом цАМФ (красный). B. На рисунке показано регионах интересов (трансформирования) для измерения кинетики PIP 3 продукция, представленная в С. С . Кинетика ое PIP 3 производства в клетки подвергаются постоянным градиентом. Д. Схема показывает, сети сигнализации направленного зондирования из лагеря стимуляции PIP 3 производства. Их кинетика при воздействии устойчивый градиент представлена в том же цвете сплошные линии на E.

Рисунок 5: Одновременный мониторинг нескольких событий GPCR сигнализации сетей. А. Схема показывает одновременное измерение гетеротримерные белка G активации и PIP 3 производства путем мониторинга FRET изменения и мембраны транслокации PIP3 зонд, PH-GFP в С и рН клетки, соответственно. Б. Монтаж изображения радуги G и PH клетки показывает, , что ровным слоем цАМФ стимуляция вызывает стойкие белка активации G на клеточном периферические, в то время, который вызывает переходные PIP3 производства. Время до точки (0s) и после стимуляции 4.9s, и 10.2s 20.4s. С. Кинетика G активация белка и PIP3 производства по ровным слоем цАМФ стимуляции.
Обсуждение
Процессы идущие хемотаксиса компетентных этапе клетки
Для дикого типа D. discoideum клетки, она занимает около 5 ~ 6 часов пульсирующий развития при комнатной температуре, чтобы побудить их в хорошо хемотаксиса компетентных стадию, при которой клетки дисплей хорошо поляри?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа проводится при поддержке очной фонд из NIAID, NIH.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
|---|---|---|---|
| D3-T Медиа роста | К. Д. Медицинские | ||
| Кофеин | Сигма | ||
| Latrunculin B | Молекулярные зонды | ||
| Alexa 594 | Молекулярные зонды | ||
| цАМФ | Сигма | ||
| ChronTrol XT программируемый таймер | ChronTrol Corp | ||
| Miniplus 3 перистальтического насоса | Gilbson | ||
| Платформа роторном шейкере | |||
| FemtoJet микрокапиллярных давление питания | Эппендорф | ||
| Одно-и четырех-и Lab-Tek II покровного стекла камеры | Nalge Nunc Международной | ||
| LSM 510 META или эквивалент флуоресцентного микроскопа | Zeiss | 40X 1,3 НС или 60X 1,4 Н. А. масла ДВС План-Neofluar объектива | |
| Olympus X81 или эквивалент | Олимп | Требуется 100X 1,47 NA TIRF объектив |
Ссылки
- Lijima, M., Huang, Y. E., Devreotes, P. Temporal and spatial regulation of chemotaxis. Dev Cell. 3, 469-469 (2002).
- Murphy, P. M. The molecular biology of leukocyte chemoattractant receptors. Annu Rev Immunol. 12, 593-593 (1994).
- Devreotes, P. N. G protein-linked signaling pathways control the developmental program of Dictyostelium. Neuron. 12, 235-235 (1994).
- Jin, T., Xu, X., Hereld, D. Chemotaxis, chemokine receptors and human disease. Cytokine. 44, 1-1 (2008).
- Meier-Schellersheim, M. Key role of local regulation in chemosensing revealed by a new molecular interaction-based modeling method. PLoS Comput Biol. 2, e82-e82 (2006).
- Xu, X. Coupling mechanism of a GPCR and a heterotrimeric G protein during chemoattractant gradient sensing in Dictyostelium. Sci Signal. 3, 71-71 (2010).
- Xu, X., Meier-Schellersheim, M., Jiao, X., Nelson, L. E., Jin, T. Quantitative imaging of single live cells reveals spatiotemporal dynamics of multistep signaling events of chemoattractant gradient sensing in Dictyostelium. Mol Biol Cell. 16, ra71-ra71 (2005).
- Xu, X., Meier-Schellersheim, M., Yan, J., Jin, T. Locally controlled inhibitory mechanisms are involved in eukaryotic GPCR-mediated chemosensing. J. Cell Biol. 178, 141-141 (2007).
- Jin, T., Zhang, N., Long, Y., Parent, C. A., Devreotes, P. N. Localization of the G protein betagamma complex in living cells during chemotaxis. Science. 287, 1034-1034 (2000).
- Janetopoulos, C., Jin, T., Devreotes, P. Receptor-mediated activation of heterotrimeric G-proteins in living cells. Science. 291, 2408-2408 (2001).
- Funamoto, S., Milan, K., Meili, R., Firtel, R. A. Role of phosphatidylinositol 3' kinase and a downstream pleckstrin homology domain-containing protein in controlling chemotaxis in dictyostelium. J. Cell Biol. 153, 795-795 (2001).
- Li, Z. Roles of PLC-beta2 and -beta3 and PI3Kgamma in chemoattractant-mediated signal transduction. Science. 287, 1046-1046 (2000).
- Sasaki, A. T., Chun, C., Takeda, K., Firtel, R. A. Localized Ras signaling at the leading edge regulates PI3K, cell polarity, and directional cell movement. J. Cell Biol. 167, 505-505 (2004).
- Meili, R. Chemoattractant-mediated transient activation and membrane localization of Akt/PKB is required for efficient chemotaxis to cAMP in Dictyostelium. EMBO J. 18, 2092-2092 .
- Parent, C. A., Blacklock, B. J., Froehlich, W. M., Murphy, D. B., Devreotes, P. N. G protein signaling events are activated at the leading edge of chemotactic cells. Cell. 95, 81-81 (1998).
- Funamoto, S., Meili, R., Lee, S., Parry, L., Firtel, R. A. Spatial and temporal regulation of 3-phosphoinositides by PI 3-kinase and PTEN mediates chemotaxis. Cell. 109, 611-611 (2002).
- Iijima, M., Devreotes, P. Tumor suppressor PTEN mediates sensing of chemoattractant gradients. Cell. 109, 599-599 (2002).
- Haastert, P. J. V. a. n., Devreotes, P. N. Chemotaxis: signalling the way forward. Nat Rev Mol Cell Biol. 5, 626-626 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены