Method Article
Живая изображений Ячейка Сенная Bacillus И Пневмококк С использованием средства аварийного Покадровый микроскопии
В этой статье
Резюме
Этот протокол обеспечивает шаг за шагом процедуру наблюдения одного поведение клеток различных бактерий во времени с использованием автоматизированных флуоресценции покадровой микроскопии. Кроме того, мы предоставляем руководящие принципы, как анализировать микроскопии изображений.
Аннотация
В течение последних нескольких лет ученые все больше осознают, что средние данные, полученные от микробного населения на основе экспериментов не являются репрезентативными для поведения, статуса или фенотипа отдельных клеток. Благодаря этому новому взглянуть число единичных исследованиях клетка плавно подниматься вверх (для последних обзоров см. 1,2,3). Однако многие из одной ячейки применяются методы не позволяют мониторинга развития и поведения одного конкретного одной клетки во времени (например, проточной цитометрии или стандартный микроскопия).
Здесь мы предоставляем подробное описание микроскопии метод используется в нескольких недавних исследованиях 4, 5, 6, 7, который позволяет следить и записывать (флуоресценция) отдельных бактериальных клеток из Сенная палочка и стрептококковой пневмонии через рост и деление на протяжении многих поколений. В результате фильмы могут быть использованы для построения филогенетического дерева линии, прослеживая назад история одной ячейки в пределах популяции, которые произошли от одного общего предка. Это покадровой флуоресцентной микроскопии метод может не только быть использованы для исследования роста, деления и дифференцировки отдельных клеток, но также проанализировать влияние истории клеток и происхождения по конкретным сотовой поведения. Кроме того, покадровой микроскопии идеально подходит для изучения динамики экспрессии генов и белков во время локализации бактериального клеточного цикла. Метод объясняет, как подготовить бактериальных клеток и построить стекло микроскопа для того, чтобы следствием одной клетки в микроколоний. Короче говоря, отдельных клеток выставляются на полутвердые поверхность, состоящая из ростовой среды дополнен агарозы, на которых они растут и делятся под флуоресцентным микроскопом в пределах контролируемой температурой экологической палаты. Изображения захватываются через определенные промежутки времени и позже проанализированы с использованием открытого программного обеспечения ImageJ.
протокол
1. Подготовка B. Сенная культур
- Привить клетки от -80 ° C запасы в 10 мл покадровой микроскопии (TLM) среды (62 мМ K 2 HPO 4, 44 мм KH 2 PO 4, 15 мМ (NH 4) 2 SO 4, 6,5 мМ цитрата натрия, 0,8 мм MgSO 4, 0,02% casamino кислоты, 27,8 мМ глюкозы, 0,1 мМ L-триптофан, рН был установлен в 7 с помощью раствора КОН) с добавлением антибиотиков, если это необходимо.
- Расти клетки на ночь в встряхивания флаконов (30 ° C, 225 оборотов в минуту).
- На следующее утро, развести 1:10 в клетках подогретого химически определенной среде (МЧР) (62 мМ K 2 HPO 4, 44 мм KH 2 PO 4, 15 мМ (NH 4) 2 SO 4, 6,5 мМ цитрата натрия, 0,8 мМ MgSO 4, 2.2 мм глюкозы, 2,1 мМ L-глутаминовой кислоты, 6 мкМ L-триптофан, 7,5 мкМ MnCl 2, 0,15 х металлов смеси (подготовка 50x MT смесь акции (ссылка 8), который содержит: 0,2 M MgCl 2, 70 мМ CaCl 2, 5 мМ MnCI 2, 0,1 мМ ZnCl 2, 0,2 мМ тиамин-гидрохлорида, 2 мМ HCl, 0,5 мМ FeCl 3 (добавить последний)) без антибиотиков.
- Расти Б. Сенная клетки до середины экспоненциальной фазе (30 ° C, 225 оборотов в минуту). Обычно это занимает около четырех часов. Важно отметить, что подготовить слайд агарозном за один час до клетки достигают середины экспоненциальной фазы (см. раздел 2).
- Измерьте оптическую плотность культуры на 600 нм (600) и разбавленных клетки приблизительный 600 из 0,035 использования МЧР. Это гарантирует, что OD одиночных клеток с соответствующим расстоянием выставляются на предметное стекло микроскопа для покадровой микроскопии.
2. Подготовка микроскопом образца (также см. Рисунок 2)
За час до клетки достигают середины экспоненциальный рост, подготовить стекло микроскопа следующим образом:
- Чистая две предметные стекла микроскопа (например Книттель Стекло, 7,6 х 2,6 см) с 70% этанола и воды.
- Возьмите гена кадра (ABgene, 1,7 х 2,8 см) и осторожно снимите одну из пластиковой пленки из генов кадр, не вызывая разборки пластиковую крышку с другой стороны ген кадра.
- Прикрепить гена кадра в центре одного из стекол, сначала облегчения контактов на одной стороне, а затем руководствоваться крепления оставшихся генов рама с ногтем. Предотвращение пузырьки воздуха придавая гена кадр стекло.
- Используйте микроволновую печь, чтобы растворить 150 мг (1,5%) с высоким разрешением легкоплавких агарозой (Sigma) в 10 мл МЧР. Агарозы должна быть полностью растворенного получить минимальную фона, необходимого для покадровой экспериментов микроскопии. При необходимости, дополнять агарозном-CDM с индуктором или других соединений, в это время
- Передача 500 мкл теплой агарозном-МЧР в середине гена кадра. Убедитесь, что вся территория, включая (границ) полностью покрывается.
Следующие шаги (2.6 - 2.10) должны быть проведены быстро, чтобы предотвратить чрезмерное высыхание агарозном-CDM. - Место второго предметное стекло на агарозном-CDM заполнены гена кадра. Старайтесь избегать пузырьков воздуха. Место зажатой слайдов в горизонтальном положении в течение 45 мин при 4 ° С в холодильнике, чтобы агарозном-CDM укрепить в достаточной степени.
- Тщательно соскальзывать верхней предметное стекло. Используйте лезвие, чтобы вырезать агар полосы ~ 5 мм ширины в пределах гена рама, на которой клетки будут выращиваться. Не более трех полос могут быть использованы на слайд, разделенных ~ 4 мм пространства для обеих сторон. Эти пространства обеспечит воздухом, который имеет важное значение для Б. Сенная роста. Если четыре различные штаммы должны быть выполнены в срок, две полоски могут быть сделаны и резать пополам, чтобы результат в четырех маленьких квадратиков. Удалите любые остаточные твердой среде.
- Осторожно снимите второй и последний пластиковую крышку от гена кадра, чтобы выставить липкой стороне гена кадра
- Нагрузка одиночных камерах (с шагом 1,5) на твердой среде, не касаясь его с пипетки чаевые. Используйте 2,5 мкл для всей полосе, или на 1 мкл для небольшой площади. Всегда начинайте сверху агарозном площадку и позволяют разогнать жидкость в равной степени о своем установленном роста области, поворачивая скользить вверх и вниз. Слайд готов, как только края жидкости становятся гофрированными и движение жидкости больше не видна при включении слайда.
- Место чистое предметное стекло покровное стекло (24 х 50 мм) на ген кадр с одной стороны на другую (во избежание воздушных пузырей). Обеспечить полное вложение, применяя давление на обложке скольжение по ген рама с ногтем. Если покровное стекло помещается на клетки, не позволяя им высохнуть достаточно долго, то клетки имеют тенденцию к росту друг на друга во время эксперимента. Также будьте осторожны, чтобы не ждать слишком долго, прежде чем применять покровным стеклом, так как агарозном затем будет слишком сухой.
- Предварительно теплой слайд в течение 1 часа при температуре 30 ° C. Если слайд Wульд непосредственно быть помещены в подогретого экологической палаты (см. шаг 3.1) микроскопа, колебания температуры могут вызвать автофокусом проблемы в первые часы эксперимента.
3. Покадровый флуоресцентной микроскопии (также см. рисунок 3 и фильм 1)
- Предварительно теплой экологической палаты по времени (в наших руках, по крайней мере 2 часа до начала эксперимента) с целью предотвращения автофокусом проблемы после начала эксперимента. Время зависит от экологической камера, используемая, а также системы отопления и микроскоп.
- Выберите соответствующую цель, фильтры и дихроичные зеркала в соответствии с вашими экспериментальной установки. Для длительных экспериментов убедитесь, что УФ-фильтр помещается между источником света и образцом. Также, по возможности, заблокировать некоторые возбуждающего света использованием нейтральные фильтры для минимизации воздействия.
Следующее оборудование (предоставляется DeltaVision, Великобритания) была использована для покадровой микроскопии экспериментов опубликованы в де Йонг и др. 2010 5. IX71 микроскоп (Olympus), CoolSNAP HQ2 камеры (Princeton Instruments), 300 Вт ксеноновые источник света, ярких 60x Цель поле (1,25 NA), GFP filterset (Chroma, возбуждения при 470/40 нм, эмиссия 525/50 нм), mCherry filterset (Chroma, возбуждения при 572/35 нм, эмиссия 632/60 нм). Автофокус проводили с использованием диаскопического света и используя настоящее автофокусом рутины в Softworx программного обеспечения Deltavision в. Следует отметить, что Есть в настоящее время ряд других систем автофокуса, который также подходят такие как Zeiss Определенные Фокус, Nikon совершенная система фокусировки и Фокус Leica адаптивного управления.
- Программа вашего эксперимента в соответствии с вашими экспериментальной установки. Целесообразно, чтобы определить количество света, необходимого для конкретных конструкций, а также автофокусом параметры для других покадровой микроскопов или бактерий до фактического эксперимента. Более короткие экспозиции и меньшее количество возбуждающего света позволит свести к минимуму отбеливания и фототоксичности. Используйте диаскопического света для рутинных автофокусом.
Следующие параметры были использованы для покадровой микроскопии экспериментов опубликованы в де Йонг и др., 2010 5. Снимки для просмотра фильмов были сделаны с интервалом в 8 или 12 минут, используя 10% APLLC Белый светодиод и 0,05 с экспозиции для яркими картинками поле, 10% свет ксенона и 0,5 с экспозиции для GFP обнаружения, и 32% свет ксенона и 0,8 с экспозиции для mCherry обнаружения, соответственно. Исходные данные были сохранены с использованием softWoRx 3.6.0 (прикладной Presicion). Автофокус был запрограммирован на 0,06 мкм шаги и общий диапазон от 1,2 мкм.
- Место подготовленных слайдов (раздел 2) в подогретого экологической палаты микроскоп и монитор следствием одной клетки в микроколония монослоя при температуре 30 ° C.
Конкретные советы:
- Выберите отдельные клетки, которые находятся в середине агар площадку. Края площадки агар высохнуть более легко. Магазин X, Y, Z позицию, используя программное обеспечение микроскопа.
- Большой движения этап X, Y и Z направлении может возмутить агарозы и, следовательно, препятствуют идентификации клеток рутинной автофокусом. В общем, чтобы свести к минимуму X, Y, Z движение, мы не выбрали более чем на 10 позиций в эксперименте, даже если слайд содержит несколько штаммов.
- После выбора первой ячейки, регулировать только Z-фокус с программным обеспечением. С этой точки, не изменяют фокусировку вручную на микроскопе тела с помощью "Z-ручки", если это не цифровой кодировкой. Убедитесь, что после каждой процедуры автофокусом новый X, Y, Z позиции сохраняются программным обеспечением.
- Проверьте настройки автофокуса подходят для экспериментов, прежде чем начать работать. Использование фазово-контрастной микроскопии может улучшить автофокусом рутинных по сравнению с использованием светлого или DIC микроскопии, в связи с усилением контраста. Тем не менее, фазовое кольцо в фазового контраста цели делает их менее чувствительными (около 10%) в сборе света флуоресценции. Так для слабых люминесцентные образцы, цель без фазового кольца больше подходят.
- Проверьте выбранные ячейки по-прежнему в центре внимания каждые полчаса, пока эксперимент работает стабильно. Когда клетки в данный момент находятся вне фокуса, регулировать вручную. Из-за изменения температуры, а также плохо высушенных образцов, это может быть необходимо в течение первого часа. Кроме того, из-за повышенной контрастности, автофокус работает лучше, когда больше клеток в поле зрения.
- После эксперимент закончен, отдельные различные каналы кино и безопасного их в виде отдельных файлов (например, фазового контраста, GFP, mCherry), если требуется (некоторые пакеты приобретение будет место для всех каналов в один стек файл). Для публикации, фотографии могут быть повышена за счет 2D деконволюции, что особенно насeful для исследования белков локализации. Deconvolve изображений с помощью программного обеспечения вашего микроскопа или коммерческих пакетов, таких как Гюйгенс ( www.svi.nl ).
- Анализ данных с помощью ImageJ ( http://rsbweb.nih.gov/ij/ ) (используйте сырые, необработанные файлы изображений для этого) и Microsoft Excel или Sigma участка. Стеки могут быть, например, сохранить как ". AVI" видеофайл в ImageJ. Подробное описание того, как флуоресценция одиночных клетках может быть измерен во времени, приводится ниже.
4. Данные анализа динамики промоутер деятельности с использованием ImageJ
Отметим, что другие хорошие пакеты программ, которые специализируются на анализе замедленной изображений микроскопии, таких как программное обеспечение BHV 9, 4, Schnitzcell 10, PSICIC 11 и Микроб-Tracker 12, но здесь мы сосредоточимся на свободно доступный пакет ImageJ.
- Скачать ImageJ ( http://rsbweb.nih.gov/ij/ ) и (при необходимости) правильный плагин для открытия (стек) файла. Например, фильмы записаны с помощью deltavision микроскоп может быть открыт только в ImageJ с плагином нож deltavision. Копирование DV-плагин в папку плагинов ImageJ и запустить программу. Изменение объема памяти в файле / опция / памяти и темы с 1250 года. Это позволяет работать с большими файлами, таких как полученные из покадровой фильмов.
- Для оценки клетка история одной единственной клетки, открытые в оригинальном фильме фазового контраста одной микроколония и выделите последний кадр интереса к кино. Выберите "сегментированным линии" Кнопка выбора в меню.
- Нарисуйте линию в фоновом режиме и нажмите "Ctrl" + "T". Это откроет регионах, представляющих интерес (ROI), менеджер. (Соответствующее значение флуоресценции фона можно использовать, чтобы вручную вычесть фон -.. См. ниже Вместо этого можно использовать обычный вычитание фона присутствует в ImageJ) Также нарисовать линию в клетке интересов и добавить к ROI менеджер ROI. Так как мы исследуем промотор-GFP слияний в этом случае изучение и GFP распространяется по всей цитоплазме, всей клетки должны иметь аналогичные флуоресценции значения для каждого отдельного пикселя по всей длине клетки. Выделите один кадр назад во времени и выбрать новый ROI в той же камере, представляющих интерес. Сохранить эту третью ROI и продолжить процедуру, пока соответствующие ROI в первый кадр фильма был сохранен.
Имейте в виду, что флуоресценция дочерние клетки могут сильно различаться после деления клетки. Либо использовать мембраны краситель, который может быть применен вместе с флуоресценции белков, производимых клетками (например, сочетание красного красителя мембраны FM ® 5-95 (Invitrogen) и GFP) для визуализации перегородки образования. В этом случае соответствующая флуоресценции канал, а не фильм фазового контраста следует использовать следовать клетки во времени. Кроме того, можно оставаться на безопасной стороне, выбрав ROI в только одну половину клетки. - В менеджер ROI, нажмите кнопку "Сохранить". Если окончание файла ". Рои", то рои выбран в списке, и только для него будут сохранены. Если окончание файла ". ZIP", то весь набор будет сохранен (обязательно).
- Закрыть фильм фазового контраста и открыть исходный флуоресценции кино (например, GFP). Нажмите кнопку "показать все" и "измерение" в менеджере ROI. Откроется новое окно (результаты). Копирование результатов в лист Excel и вычесть среднее флуоресценции для каждой отдельной клетки от фоновой флуоресценции среды. В результате чистая флуоресценции может быть заговор против время раскрыть промоутера активность клетки интересов во времени.
- Кроме того, флуоресценции всех клеток микроколония возможность анализа данных на определенный момент времени точки. Для того, чтобы сделать это выбрать и сохранить рентабельность по фон и каждую клетку в одном кадре, как описано выше, копировать флуоресценции значений Excel и производить гистограмм использования "Гистограмма" функции в "инструмент" меню.
- Для получения изображения из отдельных кадров для публикации, выберите кадр интереса, выберите "Изображение" - "копию изображения" и изменить тип изображения "RGB" или "8-бит", выбрав "образ" - "тип" - "RGB цвет" или "8-бит". Сохранить кадр дублируется как ". Размолвка". RGB/8-bit фотографии можно открыть с помощью обычных программ рисования, такие как CorelDraw или Adobe Illustrator. При необходимости, снимки могут быть адаптированы с помощью "образ" - "настроить" - "яркость / контрастность" или "образ" - "настроить" - "окно / уровень" в ImageJ.
5. Производство фильмов для публикации с ImageJ
- Откройте исходный фазового контраста и соответствующий фильм флуоресценции (ы) в ImageJ как описано выше. Выберите прямоугольная кнопка выбора (1-й слева) и нарисуйте прямоугольник ROI в первый кадр таким образом, что развивающиеся микроколония окружен ROI throughout весь фильм. Выберите "Изображение" - "урожай" и безопасные это уменьшенная версия фильма под новым именем. Выберите тот же ROI через менеджер ROI в флуоресценции фильм и перейти, как раньше.
- Чтобы объединить фильмы горизонтально или вертикально, выберите "плагин" - "Стек комбайнера". При желании, времени штампа могут быть добавлены с помощью "плагинов" - "время штампа". Сохраните объединенный стек один раз ". DV" или ". Размолвка" и один раз как ". AVI" или QuickTime фильмов.
Альтернативный протокол Приспособления для стрептококковой пневмонии (рис. 4 и фильм 2):
6. Подготовка С. пневмонии культур
- Расти С. пневмонии клеток (капсулированные штамм D39 13, или unencapsulated штамм R6 14 стоящим культур в C + Y среду 15 при 37 ° С до ОП при 600 нм приблизительно 0,4 будет достигнута. Центрифуга клетки в течение 2 мин при 14000 оборотах в минуту и ресуспендирования осадок клеток в объеме свежие C + Y среде, содержащей 14,5% глицерина (о / о), что привело бы к 600 нм точно 0,4. Алиготе клетки и хранить их при температуре -80 ° C для дальнейшего использования.
- Для покадровой микроскопии, возьмите аликвоту ранее культурный С. пневмонии клеток. Привить 4 мл свежей C + Y средний 1:100 с ячейками от -80 ° C аликвоту. Расти клетки до середины экспоненциальной фазы ОП 600 нм до 0,1 - 0,2. Обычно это занимает около 2 часов при использовании клетки от -80 ° C аликвоты.
7. Подготовка микроскопом образца
- Подготовка стекло микроскопа, как описано выше для B. Сенная но убедитесь, что агарозном содержит комплекс С + Y среды. С С. пневмонии является microaerophile, воздушные карманы между полосами агарозы должна быть меньше, чем для Б. Сенная (~ 1 мм пространства с обеих сторон).
- Измерьте оптическую плотность культуры при 600 нм (600), развести экспоненциально растущей С. пневмонии клетки приблизительный 600 из 0,05 использованием C + Y средних и использовать это разбавление, чтобы загрузить слайд агарозы.
8. Покадровый фазово-контрастной микроскопии
Настройте микроскоп настройки для S. пневмонии: использовать фазово-контрастной микроскопии с С. пневмонии трудно определить использованием светлого поля микроскопию. Продолжить протокола, как это описано для В. Сенная (последующие шаги 2,9 - 3,7). С. пневмонии клетки могут быть выращены на любом 30 ° C или 37 ° C (они быстрее растут при 37 ° С).
9. Представитель результаты:
Замедленной флуоресценции эксперимент был проведен успешно, если бактерии превратились в микроколония монослоя, который полностью расположен в пределах поля зрения в конце эксперимента (см. рис 5A-C). Если клетки росли друг на друга, это не только невозможно проследить их историю точно, но и флуоресценции уровней перекрывающиеся ячейки не может быть измерено правильно. Клетки имеют тенденцию к росту друг на друга, если пятнистый клетки не были достаточно сухой (шаг 2,9), или если состав среды должна быть скорректирована, чтобы получить более медленный рост. Если микроколония выросла из точки зрения, то распределение флуоресценции сигналов в пределах одной колонии не может быть определена. Причины "микроколония движение" может быть недостаточно сушки клеток пятнистый (шаг 2,9), или, если программное обеспечение не было запрограммировано для отслеживания микроколония в процессе разработки. Кроме того, важно, чтобы местные пятна увеличились флуоресценции не обнаруживаются в среде, так как это затемняет флуоресценции сигналы, поступающие от клеток (см. рисунок 5D-F). Фон связанные проблемы могут возникнуть из соединений СМИ, воздушных пузырьков или нерастворенных сгустки агарозы. Чтобы представить себе это, мы приводим на рис. 5F фоне сигналов этого определенному слайду, когда изображение было получено использованием возбуждение / излучение фильтры для красных флуоресцентных красителей. Как видно, яркие пятна autofluorescent присутствуют которая могла бы помешать изображений. Для предотвращения таких местах, убедитесь, что агарозном полностью не растворится и Есть нет воздушных пузырьков при размещении на покровное стекло микроскопа.
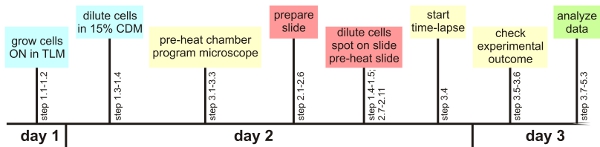
Рисунок 1: Экспериментальный обзор

Рисунок 2: Подготовка микроскопом образца
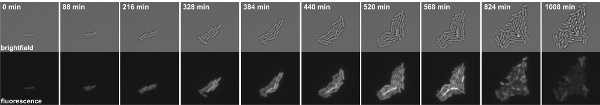
Рисунок 3: Покадровый флуоресцентной микроскопии Б. Сенная клетки укрывательство P kinB-GFP синтеза. Снимки взяты из фильмов 1. Топ панелей: светлое поле, нижняя панели: GFP канала.
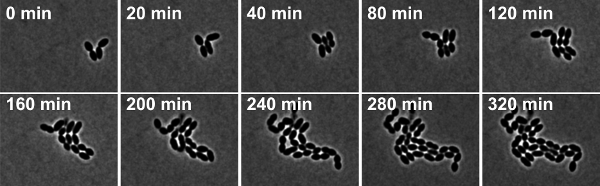
ИнжирЮр 4: Покадровый фазово-контрастной микроскопии С. пневмонии штаммом дикого типа R6. Снимки взяты из фильмов 2.
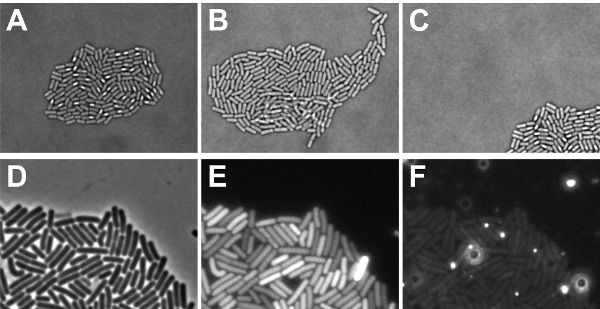
Рисунок 5: Иллюстрация возможных (замедленной) результаты микроскопии. AC показывает факторы, которые должны быть рассмотрены на данных, полученных с диаскопического настройки света. (А) Светлое микрофотография монослоя микроколония (положительный результат) спорообразующих Б. Сенная клетки (B) Светлое образ Б. Сенная микроколония, в которых некоторые клетки росли друг на друга (отрицательный результат) (C) Светлое образ спорулирующими B. Сенная микроколония, которые выросли из области фокуса (отрицательный результат). DF-шоу факторов, которые должны быть рассмотрены для данных, полученных с эпископического настройки света (D) фазового контраста картины Б. Сенная клеток в экспоненциальной фазе изображены для визуализации, где сигналов флуоресценции в Е и F исходят из (Е) сигналов GFP клеток показано в D. Обратите внимание, что фон сигналы подобны в каждом пикселе (положительный результат). Также отметим, что время экспозиции может быть слишком много, так как одна ячейка показывает насыщенных сигнала (отрицательный результат) (F) сигналов, полученных через красный коридор клеток показано в примечании, что Д. фон содержатся участки с повышенным уровнем красной флуоресценции (отрицательный результат).
Фильм 1. Покадровый флуоресцентной микроскопии Б. Сенная клетки укрывательство P kinB-GFP синтеза. Снимки были сделаны в 8 минутные интервалы. Слева: светлое поле, справа: GFP канала. Нажмите сюда, чтобы посмотреть фильм.
Фильм 2. Покадровый фазово-контрастной микроскопии С. пневмонии штаммом дикого типа R6. Снимки были сделаны в 10 минутные интервалы. Нажмите сюда, чтобы посмотреть фильм.
Обсуждение
В отличие от многих других методов одну клетку, замедленной флуоресценции методом микроскопии описаны здесь, могут быть использованы для проследить историю определенной ячейке в связи с его предков, его поведение, и разделение событий. В сочетании с флуоресцентно меченных целевых промоутеров или белки, конкретные пути развития активации можно проследить во времени и локализация белка, а также динамики белков может контролироваться при бактериальном развития.
Как указывалось выше, исследования концентрации на различных видов бактерий может быть выполнена путем адаптации условий роста в соответствии с требованиями для конкретной бактерии. Единственные ограничения мы столкнулись, связаны с условиями роста и размера выборки. Из-за замкнутом пространстве, средние условия не могут быть изменены во время эксперимента. Кроме того, более четырех штаммов в эксперименте можно контролировать эффективно.
Учитывая несколько важных шагов, единственный метод анализа клетка описанные здесь, могут быть легко применяться с использованием автоматизированной микроскопом. В следующем, обзор этих важных шагов будет предоставлена. Подробную информацию можно найти в основной текст Общая подготовка. Целесообразно проверить автофокус настройки, необходимые для конкретной бактерии до эксперимента. Кроме того, приближенные оптимальные настройки для визуализации флуоресценции должны быть определены заранее, если это возможно. Кроме того, после подготовлены тайм-линии помогает иметь все материалы готовы к использованию во времени (до потепления микроскоп камеры, программирование микроскопом настройки, подготовки слайд один час до клетки в нужной фазе роста, см. рисунок 1) . Рост B. Сенная в TLM и МЧР: TLM и МЧР определенного химического голода сред, в которых Б. Сенная только растет медленно. Период времени, в котором клетки, выращенные в средствах массовой информации, возможно, придется быть продлен в зависимости от конкретного штамма. Медленный рост не позволяет клеткам нагромождение друг на друга Подготовка микроскопом образца:. Пузырьки воздуха между геном рама, стекло и покровным стеклом должны быть предотвращены, чтобы предотвратить обширный сушки агарозном основе среды. То же самое касается средних / покрытие скольжения интерфейс. Очень важно, чтобы клетки достаточно сухой, чтобы предотвратить плавания и / или нескольких роста слоя Покадровый флуоресцентной микроскопии. Предварительно потепления слайдов, а также экологические камера имеет решающее значение для предотвращения серьезных проблем автофокусом. Клетки должны быть выбраны в середине агар площадку, так как они имеют самые высокие шансы остаться в области, и внимание в ходе эксперимента (если образец сушили достаточно хорошо). Максимум 10 мест в экспериментах по-прежнему работает должным образом. После выбора первой ячейки представляют интерес только использовать программное обеспечение для настройки фокуса (см. текст право). Проверьте клетки по-прежнему в центре внимания в течение первых часов эксперимента в 30-минутные интервалы анализа:. Важно проверить до расширенных процедур анализа ли фон среды имеет аналогичные значения в флуоресценции каналов. Мелкие частицы пыли, компонентов среды, грязных линз или крошечные скопления агарозы может способствовать локально увеличился флуоресценции, что делает фильм трудно или невозможно проанализировать и устранение неисправностей. Если клетки растут друг на друга, это может либо указать, что покровное было прилагается слишком рано, или, что среда не подходит для роста микроколоний монослоев. Если клетки интерес непрерывно умирают преждевременно, в то время как другие клетки на слайде разделить счастливо, вы можете проверить, является ли вы положите УФ-фильтр в нужном положении. Это может также помочь уменьшить время экспозиции или интенсивности света в течение длительного эксперимента.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Работа в группе JWV поддерживается ЕС Мари-Кюри реинтеграции стипендий, Sysmo2 Грант (NWO-ALW/ERASysBio), Horizon гранта (ZonMw) и Вене стипендий (NWO-ALW). Группа ОПК поддерживается несколько грантов STW (НМП), SYSMO1 (IGdeJ) и SYSMO2 грант, ESF EUROCORES SynBio гранта (SynMod) и Клюйвер центра геномики промышленной ферментации и Top института пищевых продуктов и питания.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (необязательно) |
|---|---|---|---|
| Гена Frame | ABgene | AB-0578 | 1,7 х 2,8 см. |
| с высоким разрешением низкой температурой плавления агарозы | Сигма | A4718 | |
| большой скольжения крышки | несколько | 24 х 50 мм | |
| При желании, мембрана красителя, например, FM 5-95 | Invitrogen | T23360 | другие красители мембраны, также доступны: http://probes.invitrogen.com/media/pis/mp34653.pdf |
| Покадровый микроскоп с экологическими камеры | несколько | подробнее см. на нашем устройстве в соответствующих разделах |
Ссылки
- Veening, J. W., Smits, W. K., Kuipers, O. P. Bistability, epigenetics, and bet-hedging in bacteria. Annu. Rev Microbiol. 62, 193-193 (2008).
- Dubnau, D., Losick, R. Bistability in bacteria. Mol Microbiol. 61, 564-564 (2006).
- Locke, J. C., Elowitz, M. B. Using movies to analyse gene circuit dynamics in single cells. Nat. Rev. Microbiol. 7 (5), 383-383 (2009).
- Veening, J. W. Bet-hedging and epigenetic inheritance in bacterial cell development. Proc. Natl. Acad. Sci. U. S. A. 105 (11), 4393-4393 (2008).
- de Jong, I. G., Veening, J. W., Kuipers, O. P. Heterochronic phosphorelay gene expression as a source of heterogeneity in Bacillus subtilis spore formation. J. Bacteriol. 192 (8), 2053-2053 (2010).
- Veening, J. W., Murray, H., Errington, J. A mechanism for cell cycle regulation of sporulation initiation in Bacillus subtilis. Genes Dev. 23 (16), 1959-1959 (2009).
- Eberhardt, A. Cellular localization of choline-utilization proteins in Streptococcus pneumoniae using novel fluorescent reporter systems. Mol Microbiol. 74 (2), 395-395 (2009).
- Vasantha, N., Freese, E. Enzyme changes during Bacillus subtilis sporulation caused by deprivation of guanine nucleotides. J Bacteriol. 144 (3), 1119-1119 (1980).
- Stewart, E. J. Aging and death in an organism that reproduces by morphologically symmetric division. PLoS. Biol. 3, 45-45 (2005).
- Rosenfeld, N. Gene regulation at the single-cell level. Science. 307 (5717), 1962-1962 (2005).
- Guberman, J. M. PSICIC: noise and asymmetry in bacterial division revealed by computational image analysis at sub-pixel resolution. PLoS. Comput. Biol. 4 (11), 1000233-1000233 (2008).
- Montero, L. l. o. p. i. s. . P. Spatial organization of the flow of genetic information in bacteria. Nature. 466, 77-77 (2010).
- Avery, O. T., Macleod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types: Induction of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III. J Exp. Med. 79, 137-137 (1944).
- Hoskins, . Genome of the bacterium Streptococcus pneumoniae strain R6. J Bacteriol. 183, 5709-5709 (2001).
- Martin, B. The recA gene of Streptococcus pneumoniae is part of a competence-induced operon and controls lysogenic induction. Mol Microbiol. 15, 367-367 (1995).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены