Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Обнаружение и Genogrouping норовирусов от стулья Детский По Taqman один шаг RT-PCR
В этой статье
Резюме
One-Step RT-ПЦР для обнаружения и геногруппы идентификации норовирус изолятов детский стул, который использует грунтовки и TaqMan зонды, специфичные для открытой рамки считывания 1 (ORF1) ORF2 области перехода, наиболее консервативные области норовирус генома описано. Некоммерческих, экономически эффективной добычи методом РНК подробно.
Аннотация
Noroviruses (NoVs) are the leading cause of outbreaks of sporadic acute gastroenteritis worldwide in humans of all ages. They are important cause of hospitalizations in children with a public health impact similar to that of Rotavirus. NoVs are RNA viruses of great genetic diversity and there is a continuous appearance of new strains. Five genogroups are recognized; GI and GII with their many genotypes and subtypes being the most important for human infection. However, the diagnosis of these two genotypes remains problematic, delaying diagnosis and treatment. 1, 2, 3
For RNA extraction from stool specimens the most commonly used method is the QIAmp Viral RNA commercial kit from Qiagen. This method combines the binding properties of a silica gel membrane, buffers that control RNases and provide optimum binding of the RNA to the column together with the speed of microspin. This method is simple, fast and reliable and is carried out in a few steps that are detailed in the description provided by the manufacturer.
Norovirus is second only to rotavirus as the most common cause of diarrhea. Norovirus diagnosis should be available in all studies on pathogenesis of diarrhea as well as in outbreaks or individual diarrhea cases. At present however norovirus diagnosis is restricted to only a few centers due to the lack of simple methods of diagnosis. This delays diagnosis and treatment 1, 2, 3. In addition, due to costs and regulated transportation of corrosive buffers within and between countries use of these manufactured kits poses logistical problems. As a result, in this protocol we describe an alternative, economic, in-house method which is based on the original Boom et al. method4 which uses the nucleic acid binding properties of silica particles together with the anti-nuclease properties of guanidinium thiocyanate.
For the detection and genogrouping (GI and GII) of NoVs isolates from stool specimens, several RT-PCR protocols utilizing different targets have been developed. The consensus is that an RT-PCR using TaqMan chemistry would be the best molecular technique for diagnosis, because it combines high sensitivity, specificity and reproducibility with high throughput and ease of use. Here we describe an assay targeting the open reading frame 1 (ORF1)-ORF2 junction region; the most conserved region of the NoV genome and hence most suitable for diagnosis. For further genetic analysis a conventional RT-PCR that targets the highly variable N-terminal-shell from the major protein of the capsid (Region C) using primers originally described by Kojima et al. 5 is detailed. Sequencing of the PCR product from the conventional PCR enables the differentiation of genotypes belonging to the GI and GII genogroups.
протокол
1. Кала
- Стул пробы должны храниться замороженными сохранить РНК. Для того, чтобы 10% фекальных подвеску, занимает около 0,1 г талой кала и завершить к 1 мл PBS.
- Алиготе в 200 мкл, чтобы избежать повторного замораживания и оттаивания. Хранить аликвоты при -70 ° C.
- Таяние и центрифуги аликвоты в 4000 г в течение 10 минут перед использованием в добычу.
2. Подготовка частиц кремнезема для добычи с гуанидина и кремния
- В РТ, приостановить 30 г двуокиси кремния, и в комплекте с дН 2 O до 250 мл.
- После 24 часов осаждения, удалите 215 мл супернатант всасывания. Добавить дН 2 O до 250 мл, а также приостановить кремния гранул при встряхивании.
- Еще через 24 часа, удалить супернатант всасывания и регулирования рН кремнезема подвески рН 2,0, с помощью соляной кислоты (HCl). Алиготе кремния суспензии в стеклянных ботловушках и автоклав.
3. Подготовка L6 буфера для экстракции с гуанидина и кремния
- В РТ подготовить L6 буфера путем растворения 60 г роданида гуанидин (GuSCN) и 1,3 г Тритон Х-100 в 50 мл 0,1 М трис-гидрохлорида, рН 6,4, и 11 мл 0,2 М ЭДТА, рН 8,0 раствором.
4. Подготовка буфера L2 для добычи с гуанидина и кремния
- В РТ подготовить L2 буфера путем растворения 180 г роданида гуанидин (GuSCN) в 150 мл 0,1 М трис-гидрохлорида, рН 6.4.
5. Процедура извлечения
- В каждом извлечении NoV положительные образцы стула, в качестве положительного контроля, а DEPC очищенной воды, в качестве отрицательного контроля, должны быть включены.
- В микро-центрифужные пробирки перемешать следующее: 1 мл буфера L6, 20 мкл частиц кремнезема, а также добавить 200 мкл 10% фекальных подвески экстракта. Кратко Vortex и оставить при комнатной температуре в течение 15 мильл.
- Центрифуга подвески в 6000 г в течение 10 с и промыть осадок с 1 мл буфера L2 в два раза, а затем два промывок 70% этанола и один раз с помощью ацетона. Сухие гранулы в сухом блока нагрева при 56 ° C в течение 5 мин.
- Сода РНК в гранулы кремнезема путем добавления 50 мкл РНКазы без дН 2 0. Добавить 1 мкл RNasin, перемешать путем обращения трубки и инкубировать при 56 ° С в течение 15 мин.
- Центрифуга в течение 3 мин на полной скорости, в настольной центрифуге, и собрать 40 мкл супернатант, содержащий РНК.
- Количественная извлеченные образцы РНК с использованием Nanodrop 2000 спектрофотометр (Thermo Scientific). Затем хранить при температуре -70 ° C до использования, до 6 месяцев. (Примечание: лучший способ сохранить общую РНК нетронутыми превращает его в кДНК).
6. Альтернативные Добыча Использование коммерческих РНК QIAamp Вирусная РНК Kit
Подробные инструкции можно найти в буклете провided с комплектом QIAGEN. Вкратце процедура выглядит следующим образом:
- Внесите 560 мкл буфера AVL содержащий носитель РНК в 1,5 мл трубки, и добавить 140 мкл 10% стул подвески. Mix методом широтно-встряхивая в течение 15 сек. Выдержите при комнатной температуре в течение 10 мин.
- Добавить 560 мкл этанола (96-100%) в образце и смеси методом широтно-встряхивая в течение 15 секунд, а затем кратко центрифуги.
- Применение 630 мкл этого раствора в спину колонке размещены в 2 пробирки мл. Центрифуга в течение 1 мин на 6000 г, а затем поместить спину колонку в чистую 2 мл трубку.
- Промойте колонку, содержащую связанные с РНК 500 мкл буфера AW1 и центрифуги в 6000 г в течение 1 мин. Место колонна в чистом 2 трубками коллекции мл.
- Промойте колонку с 500 мкл буфера AW2 и центрифуги на полной скорости (20,000 г или 14 000 оборотов в минуту) в течение 3 мин.
- Место спина колонку в чистую 1,5 мл микро-центрифужные пробирки, добавить 40 мкл DEPC обработанной воды и элюции РНК на полной скорости. Повторитесе для окончательного 80 мкл элюированных РНК.
- Количественная извлеченные образцы РНК с использованием Nanodrop 2000 спектрофотометр (Thermo Scientific). Затем хранить при температуре -70 ° C до использования, до 6 месяцев. (Примечание: лучший способ сохранить общую РНК нетронутыми превращает его в кДНК).
7. Обнаружение норовирус в Извлеченные РНК один шаг в режиме реального времени RT-PCR с зондами Taqman
Инструмент StepOnePlus Real Time PCR система (Applied Biosystems).
Методология
- Протрите и очистите все рабочие поверхности, пипетки и центрифуги РНКазой AWAY для удаления возможного загрязнения РНКазы.
- Внесите NoV GI и GII скрининг мастер смешивает в соответствии с таблицей 1. Праймеры и зонды Taqman приведены в таблице 2.
- Алиготе 10 мкл соответствующего сочетания мастер каждый реакционную трубку.
- Добавьте 5 мкл неразбавленного неизвестного образцаРНК, DEPC обработанной воды в качестве отрицательного контроля, или GI GII соответственно положительным контролем РНК, соответствующей скважины реакции. Все образцы должны быть выполнены в двух экземплярах. Положительный контроль и стандарты с концентрацией 300 мкг / мкл и 500 мкг / мкл соответственно были предоставлены Национальным кальцивируса лаборатории Центра по контролю и профилактике заболеваний (CDC).
- Центрифуга реакция пластины на 6000 г на 10 сек.
- В окне свойств эксперимента, определить и выбрать тип эксперимента по ходу. Убедитесь, что TaqMan реагентов отображаются в виде реагентов типа, и что Предварительная ПЦР для чтения и усиления будут выбраны.
- Выполните 15 мкл реакций с использованием термопрофиля в таблице 3.
- Анализ результатов.
8. Генотипирование NoV GI и GII Использование обычных RT-PCR и секвенирования
(Это не упомянутые в этом видео, так как это общий и широко используемый метод).
Инструмента. Applied Biosystems StepOne и StepOnePlus ПЦР в реальном времени системы с шаблоном Quantitec.
Методология
- Перед генотипирования геногруппы (GI или ГИИ) образцов определяется скрининг-ПЦР, описанных выше. Г.И. NoV РНК должен быть усилен с мастером И. сочетание генотипов и ГИИ NoV РНК смесью GII генотипа хозяина.
- Внесите NoV GI и GII генотипирования мастер смешивает в соответствии с таблицей 4. Грунтовки Г.И. SKF / SKR и G2 SKF / СКР приведены в таблице 5.
- Алиготе 45 мкл соответствующего Mix Master 0.2 мл пробирок.
- Добавьте 5 мкл DEPC обработанной воды каждый отрицательный трубки контроля и 5 мкл предварительно отобранных, ноябрь (GI и / или ГИИ) положительный РНК в соответствующую трубку реакции.
- Выполните 50 мкл реакций с использованием термопрофиля в таблице 6.
- Отправить продуктов ПЦР ContaiНина не менее 100 нг / мкл усиленный капсида региона Macrogen компании для очистки и последовательности. (9700 Великий Сенека Hwy. Rockville, MD 20850 и $ 10 за образец в последовательности).
9. Представитель Результаты
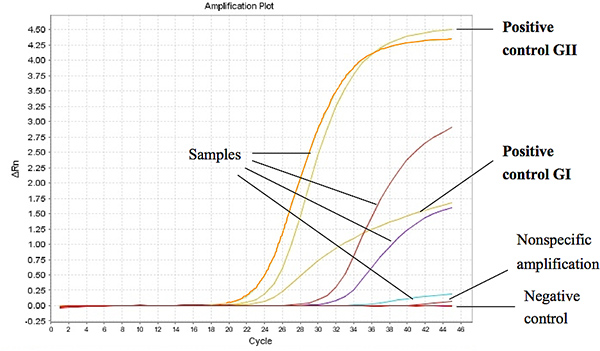
На рисунке 1 показана представитель результаты Taqman One-Step RT-PCR, когда используется для анализа РНК, выделенной из образцов стула от диарейных детей. Порог цикла (Ct) на положительный образец был установлен на уровне меньше или равна 37 Ct Г.И. и Ct 39 GII. Ct-значения для положительного контроля оказались меньше, чем 27 и 18-ORF1 ORF2 соединения для GI и GII, соответственно. Нажмите здесь, чтобы увеличить рисунок .
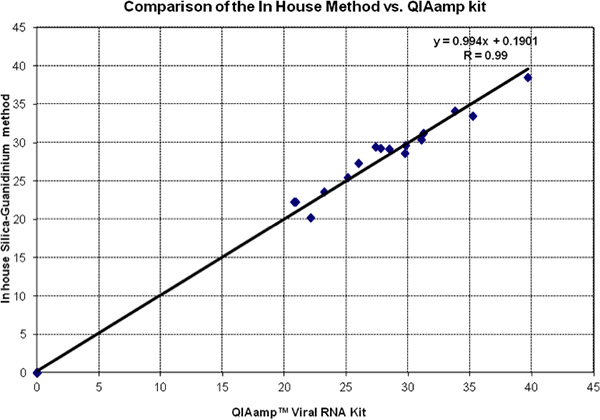
Рисунок 2 показывает, голова к голове сравнение значений Ct из кремнезема методом гуанидин и QiAmp вирусных РНК комплект. Данные тесты, как падают очень близко к равенству линии (наклон = 1 перехват = 0). Это подтверждает анализ регрессии и коэффициент корреляции. Все отрицательного контроля были оценены и признаны 0 на обоих методов.
| Master Mix | Окончательный Конц | Объем (мкл) |
| H 2 0 ПЦР | 2,875 | |
| Quantitect RT-PCR Master Mix | 1x | 6,250 |
| РТ Mix | 1x | 0,125 |
| 50 мкМ Cog R грунтовка | 1 мкМ | 0,250 |
| 50 мкМ праймер F Cog | 1мкМ | 0,250 |
| 10 мкМ зонд кольцо | 1 мкМ | 0.125/0.250 * |
| 10,00 |
* 0,250 мкл каждой пробы был использован для тестирования Г.И., в то время как 0,125 мкл каждой пробы был использован для тестирования GII.
Таблица 1. Qiagen Quantitect мастер микс для скрининга GI и GII (Трухильо и соавт., 2006) 7.
| Имя | Гено-групп | Использовать | Последовательность (5 'к 3') |
| Cog 1R | Г.И. | Грунтовка | СТТ AGA CGC CAT CAT CAT C ТЯ |
| Cog 1F | Г.И. | Грунтовка | CGY TGG ATG CGN TTY CAT GA |
| Cog 2R | ГИИ | Грунтовка | TCG ACG ОСО TCT TCA TTC ACA |
| Cog 2F | ГИИ | Грунтовка | CAR GAR BCN ATG TTY СМА TGG ATG AG |
| Кольцо 1A | Г.И. | Зонд | FAM-AGA TYG CGA TCY CCT GTC CA-BHQ-1 |
| Кольцо 1B | Г.И. | Зонд | FAM-AGA TCG CGG TCT CCT GTC CA-BHQ-1 |
| Ring2-TP | ГИИ | Зонд | FAM-TGG GAG GGC GAT CGC AAT CT-BHQ-1 |
Таблица 2. Праймеров и зондов олигонуклеотидов использоваться в режиме реального времени количественный ПЦР для геногрупп I, II (Kageyama и соавт.,2003) 8.
| Шаг | Температура (° C) | Время (мин) | |
| 1 | 50 | 30:00 | синтеза кДНК |
| 2 | 95 | 15:00 | Taq полимераза HotStart активации |
| 3 | 95 | 00:15 | |
| 60 | 1:00 | 45X циклов |
Стол3. Тепловой профиль один шаг Taqman в режиме реального времени RT-PCR (Трухильо и соавт., 2006) 7.
| Master Mix | Окончательный Конц | Объем (мкл) |
| H 2 0 ПЦР | 29,50 | |
| 5X Qiagen RT-PCR буфера | 1x | 10,00 |
| 10 мМ дНТФ Mix | 0,4 мМ | 2,00 |
| Фермент Mix | 2,00 | |
| 40 U / мкл RNAsin | 20 U / мкл | 0,50 |
| 10 мкМ SKF | 0,1 мкМ | 0,50 |
| 10 мкМ SKR | 0,1 мкМ | 0,50 |
| 45,00 |
Таблица 4. Qiagen One-Step RT-PCR Master Mix для генотипирования GI и GII.
| Имя | Гено-групп | Использовать | Последовательность (5 'к 3') |
| G1SKF | Г.И. | Грунтовка | 5'-CTG CCC ГАА TTY GTA AAT GA - 3 |
| G1SKR | Г.И. | Грунтовка | 5'-ОАС ACC CAR ОСО TTR TAC - '3 |
| G2SKF | ГИИ | Грунтовка | 5'-CNT GGG AGG GCG УВД GCA - 3 |
| G2SKR | ГИИ | Грунтовка | 5'-CCR CCN GCA TRH CCR TTR TA CAT-3 |
Таблица 5. Грунтовка используется для усиления области C области капсида (коим и соавт., 2002) 5.
| Шаг | Температура (° C) | Время (мин) | |
| 1 | 60 | 30:00 | синтеза кДНК |
| 2 | 96 | 15:00 | Taq полимераза HotStart активации |
| 3 | 94 | 00:30 | |
| 52 | 1:00 | 40X циклов | |
| 72 | 00:30 | ||
| 4 | 72 | 10:00 | Отжиг |
Таблица 6. Тепловой профиль Taqman One-Step RT-PCR.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Использование экономических внутренний метод выделения нуклеиновых кислот из образцов кала, получаем одинаковые результаты как с коммерческой QIAmp Вирусная РНК комплект из Qiagen, а вместе с TaqMan-ПЦР в нашей лаборатории мы можем обнаружить широкий спектр NoV генотипов принадлежащих GI и GII г?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить Национальный центр лаборатории кальцивируса по контролю и профилактике заболеваний (CDC) за любезное дар стандарт и контроль срабатывания для ноября и лаборатории факультета общественного здравоохранения Университета Джонса Хопкинса для обеспечения реагентами.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Гуанидин изотиоцианат | Сигма-Adrich | G9277 | |
| Трис-HCl | Sigma-Aldrich | T5941 | |
| ЭДТА | Sigma-Aldrich | E5134 | |
| Кремнезем | Sigma-Aldrich | S5631 | |
| Triton X 100 | Химические BDH | 14530 | |
| Диэтилпирокарбонатом | Sigma-Aldrich | D-5758 | |
| QIAamp вирусной РНК Mini Kit (250) | QIAGEN | 52906 | |
| QuantiTec Probe RT-PCR комплект (200) | QIAGEN | 204443 | |
| Qiagen One Step RT-PCR Kit (200) | QIAGEN | 210212 | |
| Ингибитор РНКазы 2000 единиц | A.Biosystems | N808-0119 | 2000 unids / флакон |
| Non-Stick Rnae без трубы микроцентрифужную | Ambion | AM12450 | |
| Сверхчистых агарозном 1000 | Invitrogen | 16550-100 |
Ссылки
- Medici, M. Molecular epidemiology of Norovirus infections in sporadic cases of viral gastroenteritis among children in Northern Italy. L. Medical Virology. 78, (2006).
- Vidal, R. Novel recombinant Norovirus causing outbreaks of gastroenteritis in Santiago, Chile. J. Clinica Microbiology. 4, (2006).
- Xavier, M. Detection of caliciviruses associated with acute infantile gastroenteritis in Salvador, an urban center in Northeast Brazil. Braz. J. Med. Biol. Res. 42, (2009).
- Boom, R. Rapid and simple method for purification of nucleic acids. J. Clin. Microbiol. 28, 495-503 (1990).
- Kojima, S. Genogroup-specific PCR primers for detection of Norwalk-like viruses. J. Virol. Methods. 100, 107-114 (2002).
- Mattison, K. Multicenter comparison of two norovirus ORF2-based genotyping protocols. J. Clin. Microbiol. 47, 3927-3932 (2009).
- Trujillo, A. A. Use of TaqMan real-time reverse transcription-PCR for rapid detection, quantification, and typing of norovirus. J. Clin. Microbiol. 44, 1405-1412 (2006).
- Kageyama, T. A broadly reactive and highly sensitive assay for Norwalk-like viruses on real-time quantitative RT-PCR. J. Clin. Microbiol. 41, 1548-1557 (2003).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены