Method Article
Создает FSL: Простой метод Изменение Cell / Вирион Поверхности со спектром биологических маркеров не влияя на их жизнеспособность
В этой статье
Резюме
Функция-Spacer-липидный (FSL) конструкции позволяют характеристик поверхности живых клеток и вирионы быть изменен без потери жизнеспособности. Метод требует лишь простой контакт решение FSL построить с Cell / вириона и спонтанных и устойчивой поверхности включение происходит.
Аннотация
The ability to modify/visualize biological surfaces, and then study the modified cell/virion in a range of in vitro and in vivo environments is essential to gaining further insight into the function of specific molecules or the entire entity. Studies of biological surface modification are generally limited to genetic engineering of the organism or the covalent attachment of chemical moieties to the cell surface1,2. However these traditional techniques expose the cell to chemical reactants, or they require significant manipulation to achieve the desired outcome, making them cumbersome, and they may also inadvertently affect the viability/functionality of the modified cell. A simple method to harmlessly modify the surface of cells is required.
Recently a new technology, KODE Technology has introduced a range of novel constructs consisting of three components: a functional head group (F), a spacer (S) and a lipid tail (L) and are known as Function-Spacer-Lipid or FSL constructs3. The spacer (S) is selected to provide a construct that is dispersible in water, yet will spontaneously and stably incorporate into a membrane.
FSL construct functional moieties (F) so far include a range of saccharides including blood group-related determinants, sialic acids, hyaluronan polysaccharides, fluorophores, biotin, radiolabels, and a range of peptides3-12. FSL constructs have been used in modifying embryos, spermatozoa, zebrafish, epithelial/endometrial cells, red blood cells, and virions to create quality controls systems and diagnostic panels, to modify cell adhesion/ interaction/ separation/ immobilization, and for in vitro and in vivo imaging of cells/virions3-12.
The process of modifying cells/virions is generic and extremely simple. The most common procedure is incubation of cells (in lipid free media) with a solution for FSL constructs for 1-2 hours at 37°C4-10. During the incubation the FSL constructs spontaneously incorporate into the membrane, and the process is complete. Washing is optional. Cells modified by FSL constructs are known as kodecytes6-9, while virions are kodevirions10.
FSL constructs as direct infusions and kodecytes/kodevirions have been used in experimental animal models7,8,10. All kodecytes/kodevirions appear to retain their normal vitality and functionality while gaining the new function of the F moiety7,8,10,11.
The combination of dispersibility in biocompatible media, spontaneous incorporation into cell membranes, and apparent low toxicity, makes FSL constructs valuable research tools for the study of cells and virions.
протокол
Следующий протокол описывает общие процедуры для вставки конструкций FSL (рис. 1) в биологических мембранах. Для простоты протокол будет относиться только к клеткам (kodecytes), которые на 100%-ной концентрации. Однако термин клеток взаимозаменяемы с вирионов (kodevirions) или организмов или клеточных структур и их концентрации в разбавителя не важно, при условии, что всегда последовательно между тестами, элементы управления и экспериментов. С красных кровяных телец гематокрита, как правило, 80%, но с вирионов, эмбрионов и другие клетки она обычно не превышает 1%. Метод очень надежен и будет производить модифицированных мембран при использовании в любом из ее вариантов, но уточнение необходимо будет оптимизировать и стандартизировать степени модификации, необходимые для конкретных приложений.
1. Подготовка FSL Создает
- Для подготовки акции FSL построить решение сначала восстановить сухой продукт FSL (табл. 1) путем добавления 1,0 мл растворителя (или, как указано в продукт вставить) к произведению флаконе. Кратко разрушать ультразвуком (30 секунд). Это подготовит 1mg/mL решение, которое может быть аликвоты 100 мкл в стерильные контейнеры и хранят при температуре 2-8 ° С не более одной недели или заморозить на срок до 3 месяцев.
- Для подготовки рабочих FSL построения решений для вставки, непосредственно перед использованием кратко разрушать ультразвуком (30 секунд) исходного раствора для гомогенизации любой мицеллы. Развести FSL построить в буфере (желательно, не содержащих липиды или очень гидрофобного материала) до концентрации, необходимой или над диапазон, если это необходимо.
Примечания:
- FSL конструкции, как правило, вставить в клетки в липидных средах, но, как правило, требуют столько, сколько 50X выше FSL рабочих концентрациях, чем если бы в ФБР или других липидных свободных средств массовой информации.
- Диапазон рабочих разведениях будет зависеть от приложения, чувствительность метода обнаружения, типа FSL построить и степени модификации требуется. Обычно диапазон разбавления будет составлять от 10-500 мкг FSL на мл растворителя для углеводов конструкций FSL и 1-100 мкг / мл для других конструкций, такие как FSL флуорофоров и биотин.
- При приготовлении вставки разбавители, содержащие несколько FSL построить, просто добавьте конструкций вместе в одном разбавителя на их обычное рабочее концентрации. Если одна конструкция при гораздо более высокой концентрации, чем другой, некоторая корректировка (увеличение) концентрации могут потребоваться для меньшей конструкции. Кроме конструкции могут быть добавлены последовательно, желательно с наибольшей концентрацией построить первую, а затем меньше.
- FSL построить концентрациях, превышающих 1000 мкг / мл может внести значительные суммы в липидной мембране клетки, и может изменить форму клетки или сделать его более восприимчивым к лизису.
- FSL построить рабочие растворы должны храниться при температуре 2-8 ° С и использовать в течение нескольких дней.
- FSL конструкции можно развести в воде, но будет иметь снижение стабильности и должны использоваться в течение нескольких часов. Если вкладыше указывается воды восстановления растворителя продукт в пузырек будет также содержать солей (как указано в листке-вкладыше).
2. Введение FSL Построить (ы) в мембранах
- Первый мыть ячейки для FSL модификация свободных несвязанных липидов путем центрифугирования и используя PBS или липидных свободных средств массовой информации клетки как промывочного раствора.
- Обновления клеток или приостановить в 100 мкл разбавителя.
- Одновременно подготовить контроля, которые в идеале должны быть как неизмененные клетки (инкубируют с PBS, а не FSL раствора) и / или клеток модифицированный доброкачественная, но связанных FSL конструкции.
- Добавить 100 мкл соответствующего разведения FSL решение (содержащие 1 или более FSL конструкции) в клетки и инкубировать в течение 1-2 часов при температуре 37 ° C. Аналогичный результат может быть получен на 6 часов инкубации при 25 ° С или в течение ночи (18 часов) при 4 ° С - смешивание рекомендуется каждые несколько часов, если тяжелые клеточные суспензии используются.
- Вымойте (опционально) дважды с PBS или СМИ, для удаления любых свободных конструкций FSL и подготовить соответствующие подвески.
Примечания:
- Разбавителя используется для приостановки клетки могут быть культуры клеток, PBS, решения ячейки хранения, и т.д., но желательно без липиды (например, эмбриональной телячьей сыворотки) или моющих средств (например, ТВИН).
- Различные объемы (более 100 мкл) отношений (чем 1:1 клеток / FSL раствора) или инкубации условий времени и температуры может использоваться при условии той же пропорции, концентрации и объема используются для получения воспроизводимых результатов.
3. Обработка и визуализация
- Как только процесс FSL модификация была завершена kodecytes можно хранить при температуре 4-8 ° C в липидных свободных средств массовой информации или использовали.
- Kodecytes и kodevirions вообще ведут себя так же, как немодифицированных клеток / вирионов и может быть Handlред и рассматривается в нормальных системах тестирования (микроскопия, серологические, проточная цитометрия и т.д.). Они, как правило, никаких особых требований, за исключением избежании растворителей / средства / липиды, которые могут элюировать липидного строит из мембран.
Примечания:
- Создает останется в мембране клетки неактивны, таких как эритроциты, при условии хранения в липидных свободных средств массовой информации для жизни клетки. В клетках с активной мембраны конструкций будет внутренним и метаболизируется, со скоростью, зависящей от активности клеток мембраны.
- Мертвые клетки, как правило, содержат высокие уровни конструкций FSL, что может быть использован для разделения нежизнеспособные клетки жизнеспособных клеток.
- Если kodecytes хранятся (или используются в естественных условиях) в липидных средах / сред, таких как сыворотка / плазма построить постепенно вымывается из мембраны в течение нескольких часов или дней, в зависимости от температуры и концентрации липидов / композиций.
4. Представитель Результаты:
- Следующие результаты представителя зависит от конструкции (табл. 1), его концентрации и вставлены относительная чувствительность и специфичность системы обнаружения (ы). В целом все FSL конструкций будет вставить в клетки через 1 час, но оптимальные условия должны быть созданы для каждой ситуации.
- FSL конструкции могут использоваться для маркировки вне разнообразие живых клеток 3-9,11,14. В примерах показано на рисунке 2 эмбрионов на разных этапах были использованы (как они хрупкие клетки), но и другие клетки (рис. 3) или окутан вирионов (рис. 4) также могут быть помечены. FSL-Fluorescein позволяет прямой маркировки поверхности (рис. 2-4), в то время FSL-биотин и другие конструкции FSL может потребовать использования вторичных система обнаружения (обычно авидин / антител / лектины), чтобы показать свое присутствие (рис. 5) .
- Группа крови маркеров человека или животного, специфичность может быть присоединена к клеткам, включая эритроциты 4-9 (рис. 6). Так как количество FSL построить на kodecyte управляема и воспроизводимые 4-6, kodecytes на антитела количественного может быть сделано (табл. 2 и рис 6). Фактический источник клеток, не важно, они могут быть любого вида, или даже одного и того же происхождения, источником антител, обеспечивая тем самым на только несовместимых антигенов является то, что введенные FSL 7,8 (рис. 6).
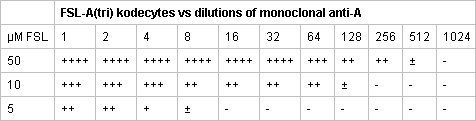
Таблица 2. Представителю серологические реакции трех различных FSL-(три) красный kodecytes ячейка сравнивается разведения моноклональных антител. 50 мкМ решение FSL-(три), когда инкубировали с равным объемом группа О эритроцитов произвела сильное антиген-положительных клеток, которые могут быть обнаружены 1:512 разведения моноклональных антител. 5 - и 10 раз ниже, FSL-(три) решений производится kodecytes с меньшей группой крови антиген выражения.

Рисунок 1. FSL построить обзор. Как цветок конструкций FSL состоит из трех основных компонентов. Функциональные головы (F) в случае FSL конструкция может быть различных биологически функциональных групп, распорку (S) призваны побудить расстоянии F от мембраны, улучшению водоснабжения дисперсности и быть не реагируют с сывороткой, в то время как диацилпероксиды липидного позволяет построить самопроизвольно включить в поверхностях. (I) FSL-GB3 с группой крови Gb 3 (или P л) трисахарида эпитопа Galα4Galβ4Glcβ. (II) FSL-(три) с группой крови трисахарида эпитопа GalNAcα3 (Fucα2) Galβ. (III) FSL-флуоресцеина. (IV) FSL-биотин с одним фрагментом F биотин. Функциональной группы структур в I-III сопряжены с активированным производным адипинат из dioleoylphosphatidylethanolamine (DOPE), тогда как прокладка структуры IV является carboxymethylglycine-адипинат основе.
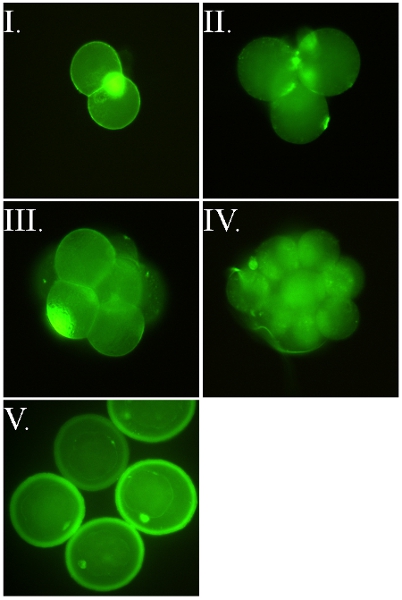
Рисунок 2. FSL-Fluorescein меченых мышиных эмбрионов. Все изображения живых эмбрионов, которые были помечены, когда их зона pellucida (ZP) цел (т.е. FSL построить прошли через ZP для обозначения эмбриона внутри). Изображения I-IV имеют ZP-свободные эмбрионы освобождаются от ZP с кислотой tyrodes сообщение маркировки с FSL-флуоресцеина. Идентичные окрашивание происходит независимо от того, эмбрионы были FSL модифицированных ZP ZP нетронутыми или бесплатно. Эмбрионы непосредственно помечены FSL-флуоресцеина, по 2 часа 37 ° С в сыворотке крови методом свободных средств массовой культуре клеток, промывают, а затем смотреть под флуоресцентной микроскопии. (I) ZP свободной двух клеток мышиных эмбрионов, также демонстрируют классические интенсивные полярные окрашивания тела. (II-III) ZP свободной четыре-клеток и восемь клетка мышиной эмбрионов, как показывает темные окрашивания клеток, которые аутовязь микроскопом плоскости фокуса. (IV) ZP свободной ячейки 16 мышиных эмбрионов. (V) ZP нетронутыми мышиных эмбрионов бластоцисты (d4-d5), где оба эмбриона и зона помечены.

Рисунок 3. FSL-флуоресцеина и данио 14. (I) Microangiography на 52 HPF (ч после оплодотворения) данио личинки непосредственно вводится в обращение с FSL-флуоресцеина. Сосудистую данио окрашивается. (II) FSL-Fluorescein гетерогенных данио рерио почечной ткани клеток (ZK kodecytes) были созданы бывших естественных условиях, то микро-вводится в обращение 52 данио рерио HPF получателя. В естественных условиях наблюдения из kodecytes ZK были сделаны 2 часа после инъекции по визуализации сосудистую под флуоресценции с покадровой микроскопии. Показана один кадр видео с большими медленные или неподвижные клетки (указаны с оранжевыми стрелками) и быстро движущихся клеток (смазывания изображения из-за движения - указано зелеными стрелками). Маркировка позволяет в режиме реального времени в естественных условиях наблюдение за поведением и биораспределения ZK kodecytes. (III) при пероральном приеме FSL-Fluorescein достигнуто путем погружения данио эмбрионов в FSL-Fluorescein средах на срок до 5 дней. Стиральная было достигнуто за счет передачи эмбрионов в средствах массовой информации, не содержащей FSL конструкции (не менее 6 часов требуется, но может быть в течение нескольких дней). (IIIa) Яркие области микроскопии FSL-Fluorescein лечение рыбок данио соответствующих соседних флуоресценции изображение (IIIb). Флуоресценции была преимущественно расположены в желудочно-кишечном тракте. Нет окрашивание наблюдалось в необработанных эмбрионов контроля (IVa и IVb).

Рисунок 4. FSL-Fluorescein маркировки вирионов 10 VSV и H1N1. (I) Вирус везикулярного стоматита (VSV) была прямо меченных 10 мкг / мл FSL-флуоресцеина в течение 2 ч при 37 ° С, а затем, фиксируя с 4% параформальдегида, а затем проточной цитометрии. Нет очистки VSV kodevirion сообщение FSL маркировка не требуется. (II) Проточная цитометрия свиного яичка клетках, инфицированных человека / Пуэрто Rico/8/1934 (H1N1) kodevirions помечены использованием FSL-флуоресцеина. Незараженных клеток рассматриваются как черная линия, в то время как слияние H1N1 kodevirion с ST клеток приводит к флуоресцентные клетки (красная линия).
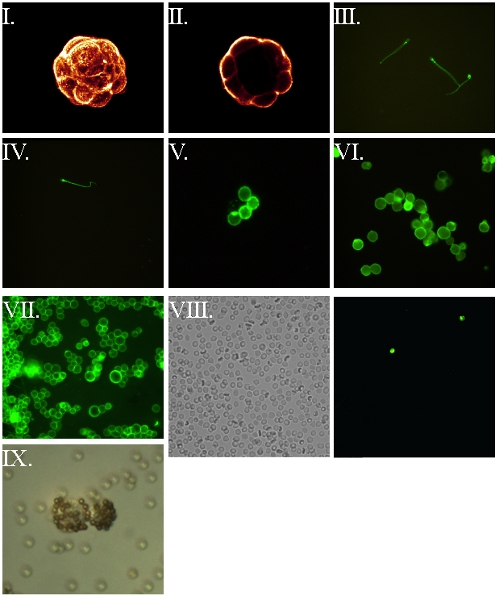
Рисунок 5. FSL-биотин меченых клеток и последующей визуализации с помощью меченого авидин 7,8. Все клетки впервые были названы с FSL-биотина в течение 1 ч при 37 ° С, промывают затем реагирует с флуорофора помечены авидин, вымытый и мокрой установлены для флуоресцентной микроскопии. (I) Составитель конфокальной образ мышиные бластоцисты эмбрион. (II) Центральный конфокальной кусочек эмбриона из предыдущего образа. (III) Live подвижных сперматозоидов человека - размытие происходит вследствие их движения. (IV) Исправлено (4% вставки параформальдегида пост) сперматозоидов человека. (V) эритроцитов человека. (VI) Исправлено (4% параформальдегида предварительно вставки) RL95 эндометрия карциномы человека. (VII) незаписанные RL95 эндометрия человека клеточной линии карциномы. (VIII) Биотин РБК kodecytes наблюдается в крови по 2 часа после внутривенной инфузии kodecytes с (VIIIa), представляющий поле смотреть под световым микроскопом в то время как (VIIIb) является той же самой области рассматривается под флуоресценции, определяя два kodecytes настоящее время в области -обзора. Расчет отношения к kodecytes немеченого клетки можно использовать в качестве индикатора на выживание. (IX) Живые человеческие эндометрия kodecytes биотин визуализируются с помощью привязки к avidinylated бисером.

Рисунок 6. FSL-углеводов, чтобы добавить маркеры групп крови для серологического профилирования. (I) прав эритроцитов Галили kodecytes были созданы с набором концентрация FSL-Галили (500 мкг / мл) и испытанные в сравнении с разведения сыворотки крови человека. Человек эритроцитов естественных условиях не встречаются с антигеном xenoantigen Галили. Такие kodecytes может быть использована для количественного уровня антител в сыворотке крови. В этом примере донор был полон решимости есть анти-Галили титр 1:32. (II) Создавая kodecytes с понижением уровня FSL ("антиген титры»), оптимальный уровень антигена для выявления антител можно определить (в данном примере Le). Клетки могут быть созданы, чтобы дать только положительный результат, когда уровень антител превышает определенный титр. Уровень FSL необходимых антигенов, чтобы дать положительный результат зависит от качества и уровня антител обнаружения. Для углеводных антигенов, решение FSL 100 мкг / мл, как правило, приводит к сильной положительной реакции. (III) группы O правам эритроциты были изменены, чтобы иметь определенный уровень муравейIGEN (стандартизированным kodecytes), и используется для точного количественного и воспроизводимо анти-в сыворотке крови человека. В этом примере анти-титр в группе O сыворотке испытываемый 1:32 и kodecytes готовили из собственных красных донора клеток. (IV) группы крови антигенов А и одновременно вставлены в одну группу O кюветы красные используются для создания слабое B слабые kodecytes. Эти kodecytes могут быть использованы для ABO целях контроля качества. Этот результат показывает анализ специально разработан слабая B слабые kodecyte испытанные в сравнении с анти-А и анти-В реагенты и дает ожидаемые слабые реакции.
Обсуждение
Изменение клеток и вирионы с конструкциями FSL является очень простой и надежной техникой 3-11. Чтобы описать и отличить FSL построить модифицированные клетки и вирионов из немодифицированных клеток, они называются kodecytes и kodevirions соответственно 6-10, но только тогда, когда представила функциональную группу, можно показать, чтобы присутствовать на их мембране. Когда kodecytes изготавливаются с различными концентрациями конструкций FSL, они могут быть переданы от концентрации раствора FSL построить используемых для их создания, например, 15 мкг / мл kodecytes, или, если более одного FSL используется, то комбинированный термин, например, биотин kodecytes + 7,8. Когда различные клетки для сравнения, в том числе типа клеток в описании рекомендуется, например, красные клетки биотин kodecytes или эндометрия kodecytes биотин 7,8.
Хотя процесс вставки очень надежен и вставки (хотя и с разной скоростью) будет происходить в широком диапазоне температур от 4 - 37 ° С и в течение нескольких минут до нескольких часов, чтобы получить воспроизводимые вставки строгий контроль времени контакта, температуры, концентрации FSL ( в том числе разбавителя формулировке), и, в меньшей степени концентрация клеток не требуется. На сегодняшний день все FSL конструкции могут быть использованы для изменения клетки тем же методом 4-11, однако ожидается, что определенные условия будут более благоприятными для рабочего процесса и / или оптимальные требования обработки клеток / вирионов быть изменены . Точная концентрация FSL для достижения желаемого эффекта необходимо определить пользователем 4. Результирующая FSL построить модифицированные клетки / вирионов обычно могут быть использованы таким же образом, как неизмененные клетки / вириона в биологических или аналитических систем 4-11. Как FSL конструкции постепенно вымывается из модифицированных поверхностей при контакте с нарушениями липидного решениями 7,8, или могли быть потреблены на активных клеток 11, эти вопросы должны рассматриваться по отношению к уровню сигнала или деятельности, полученные в течение периода времени. Kodecytes может быть фиксированным (например, глутаральдегида / формалина) после установки при условии, фиксирующие не содержит липидов элюирования растворители и функциональной группы совместим с фиксатором. Кроме фиксированные клетки могут быть изменены с помощью конструкции FSL.
В дополнение к модификации клетки и вириона поверхности FSL конструкции также может вводиться непосредственно в кровоток лабораторных животных в естественных условиях вызывает изменения циркулирующих клеток 7, а также подавляет вирусы 12, токсины, 12 и антител 7. FLS конструкции использовались также для украшения липосомы и могут быть распечатаны на бумаге поверхности 13, где они обездвижить, а затем могут быть использованы в диагностических тестов.
Возможность легко изменять живые клетки с расширяющийся ассортимент конструкций FSL должен доказать свою полезность исследований и разработок инструмент для изучения клеточной биологии поверхности.
Раскрытие информации
Дебора А. Бланк и Стивен М. Генри являются сотрудниками и акционерами Kode Biotech ограниченной патентообладателем технологии Kode. Дэн Бесс является сотрудником Sigma-Aldrich, который спонсировал производство этого видео-статьи.
Благодарности
Авторы благодарят Дэн Бесс от Sigma-Aldrich для представления видео. Мы также благодарим Дону отделения Евгений Черный, Скотт Chesla, Элизабет Hadac, Аманда Харрисон, Дэмиен Хиткот, Анника Халт, Чуан-Цзин Lan, Сюзанна Макинтош, Sarvani Komarraju, Елена Корчагина, Кэролайн Оливер Мартин Олссон, Стивен Паркер, Игорь Rodinov, Александр Тузиков, и Элеонора Уильямс за свои результаты и вклад в проектирование, синтез конструкции FSL и определения биологической активности.
Материалы

Таблица 1. Коммерчески доступные FSL конструкции, описанные в этой статье.
Ссылки
- Waehler, R., Russell, S. J., Curiel, D. T. Engineering targeted viral vectors for gene therapy. Nat. Rev. Genet. 8, 573-587 (2007).
- Strable, E., Finn, M. G. Chemical modification of viruses and virus-like particles. Curr. Top. Microbiol. Immunol. 327, 1-21 (2009).
- Henry, S., Bovin, N. The development of synthetic peptidolipids, glycolipids and other lipid-linked structures to create designer red cells. Transfusion. 48, Suppl 2S. 194A-194A (2008).
- Frame, T., Carroll, T., Korchagina, E., Bovin, N., Henry, S. Synthetic glycolipid modification of red blood cell membranes. Transfusion. 47, 876-882 (2007).
- Hult, A. K., Frame, T., Henry, S., Olsson, M. L. Flow cytometry evaluation of red blood cells transformed with variable amounts of synthetic A and B glycolipids. Vox Sang. 95, Suppl 1. 180-180 (2008).
- Henry, S. Modification of red blood cells for laboratory quality control use. Curr. Opin. Hematol. 16, 467-472 (2009).
- Oliver, C., Blake, D., Henry, S. In vivo neutralization of anti-A and successful transfusion of A antigen incompatible red cells in an animal model. Transfusion. , Forthcoming (2011).
- Oliver, C., Blake, D., Henry, S. Modeling transfusion reactions and predicting in vivo cell survival with kodecytes. Transfusion. , Forthcoming (2011).
- Heathcote, D., Carroll, T., Wang, J. J., Flower, R., Rodionov, I., Tuzikov, A., Bovin, N., Henry, S. Novel antibody screening cells, MUT+Mur kodecytes, created by attaching peptides onto erythrocytes. Transfusion. 50, 635-641 (2010).
- Hadac, E. M., Federspiel, M. J., Chernyy, E., Tuzikovb, A., Korchagina, E., Bovin, N. V., Russell, S. J., Henry, S. M. Fluorescein and radiolabeled Function-Spacer-Lipid constructs allow for simple in vitro and in vivo bioimaging of enveloped virions. J Virol Meth. 10, Forthcoming (2011).
- Blake, D., Lan, A., Love, D., Bovin, N., Henry, S. Fluorophore-kodecytes - fluorescent function-spacer-lipid (FSL) modified cells for in vitro and in vivo analyses. FEBS J.. 277, Suppl 1. 199-199 (2010).
- Harrison, A. L., Olsson, M. L., Brad Jones, R., Ramkumar, S., Sakac, D., Binnington, B., Henry, S., Lingwood, C. A., Branch, D. R. A synthetic globotriaosylceramide analogue inhibits HIV-1 infection in vitro by two mechanisms. Glycobiology. 27, 515-524 (2010).
- Barr, K., Diegel, O., Parker, S., Bovin, N., Henry, S. Function-Spacer-Lipid (FSL) constructs enable inkjet printing of blood group antigens. FEBS J. 277, Suppl 1. 235-235 (2010).
- Lan, C. -C. Modeling inflammatory bowel disease [dissertation]. , University of Auckland. Auckland. (1988).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены