Method Article
Single Cell транскрипции Профилирование взрослых кардиомиоцитов мышь
В этой статье
Резюме
Одноместный профилирования выражение клеток позволяет детальный анализ экспрессии генов в отдельных клетках. Мы опишем методы для выделения кардиомиоцитов, а также подготовку результате лизатов или для целого микрочипов транскриптома или КПЦР конкретных задач.
Аннотация
Хотя многочисленные исследования изучили изменения экспрессии генов из гомогенатов сердечной ткани, это препятствует изучению присущих изменение стохастической между клетками в тканях. Выделение чистой кардиомиоцитов населения посредством коллагеназы кровоснабжение сердца мышь облегчает поколение микрочипов одной ячейки для целого транскриптома экспрессии генов, или КПЦР конкретных целей с использованием nanofluidic массивов. Мы описываем здесь процедуры для изучения одной клетки профили экспрессии генов кардиомиоцитов изолированного от всего сердца. Эта парадигма позволяет оценки метрик интерес, который не зависит от среднего значения (например, разницы между клеток в ткани), что невозможно при использовании обычных целом рабочие процессы тканей для оценки экспрессии генов (рис. 1). Мы добились надежных усиление одной клетки транскриптома уступая микрограмм двухцепочечной кДНК, которая облегчает использование микрочипов на яndividual клеток. В процедуре мы описываем использование массивов NimbleGen, которые были отобраны за их простоту использования и возможность настройки их конструкции. Кроме того, обратной транскриптазы - удельный усиления цели (RT-STA) реакции, позволяет КПЦР сотни мишеней nanofluidic ПЦР. Использование любого из этих подходов, можно изучить изменчивость выражения между клетками, а также рассмотреть профили экспрессии редких типов клеток из ткани. В целом, одной клетке экспрессию генов подход позволяет поколение данных, которые потенциально могут определить своеобразный профилей выражение, которое, как правило, усредняются при рассмотрении выражения из миллионов клеток от типичных гомогенатах полученные от целого тканей.
протокол
1. Шаг 1 - кардиомиоцитов изоляции
- Подготовка пищеварения буфера следующим образом:
10 х Пищеварение буфера (производство сверхчистых H 2 O)Заключительные Конц. г / л g/500 мл 10x решение г / л NaCl 130 мМ 7,597 3,3 75,97 KCl 5 мМ 0,4 0,2 4,0 Пировиноградная кислота 3 нМ 0,33 0,165 3,30 HEPES 25 мМ 5,96 2,85 59,6 MgCl 2 0,5 мМ 0,101 0,05 1,01 NaH 2PO 4monobasic 0,33 мм 0,04 0,02 0,40 Декстроза 22 мм 3,96 1,98 39,6
буфера рН до 7,4 с NaOH - Использование 10x Буфер пищеварение, сделайте следующие четыре решения для каждого сердца, которое будет перфузии (производство сверхчистых H 2 O):
Пищеварение буфера (Сделайте три порции этого решения)
- 50 мл - 1x буфера пищеварения, содержащий:
- 75 мкл - EGTA решение (100 мМ EGTA)
Пищеварение буфера B (Сделайте один из них)
- 25 мл - 1x буфера пищеварения, содержащий:
- 1,25 мкл - CaCl 2 решения (1 М)
- 1 мг - протеазы
- 25 мг - коллагеназы (околоя также использовать 75% от этой суммы = 18,75 мг) **
Коллекция Buffer (Сделайте один из них)
- 2,5 мл - 1x буфера пищеварения, содержащий:
- 1,25 мкл - CaCl 2 решения (1 М)
- 0,5 мг - протеазы
- 15 мг - коллагеназы (75% = 11,25 мг) **
- 125 мг - BSA
Нейтрализация промывочного буфера (Сделайте один из них)
- 25 мл - 1x буфера пищеварения, содержащий:
- 6,25 мкл - CaCl 2 решения (1 М)
- 250 мг BSA
** В зависимости от источника и партия коллагеназы, активность фермента может меняться. Это может быть необходимо оптимизировать количество фермента, добавил в этот буфер, чтобы предотвратить чрезмерное пищеварения.
- Настройка изоляции системы, как описано ранее в гetail 1,2 с тремя 15 мл стаканов Пищеварение буфера на льду, один 50 мл трубки Пищеварение буфера и 25 мл Пищеварение буфера B готовы к перфузии (Пищеварение буфера должны быть удалены через линию, как минимум 5 мл проходят через систему), Сборник буфера подогреть в водяной бане, чтобы поднять температуру до 37 ° С, а буфер Нейтрализация стирка при комнатной температуре.
- Заполните канюли перфузии и рассечение блюдо, где сердце будет очищен и привязали на кончике перфузии с холодной А. буфера Пищеварение Свободно узел некоторые шва (4-вывода 6-О размере) вокруг верхней части канюли. Это в дальнейшем будет использоваться для хранения аорты для предотвращения соскальзывания сердце канюли.
- Неизлечимо степенный мышь с IP-инъекцию анестетика (0,25 мл Натрия пентобарбитал раствор) и обеспечить мышь находится в бессознательном состоянии и не реагирует на болевые раздражения. Разрежьте грудной полости тщательно вдоль грудной маржи за счет сокращения диафрагмы(Рис. 2). Отрежьте сверху вверх и отражают передней грудной клетки (эти разрезы обозначаются В, и, соответственно, на рисунке 2) Критические -. Мыши все равно должны быть дыхание до этих разрезов.
- Использование пластиковых сократить пипеткой по размеру, нежно посасывать сердце в пипетку. Вырезать сердце из грудной полости будьте осторожны, чтобы оставить достаточно аорты на сердце, чтобы четко определить аорты ветвь (рис. 3). Пипетка используется, поскольку она вызывает минимальные повреждения сердца.
- Оставьте сердце в один стакан ледяного буфера Пищеварение и ополосните крови прочь. Через 15 - 45 сек место сердца во второй стакан ледяного буфера Пищеварение кратко снова промыть. Передача сердце в чашке Петри также заполнены холодной А. буфера Пищеварение
- Посмотреть сердца в блюдо Пищеварение буфера при вскрытии рамки и тщательно изолировать аорты и ее ветвей. Тщательно отделки просто уступает последней brancч (рис. 4).
- Установите наконечник канюли в аорту и перевязывать в месте с 4-O-6-O шва использованием этапе установки при вскрытии микроскопом. Убедитесь, что канюля не сидит слишком низко в аорте и остается выше коронарных артерий (рис. 4).
- С пищеварением буфера, протекающий через перфузии установки, место перфузии наконечник на установку, и начинают заливать сердце, пока большинство крови отмывали от сердца и жидкости оставив сердце ясно. Критические - температура перфузии жидкости должна быть как можно ближе к 37 ° С, когда он выходит из катетера. Если раствор слишком жарко или слишком холодно, то убьет перфузии тканей. Время, пока кровоснабжение сердца также имеет важное значение. Временное окно должно быть не менее 5-10 мин после удаления сердца до перфузии начинается. Сердце должно быть удалено под наркозом, а не CO 2 аффиксация или шейки дислокации.
- Как только кровь былаHed от сердца, переключитесь в буфер B Пищеварение из буфера А. Пищеварение Убедитесь, что B Пищеварение буфера теперь течет через сердце. Решение начнет имеют желтый оттенок. Подождите 2-3 минут, пока сердце показывает признаки потерять свою форму и начинает выглядеть округлыми что свидетельствует о том, что пищеварение работает. Миокарда должны появиться легкие, как перфузии продолжается.
- Сокращение желудочков с ножницами и поместить в 50 мл коническую пробирку, содержащую 15 мл Коллекция буфера при 37 ° C. Аккуратно вырезать желудочка на мелкие кусочки при размещении ткани в коллекции буфера. Осторожно перемешать с пластиковой пипеткой, чтобы растворить межклеточных спаек и сделать одну смесью кардиомиоцитов клетки.
- Когда большинство из ткани в раствор, (менее 1 мин) позволяют крупные куски ткани опускаются на дно. Снимите и сохраните супернатант в 15 мл коническую трубку. Пусть сила тяжести гранул от надосадочной свыше 10 до 20 мин (15мин предпочтительно) при комнатной температуре.
- Удаляют супернатант. Вымойте гранул путем добавления 5 мл промывочного буфера Нейтрализация для гранул и хорошо смешайте клетки ресуспендируют них. В этот момент клетки уже готова к выбранным для одиночного анализа клетки (переходите к шагу 2).
2. Шаг 2 - Выделение отдельных клеток
- Подготовка микроманипулятора использованием пламени и стеклянной капиллярной трубке, которая будет использоваться для управления клетками. Микроманипулятора просто очень тонкой капиллярной трубки, затем прикрепляется к длинный кусок гибкого шланга, который может двигаться или забрать клетки при всасывании применяется.
- Сразу переходите к выбору отдельных клеток под микроскопом (Nikon Eclipse TS100, 20x) с помощью микроманипулятора который был создан с вытащил пипетки и шлюз для предотвращения материал передается один образец ячейки образцов. Убедитесь, что клеточную популяцию здоровых(70% целесообразны) и не повреждена изоляция от процесса.
- Развести ячейки вниз в небольшой чашке Петри, чтобы они могли быть выбраны индивидуально. При выборе клетки не забудьте захватить клетки в небольшом объеме (менее 2 мкл). Выберите только здоровые клетки, которые имеют отличительные нормальной морфологией кардиомиоцитов (рис. 5).
- Место отдельных клеток в нижней части отдельных трубок ПЦР и заморозить их сразу же на сухом льду. Эти клетки затем хранится при температуре -80 ° С, пока они не будут использоваться для генной анализа экспрессии.
3. Шаг 3A - одной клетки КПЦР экспрессии генов
Для выполнения КПЦР на отдельные клетки используют протокол адаптирован из одного разработанные для одного выражения гена ячейки Fluidigm корпорация по их Biomark Nanofluidic массивы КПЦР (Fluidigm - Advance развития Протокол № 30) 3,4.
- Подготовка обратной транскрипции - Специальные усиления цели (RT-STA). Чтобы бытьджин, ресуспендируют всех пар праймеров (мы использовали до 125 пар праймеров успешно) для генов интерес при 100 мкМ в буфере 1x подвески ДНК (10 мМ Трис, рН 8,0, 0,1 мМ ЭДТА). Объединение и дальнейшее разбавить прямом и обратном пар праймеров до 20 мкМ для каждого анализа. Наконец, развести всех пар праймеров в одно решение с конечной концентрации 200 нМ для каждого анализа, которые будут усиливаться в RT-STA реакции. Чтобы сделать это, возьмите каждый пары праймеров и разбавить их 1:100. Например, если у вас есть 30 пар праймеров анализа при 20 мкМ, вам нужно добавить 1 мкл каждой пары (30 мкл общего числа), а затем составляют оставшуюся часть объема с 70 мкл ДНК-буфера подвески выйти в финал разбавления объемом 100 мкл.
- Теперь, когда грунтовка растворы готовят, сборки RT-STA реакция мастера микса. Подготовка достаточно мастера микса для каждого из отдельных ячеек вы хотите усилить.
Таблица 1. RT-STA Master MixРеагент Объем в мкл (на реакцию) CellsDirect 2x смесь реакции 5,0 Надстрочный III RT Plantinum Taq смеси 0,2 RT-STA Primer смеси (200 нМ каждого анализа) 2,5 Нуклеазы Бесплатный H 2 O (или 1x буфер подвески ДНК) 1,3 Общий 9,0 - Немедленно снять замороженные клетки и центрифуги при максимальной RCF в течение 30 секунд для того, чтобы клетки расположены в нижней части трубы. Добавить 9 мкл RT-STA смеси для трубки и перейти к реакции в амплификаторе.
- 50 ° C - 15 минут
- 95 ° C - 2 минуты
- 18 циклов
- 95 ° С в течение 15 секунд
- 60° С в течение 4 минут
- Держите при температуре 4 ° C
- Удалить труб из машины ПЦР и добавить 4 мкл ExoSAP-IT для реакции. ExoSAP-IT является реагентом очистки ПЦР который удалит избыток грунтовки и фермента из RT-STA реакции. Запуск трубы через следующую реакцию в машине ПЦР.
- 37 ° C - 15 минут
- 80 ° C - 15 минут
- Держите при температуре 4 ° C
- Когда ExoSAP-IT лечения полно; разбавленных образцах 1:05 буфером подвески ДНК. Образцы теперь готовы для анализа КПЦР. Мы используем этот материал в сочетании с Экспрессия генов Fluidigm в КПЦР массивы (48,48 или 96,96 пластины). Возможно также использовать этот подход с более традиционными приборами КПЦР (96 или 384 и форматов). Однако эти инструменты как правило, требуют гораздо больше образцов вход, который ограничивает количество анализов, которые могут быть рerformed из одной ячейки.
3. Шаг 3B - Всего усиления транскриптом и микрочипов одиночных клеток
Добыча и усиления
- Использование Сигмы WTA2 комплект (Cat # WTA2) для амплификации двухцепочечной кДНК с обеих гранул и отдельных клеток. Отдельные клетки являются "извлеченный" через первый шаг WTA2 протокол от Sigma в соответствии с инструкциями производителя. Во время этого первого шага инкубации с библиотекой буфера синтеза при 37 ° С в течение 5 минут разрушает мембраны клеток и одно "экстракты" сообщение для усиления.
- Amplify одиночных камерах в два тура, следуя указаниям из WTA2 комплект Сигма-Олдрича. Выполните шаг библиотеки приготовительные в соответствии с протоколом производителя, а затем добавить 1 / 5 часть библиотеки образца 70 мкл WTA2 усиления
Master Mix. Amplify образцы в течение 25 циклов с использованием рекомендуемых параметров на велосипеде. - Purify образцы USIQIAquick нг Qiagen в ПЦР Очистка Kit (Cat # 28104) и процесса на Qiacube Qiagen, используя "Очистка QIAquick реакции ПЦР-амплификации Стандартный V4" протокол.
- Концентрат очищенных образцов до 5 мкл, используя скорость вакуум, и положить через второй раунд усиления в течение 17 циклов (WTA2 протокол усиления и езда на велосипеде параметров повторяются).
- Purify образцов с использованием ПЦР Очистка QIAquick Kit и проверки качества, используя спектрофотометр и NanoDrop BioAnalyzer компании Agilent ДНК 7500 комплект в соответствии с протоколом производителя.
Маркировка и NimbleGen Массивы экспрессии генов
- Этикетка 2 мкг двухцепочечной кДНК из каждой ячейки усиливается примера с использованием Один NimbleGen в цвет маркировки Kit (Cat # 05223555001) в соответствии с протоколом производителя.
- Гибридизации 5 мкг Cy3 помечены образец Mus мышцы 12x135k, NimbleGen экспрессии генов массивы (Cat # 05543797001) в соответствииОрдинг протоколу производителя. После гибридизации образцы массивов, слайды должны быть затем промывают и сушат, прежде чем они могут быть отображены на лазерный сканер.
- Сканирование экспрессии генов массивов с помощью лазерного сканера. Здесь мы используем Molecular Devices GenePix 4200A Сканер с настройками 100POW, и 300-350PMT. Затем генерировать пару файлов для каждого массива, используя программное обеспечение NimbleScan NimbleGen и впоследствии анализировать в целом транскриптома выражения из каждого отдельного массива ячейки (таблица типичных стабильно выразил кардиомиоцитов стенограммы включен в качестве дополнения; Таблица S1).
Если сердце работало хорошо перфузии не должно быть высокий процент здоровых клеток сердца, которые сохраняют их типичные прямоугольной морфологии от изоляции. Если перфузия не идти хорошо, то не будет большой процент мертвых клеток (см. изображение на рисунке 5). Если элементы правильно усиливается с помощью либо WTA2 или RT-STA методыл готовой продукции должен пройти последующие тесты контроля качества для качества мРНК образцов NanoDrop и BioAnalyser (рис. 6). Для рабочих процессов микрочипов, это завершено после усиления WTA, где мРНК проверяется как NanoDrop и Bioanalyzer. Представитель положительные результаты для этого анализа показаны на рисунке 6. WTA2 образцы должны показать надежную усиления с обеих NanoDrop чтения спектрофотометр, а также electropherogram считывания информации с Bioanalyzer (BA) чипе (рис. 6). Таблица генов, которые были обнаружены с помощью стабильно микрочипов одиночных клеток входит в качестве примера (табл. S1). Для процесса КПЦР, качество данных, можно оценить, выполнив шаг расплава в конце реакции ПЦР, чтобы грунтовка наборы усиливающих целевого продукта (рис. 7). Если все правильно, этот шаг должен расплавиться генерировать один конкретный расплава пика. Чтобы проиллюстрировать это утверждение, подмножество nanofluidic КПЦР данные показываются в Тепловая карта пика расплава тemperature (рис. 8) 8. Есть возможность оценить качество продукта ПЦР ее температуры расплава чтобы убедиться в отсутствии неспецифических продуктов 5. Каждая строка этой карте представляет одну ячейку образца (S1-S40) протестированы в 43 отдельных тестов КПЦР (А1-А43). На этом рисунке видно, что некоторые анализы очень изменчивы и, вероятно, менее надежны, чем более стабильные тесты с более высокой специфичности ПЦР.
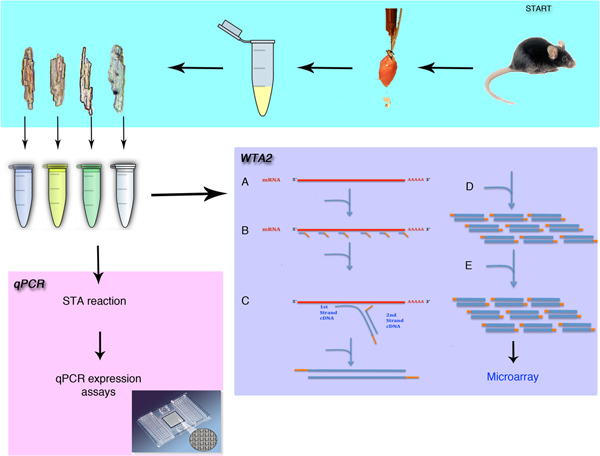
Рисунок 1. Обзор одном изоляторе и анализа экспрессии генов. Процедура будет демонстрировать хирургическое удаление мыши сердце и изоляции отдельных кардиомиоцитов. Методы, описанные в этой процедуре включает методы либо КПЦР или микрочипов анализа при общем усилении транскриптом (WTA). Процедура начинается с WTA лизис (), то обязательным праймеров универсальные сигм (В) к мРНКбассейн. Распространение этих праймеров (С) и усилением (D) этап создания микрограмм усиленного материала. Это усиление повторяется (E) для создания достаточно материала для процедуры микрочипов.

Рисунок 2. Представление расположение разрезов, чтобы удалить из сердца мыши. Отрежьте вдоль боковой стенке грудной клетки (), затем разрезать вдоль нижнего края грудной клетки (B). Резка суда над и под сердцем разрешить снятие то же время оставляя достаточно аорты на иглу в сердце. Изображения взято из МЮ Кук 6.
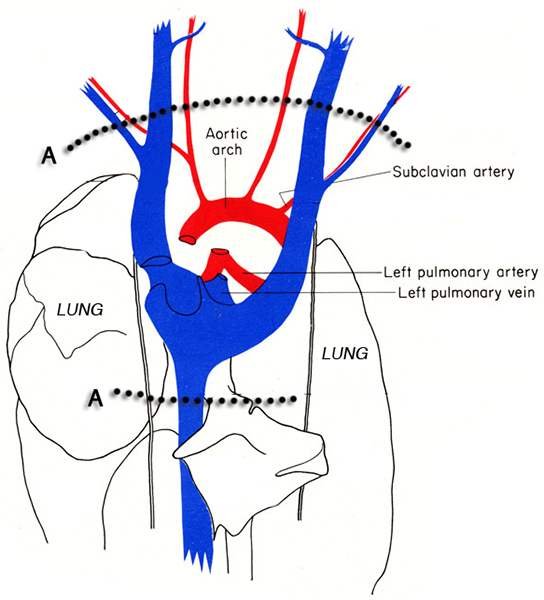
Рисунок 3. Схема грудной клетки мыши. Пунктирные линии указывают расположение разрезов () для вырезания сердце из грудной полости без повреждения ч Eart ткани. Изображения взято из МЮ Кук 6.
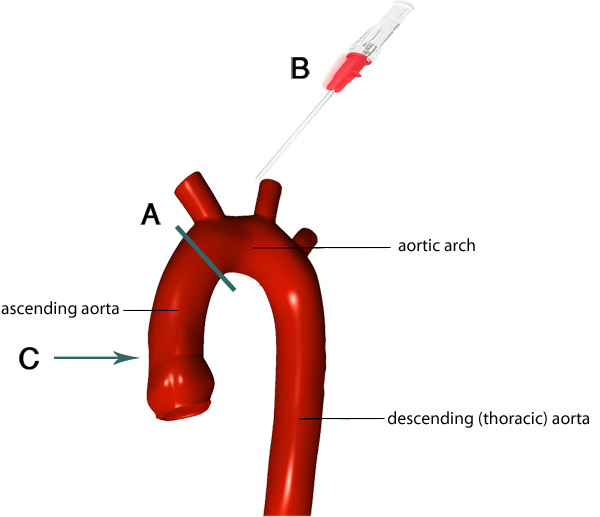
Рисунок 4. Изображение дуги аорты и ее ветвей. Серая линия показывает идеальное место, где урезать аорты (А). Остальные аорты прилагается к сердцу канюлированные так, чтобы кончик канюли (B) идет на соответствующем уровне в рамках аорты (С). Изображения адаптированный Ф. Гайяр 7.

Рисунок 5. Выбор отдельных клеток для генного анализа экспрессии. Каждая панель показывает кардиомиоцитов отображаемого под световым микроскопом с типичными морфологии кардиомиоцитов. Здоровый кардиомиоцитов отмечены зелеными стрелками. Клетки, которые являются мертвые или умирающие показаны красными стрелками. Эти мертвые клетки не должны использоваться в анализе.
iles/ftp_upload/3302/3302fig6.jpg "ALT =" Рисунок 6 "/>
Рисунок 6. Контроль качества WTA результаты для одного усиления клетки. () Изображение NanoDrop считывания спектрофотометр, который подходит для усиления стенограммы реакции WTA. (B) считывания информации с чипа BioAnalyzer показывает результаты трех усиливается клеток.
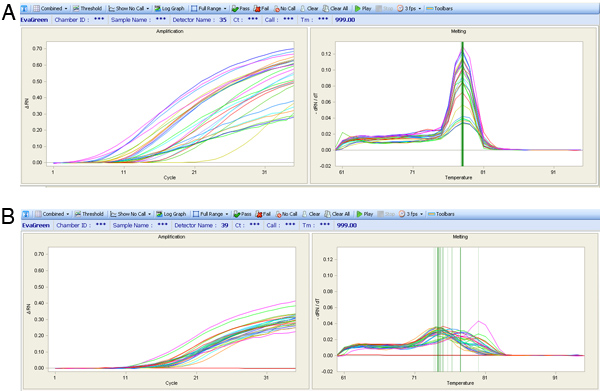
Рисунок 7. КПЦР усиления кривых (левый график) и пиковой температуры расплава кривых (правый график). (А) выражение результатов анализа качества показываются с одним расплава пик, несмотря на различные кривые усиления. (B) Растопите кривые скудный набор грунтовка, которая сильно варьирует расплава пики, которые не является идеальным для выражения анализа.
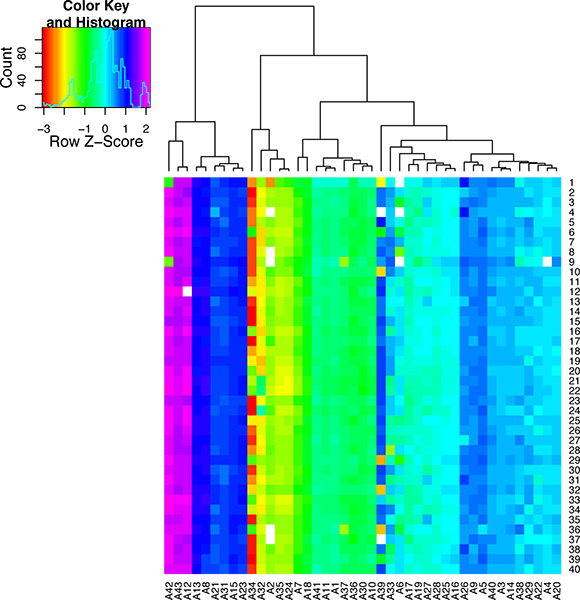
Рисунок 8. Контроль качества результатов для одной клетки реагируют КПЦРионов. Это тепло карта была создана для отображения температуры расплава в качестве цветовой гаммы. Пиковая температура плавления для каждого анализа КПЦР (А1-А43) показан в течение 40 отдельных ячеек (S1-40). Анализы были сгруппированы в соответствии с их температуры плавления. Глядя вниз по колонке для каждого анализа можно видеть изменение расплава во всех образцах. Эта цифра показывает, что некоторые КПЦР тесты очень специфичны то время как другие сильно варьируют и, следовательно, не подходят для одного анализа клеток.
Таблица S1. Справочная таблица данных микрочипов. Эти гены перечислены в соответствии с надежностью, в которых они обнаружены в одном кардиомиоцитов через большой набор данных. Этот ген список указывает на чувствительность определения для ряда генов, которые, как правило, выражается в одном кардиомиоцитов.
Обсуждение
Этот метод имеет возможность генерировать кардиомиоциты для ряда функциональных, а также исследования экспрессии генов. Изучение отдельных клеток является растущей области в гене анализа экспрессии. Преимущество изучения транскрипционных уровней, на уровне одной клетки, что он позволяет изучить чистой популяции клеток, которые не представляется возможным из цельного тканевые препараты. Кроме того, в одном анализе клеток позволяет для изучения стохастических изменение уровня мРНК в отдельных ячейках для определения клеточных популяций, которые ранее считались однородными 8,9. В дополнение к идентификации генов, которые потенциально являются стохастические в их экспрессии генов 10,11,12, метод также позволяет идентификации редких клеточных популяций определяется их профили экспрессии генов.
Хотя этот метод предоставляет ряд интересных возможностей применения в генной анализа экспрессии, Есть сомовэлектронной предостережения и аспекты использования отдельных клеток. Основное ограничение для одного анализа клетки, коллекция достаточное количество клеток в эксперименте для достижения статистической значимости по отношению к метрике интерес, например дисперсии. В случаях, когда число клеток, выделенных из тканей проценты не ограничение, можно рассмотреть сотни клеток на группы, используя подходы, такие как нового поколения, секвенирование, или nanofluidic массивов. Тем не менее, в некоторых случаях, могут быть трудности с получением достаточного клетки из тканей, представляющих интерес. Это может быть отчасти вызван своеобразный время интенсивных процедур для сбора целевых типа клеток. Тем не менее, тщательного планирования и подготовки перед продолжением одной коллекции клетка может по-прежнему позволяют строгий анализ одной ячейке с ограниченной технической ошибки. При рассмотрении результатов необходимо учитывать, что, хотя эта процедура выделения клетки были использованы в многочисленных Studieс (в том числе микроскопии, электрофизиологии и др.), изоляция сама по себе может потенциально эффект экспрессии генов. Как и любой метод, который манипулирует биологических образцов, результаты ваших выводах должны быть тщательно проверяются на обеспечение одного выражения ячейки представитель самой ткани, а не техническим уклоном. Такие методы, как на месте гибридизация может оказаться полезным для проверки этих результатов в неповрежденной ткани. Наконец, крайне важно, чтобы гарантировать, что данные, полученные тщательно проверяется на предмет контроля качества. Данные, приведенные на рисунке 8 показано, что КПЦР анализы могут быть очень надежными в их специфичности, таких как анализ # 13 (A13) или имеют высокий уровень изменчивости, которая может привести к технической дисперсии, такие как анализ # 34 (А34).
Раскрытие информации
Свободный доступ и производство этого данной статьи является спонсором Sigma-Aldrich.
Благодарности
Авторы хотели бы выразить признательность технической помощи С. Zambataro во время съемок этого протокола. Мы выражаем искреннюю благодарность поддержке Гленн Фонда медицинских исследований (SM), Hillblom фонд, и Национальный институт здоровья для Центра награду Ударная Натан (P30AG025708) и PO1AG025901. JMF был поддержан T32AG000266 присуждена Бак Институт исследований по проблемам старения.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| NaCl | Sigma-Aldrich | 71378 | |
| KCl | Sigma-Aldrich | 60128 | |
| Пировиноградная кислота | Sigma-Aldrich | P4562 | |
| Hepes | Sigma-Aldrich | 54457 | |
| MgCl 2 | Sigma-Aldrich | M1020 | |
| NaH 2 PO 4 одноосновных | Sigma-Aldrich | P9791 | |
| Декстроза | Sigma-Aldrich | G6721 | |
| NaOH | Sigma-Aldrich | 72068 | |
| EGTA | Sigma-Aldrich | O3777 | |
| CaCl 2 | Sigma-Aldrich | 21115 | |
| Протеазы, Тип XIV | Sigma-Aldrich | P5147 | |
| Коллаgenase, Тип I | Уортингтон | C9891 | |
| 1x ДНК Подвеска буфера (10 мМ Трис, рН 8,0, 0,1 мМ ЭДТА) | TEKnova, | П. Н. T0221 | |
| BSA | Sigma-Aldrich | B8667 | |
| Натрий пентобарбитал | Генри Шайн Vet. * Поставка | Связаться с поставщиком для заказа | * Должны быть закуплены по ветеринарии или лабораторных животных профессиональной |
| ExoSAP ИТ | Affymetrix / USB | 78201 | |
| CellsDirect 2x Mix Rxn | Invitrogen | 11737-030 | |
| Надстрочный III RT Платиновый Taq Mix | Invitrogen | 10928-042 | |
| RT-STA Primer Mix | IDT | Обычай | |
| Нуклеазы свободной воды | Sigma-Aldrich | W4502 | |
| WTA2 | Sigma-Aldrich | WTA2-50rxn | |
| Qiaquick ПЦР-комплект очистки | Qiagen | 28104 | |
| Qiacube | Qiagen | 9001292 | |
| NanoDrop Спектрофотометр | NanoDrop | 2000c | |
| BioAnalyzer ДНК 7500 комплект | Agilent | 7500 комплект | |
| Один цвет маркировки комплект | Рош-NimbleGen | 5223555001 | |
| Муз мышцы 12x135k массив | Рош-NimbleGen | 5543797001 | |
| GenePix 4200A Сканер | Molecular Devices | 4200A | |
| TransPlex Полное Целое Kit Усиление транскриптома (WTA2 Kit) | Sigma-Aldrich | WTA2-50RXN |
Ссылки
- Wolska, B. M., Solaro, R. J. Method for isolation of adult mouse cardiac myocytes for studies of contraction and microfluorimetry. Am. J. Physiol. 271 (3 Pt 2), H1250-H1255 (1996).
- Shioya, T. A simple technique for isolating healthy heart cells from mouse models. J. Physiol. Sci. 57 (6), 327-335 (2007).
- Guo, G., Huss, M., Tong, G. Q., Wang, C., Li Sun, L., Clarke, N. D., Robson, P. Resolution of cell fate decisions revealed by single-cell gene expression analysis from zygote to blastocyst. Dev. Cell. 18 (4), 675-685 (2010).
- Narsinh, K. H., Sun, N., Sanchez-Freire, V., Lee, A. S., Almeida, P., Hu, S., Jan, T., Wilson, K. D., Leong, D., Rosenberg, J., Yao, M., Robbins, R. C., Wu, J. C. Single cell transcriptional profiling reveals heterogeneity of human induced pluripotent stem cells. J. Clin. Invest. 121 (3), 1217-1221 (2011).
- D'haene, B., Vandesompele, J., Hellemans, J. Accurate and objective copy number profiling using real-time quantitative PCR. Methods. 50 (4), 262-270 (2010).
- Cook, M. J. The Anatomy of the Laboratory Mouse. Informatics. , (1965).
- Gaillard, F. Aorta. Radiopaedia. , (2008).
- Ståhlberg, A., Andersson, D., Aurelius, J., Faiz, M., Pekna, M., Kubista, M., Pekny, M. Defining cell populations with single-cell gene expression profiling: correlations and identification of astrocyte subpopulations. Nucleic Acids Res. 39 (4), e24-e24 (2011).
- Zhong, J. F., Chen, Y., Marcus, J. S., Scherer, A., Quake, S. R., Taylor, C. R., Weiner, L. P. A microfluidic processor for gene expression profiling of single human embryonic stem cells. Lab Chip. 8 (1), 68-74 (2008).
- Bahar, R., Hartmann, C. H., Rodriguez, K. A., Denny, A. D., Busuttil, R. A., Dollé, M. E., Calder, R. B., Chisholm, G. B., Pollock, B. H., Klein, C. A., Vijg, J. Increased cell-to-cell variation in gene expression in ageing mouse heart. Nature. 441 (7096), 1011-1014 (2006).
- Raj, A., van Oudenaarden, A. Nature, nurture, or chance: stochastic gene expression and its consequences. Cell. 135 (2), 216-226 (2008).
- Elowitz, M., Levine, A., Siggia, E., Swain, P. Stochastic gene expression in a single cell. Science. 297 (5584), 1183-1186 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены