Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Анализ Магистральные нейронной клеточной миграции Crest с использованием модифицированного Zigmond пробирной палаты
В этой статье
Резюме
Подход к анализу миграции эксплантированных клеток (ствол клетки нервного гребня) описывается. Этот метод является недорогим, нежный, и способны различать хемотаксис с обеих хемокинез и других воздействий на миграционный полярности, таких как полученные из межклеточных взаимодействий в рамках первичного ствола нейронной клеточной культуре гребня.
Аннотация
Neural crest cells (NCCs) are a transient population of cells present in vertebrate development that emigrate from the dorsal neural tube (NT) after undergoing an epithelial-mesenchymal transition 1,2. Following EMT, NCCs migrate large distances along stereotypic pathways until they reach their targets. NCCs differentiate into a vast array of cell types including neurons, glia, melanocytes, and chromaffin cells 1-3. The ability of NCCs to reach and recognize their proper target locations is foundational for the appropriate formation of all structures containing trunk NCC-derived components 3. Elucidating the mechanisms of guidance for trunk NCC migration has therefore been a matter of great significance. Numerous molecules have been demonstrated to guide NCC migration 4. For instance, trunk NCCs are known to be repelled by negative guidance cues such as Semaphorin, Ephrin, and Slit ligands 5-8. However, not until recently have any chemoattractants of trunk NCCs been identified 9.
Conventional in vitro approaches to studying the chemotactic behavior of adherent cells work best with immortalized, homogenously distributed cells, but are more challenging to apply to certain primary stem cell cultures that initially lack a homogenous distribution and rapidly differentiate (such as NCCs). One approach to homogenize the distribution of trunk NCCs for chemotaxis studies is to isolate trunk NCCs from primary NT explant cultures, then lift and replate them to be almost 100% confluent. However, this plating approach requires substantial amounts of time and effort to explant enough cells, is harsh, and distributes trunk NCCs in a dissimilar manner to that found in in vivo conditions.
Here, we report an in vitro approach that is able to evaluate chemotaxis and other migratory responses of trunk NCCs without requiring a homogenous cell distribution. This technique utilizes time-lapse imaging of primary, unperturbed trunk NCCs inside a modified Zigmond chamber (a standard Zigmond chamber is described elsewhere10). By exposing trunk NCCs at the periphery of the culture to a chemotactant gradient that is perpendicular to their predicted natural directionality, alterations in migratory polarity induced by the applied chemotactant gradient can be detected. This technique is inexpensive, requires the culturing of only two NT explants per replicate treatment, avoids harsh cell lifting (such as trypsinization), leaves trunk NCCs in a more similar distribution to in vivo conditions, cuts down the amount of time between explantation and experimentation (which likely reduces the risk of differentiation), and allows time-lapse evaluation of numerous migratory characteristics.
протокол
1. День 1: Изоляция магистральных труб для нейронных ночной культуры на покровных
- Инкубируйте куриных яиц в течение 56 ч при 38 ° C. Удалите яйца от инкубации, мягко распылять их с 70% этанола, а затем дайте им высохнуть. Разбейте яйца в открытой УФ-стерилизованные стеклянные панели задач.
- Извлечение каждого эмбриона от желтка и поместить его в куриных Рингера. Для этого сначала резки вокруг своей кровью островов с изогнутыми ножницами, а затем, с тупым пинцетом, выбрать эмбриона до его внеэмбриональной мембраны и поместить его в стерильные пластиковые чашки Петри с раствором куриного Рингера.
- Изолируйте ствол каждого эмбриона путем обрезки лишнюю внеэмбриональной мембран, а также черепа, блуждающего и сакральное осевых уровнях с использованием вольфрамовой иглы (рис. 1). Во-первых, выберите около 9 эмбрионов, которые находятся между стадиях HH15-17 11. Для стадии HH15 и выше, переднего и заднего мозга оси образуют острый угол и, следовательно, голова кажется, наклоните каудально. Встадии HH17, почки хвоста присутствуют и наклон снизу, но еще не содержит сомитов. С вольфрамовой иглой, обрезать внеэмбриональной мембраны около 2 мм от эмбриона и отрезать любую эмбриональных тканей кпереди от сомитов 10. Кроме того, удалите все хвостового эмбриональных тканей вокруг, начиная с пятой самой новообразованной сомитов.
- Поместите изолированные эмбриональных стволов в диспазы (0,24 ЕД / мл DMEM) и инкубировать их в течение 1 ч 15 мин при 37 ° C и 5% CO 2. Как только стволы начинаются инкубации, начать подготовку 6 покровные (CS) для культивирования эксплантов NT (шаги 1.5-1.8).
- Промыть 6 CS в 70% этанола (разводят в стерильной, сверхчистой воды), а затем дайте им высохнуть. Использование лаборатории маркер, нарисуйте круг в центре каждой базовой станции, что составляет около 1 см в диаметре (этот круг позже поможет вам определить, где фибронектина пальто была применена). В то же лицо каждого CS, написать слово "быть" (или другие асимметричные слово или форма) за пределами круга (это поможет уНУ определить, является ли отмеченный сторона CS вверх или вниз).
- Место каждого CS в отдельном 40 х 10 мм стерильную чашку с отмеченной поверхностью вниз и позволит блюдо, чтобы сидеть под открытым бактерицидные УФ-лампы в течение 10 мин.
- Применяют 60 мкл фибронектина (FN; 10 мкг / мл DMEM) в немаркированных поверхность CS, следя за всю площадь в 1 см, окружность покрытием. Поместите блюд для инкубации при температуре 37 ° C в течение 30 минут, а затем тщательно аспирации фибронектина друг от CS.
- Добавить 250 мкл «культура» среде [DMEM с L-глютамин (2 мМ), пенициллина (100U/ml), стрептомицин (100 мкг / мл), а 8% эмбриональной телячьей сыворотки (FBS)], чтобы FN-покрытием области CS. Поместите блюд, содержащих каждая CS при 37 ° C и 5% CO 2, пока НТ были изолированы.
- Передача всех инкубационных стволы эмбриона одного 5 см стекло чашки Петри содержащие L15 среднего и начать рассекает каждую NT с использованием тонких щипцов и вольфрамовой иглы (рис. 1). Carefully нарезать вдоль границы NT и сомиты с острой иглой вольфрама в то же время осторожно, чтобы не повредить NT. Часто бывает проще начать изоляции каждого NT от хвостового-самая конце ствола.
- Выберите 6 из прямой и длинный НТ к культуре ночи (НТ примерно между 8 и 15 сомитов долго рекомендуется). С помощью пипетки наконечник загрунтовать культуральной среде, передавать каждую из 6 НТ своим предварительно подготовленным CS (с шагом 1,5 через 1,8). Будьте уверены, что NT не осталось плавающих на поверхности. Если NT является плавающей, капать среды на него, пока он тонет помощью микропипетки.
- Поместите каждое блюдо при температуре 37 ° C и 5% CO 2 в течение ночи. Будьте осторожны, чтобы гарантировать, что каждая NT находится в FN-покрытием площадь его соответствующим CS непосредственно перед размещением блюдо в инкубаторе (используя круг, нарисованный в шаге 1.5, как ссылка). Микропипетки могут быть использованы для лучшего отрегулировать положение каждой NT, если необходимо.
- Место вне менее 2 мл питательной среды (без сыворотки) в стерильную пробирку для центрифугирования 15 мл и инкубируют в течение ночи при 37 ° C и 5% CO 2. Оставьте крышку слегка открутить, чтобы рН среды для регулировки ночь. Предварительное инкубирование среды имеет важное значение для предотвращения образования пузырьков в камере, которая может сорвать создание молекулярных градиентов. Такие "преинкубированы" среда должна быть использована во всех дальнейших шагов. Когда не используется, эта среда должна быть инкубации при температуре 37 ° C.
2. День 2: Загрузка камеры Изменения Zigmond и покадровой анализ миграции клеток
- Из 6 НТ культурный, выберите 3 культур лучше всего подходит для анализа. Как правило, NCC культур, которые имеют по крайней мере один длинный, прямой край должен быть выбран (рис. 2). 3 лучшие культур будет использоваться для загрузки и пленка 3 Изменения Zigmond камерах в течение дня, каждый с разным лечения. Из 3 культурах, выбрать один для Loadinг первой камеры и вернуть остальные в инкубатор для последующего использования.
- С помощью ватного тампона нанесите тонким, ровным слоем вазелина окружающих водоемов и мостов одного изменения Zigmond камеры.
- С вольфрамовой иглой, осторожно удалите NT от CS, оставляя окружающих НКС прикреплены к поверхности CS. Отметить блюдо с ручкой, чтобы помнить ориентации самый прямой край культуре NCC.
- Нанесите несколько капель преинкубированы среды на мосту. Возьмите CS с тонким пинцетом, приложите край CS против Kimwipe, чтобы удалить большинство старых культуральной среде, то сразу поместить CS на изменение Zigmond камеру так, чтобы прямые края культуры, который будет снят по центру над Длина моста и примерно перпендикулярной к мосту резервуара границы (рис. 2а, б).
- Использование инвертированного микроскопа, двигаться прямо границу NCC, чтобы быть на стороне моста ближе к гоэлектронной резервуар, который будет содержать подозреваемых chemotactant (рис. 2В, для управления этим будет соответствовать зависимости от того, резервуар загружается секунду). Кроме того, более точно выровнять линейку культуры перпендикулярно к мосту резервуара границы.
- Осторожно, но надежно нажмите CS в вазелин присутствующих на камеру Zigmond, убедившись, что она полностью изолирована на камеру, а затем поместить дополнительный вазелин по краю CS для дальнейшего обеспечения будет герметичным. Точная регулировка угла границы NCC еще раз, чтобы исправить за любые движения во время процесса герметизации.
- Загрузите резервуар, который не будет содержать подозреваемых chemotactant первого (рис. 2В). Сделайте это путем загрузки 1 мл шприц (25 G х 1,5 дюйма прилагаемой иглы) с примерно 300 мкл инкубируют среднего и вводить среды в резервуаре до полного (будьте осторожны, чтобы не генерировать пузырьки в резервуаре). Вставьте резервуар с обеих сторон SUFFicient количество вазелина до загрузки следующей водохранилища.
- Повторите шаг 2.7, кроме этого времени, используя преинкубированы среде, содержащей кандидата chemotactant. Очень важно при создании молекулярных градиент через культуру всегда загружать резервуар, содержащий молекулу быть проверены после загрузки резервуара хватает испытания молекулы.
- Поместите загруженный камеры Zigmond при 37 ° С для инкубации в течение 1 ч до съемок. Изображение самый прямой границы культуры NCC течение 3 ч при 90 с интервалом в то время как инкубации при примерно 37 ° C (рис. 2а, б). До создания любого фильма, не забудьте выровнять камеру так, чтобы края изображения, которые будут получены приведены в соответствие с и трогательно краю моста, который граничит с последним резервуаром загруженной (рис. 2В, верхняя панель; пунктирная коробка представляет идеальную положение для работы с изображениями). Это будет способствовать последующего анализа программного обеспечения, стандартизации направленности молекулярных градиент применяется и йE Расстояние от резервуара снят в каждом фильме производства.
- Для элементов управления, повторите шаги 2.2-2.9 для каждой из двух других культур NCC выбран (шаг 2,1), но заполнить каждого резервуара с соответствующей среде. Для одного вида контроля заполнения резервуаров с обеих преинкубированы среде, не содержащей молекулы должны быть проверены. Для второго контроля лечения, премьер-мост с несколькими каплями преинкубированы среде, содержащей подозреваемых chemotactant до установки CS. Затем, загрузить и резервуаров с той же среде, содержащей подозреваемых chemotactant.
- Используйте ImageJ (NIH) Руководство слежения (rsb.info.nih.gov / ц / плагины / дорожке / track.html) и хемотаксис и Migration Tool v1.01 (www.ibidi.de / Applications / ap_chemo.html) плагины для отслеживания Миграция периферической НКС по прямой границы культуры JУсть отображаемого и анализировать различные параметры миграционной траектории, полученные (рис. 2В-C).
3. Представитель Результаты:
Образец ячейки траектории из фильма, где много НКС ствола были отзывчивы к кандидату хемоаттрактанта помощью техники выше показано (рис. 2D). Большинство клеток в данном случае положительного ответа отображается чистая движение вверх хемоаттрактанта градиент (как показано на рисунке красным цветом). Траектория данные могут быть использованы для анализа других свойств клеточной миграции, а также.
Для того, чтобы визуально оценить применяется градиент изменения Zigmond камеры, Alexa Fluor 488 IgM сопряженное (MW ~ 900 кДа) была загружена во второй резервуар изменения Zigmond камеры (примерно 40 мкг / мл H 2 O). Градиент был создан 1 ч и еще несколько настоящему после 26 ч, но значительно уменьшилось на 50 ч (рис. 3). Если молекула быть проверены меньше, то прикладная градиент Wiбудем деградировать быстрее, чем то, что показано на рисунке.

Рисунок 1. Эксплантации магистрального уровня НТ в течение ночи на культивирование фибронектина покрытием покровные. Потому что ствол НКС расслаиваться от спинного NT расположены рядом с сомитов 8-28, данный сегмент NT выделяют микродиссекции и культивировали в течение ночи на покрытой фибронектином CS, чтобы обеспечить эмиграцию НКС от эксплантов NT. Изолированные НТ, которые находятся между 8-15 сомитов долго и относительно прямой лучше всего подходит для культивирования в течение ночи, поскольку они, как правило, дают NCC культур с более длинными прямыми границами. Регионы нервной трубки, которые порождают другие нейронные уровни осевого гребня показаны более мелким шрифтом. с, сомитов.

Рисунок 2. Метод оценки миграции эксплантированных НКС стволапомощью камеры изменение Zigmond. (A) Удлиненный ствол NCC культуры готовят в течение ночи культивирования НТ и, как следствие культур NCC, по крайней мере один длинный, прямой границы выбранных для эксперимента. Самая длинная прямая граница выбранной культуры, затем расположены перпендикулярно к мосту резервуара границ, и поэтому параллельно вектору будущем применять градиент. (B) после точной регулировки положения культуры NCC на Zigmond камеры и уплотнение покровное к камере, камеру загружен. При тестировании хемотаксис, резервуар, который не будет содержать подозреваемых chemotactant (-) загружена первая и опечатаны. Тогда, другой резервуар загружается с подозреваемым chemotactant (+) и запечатанный. Периферийные НКС по ранее выбранной границы могут быть отображены и отслеживается с помощью ручного отслеживания плагин для ImageJ (нижняя панель). (C) многочисленные миграционные характеристики в ответприложенного градиента может быть оценена на основе отслеживания данных. Например, индекс хемотаксис может быть получена путем деления смещения ячейки вдоль оси х на общее расстояние оно переносится. (D) пример привлекательного ответ показан сюжет ячейки траектории первоначально порожденных хемотаксиса и миграции Инструмент плагин для ImageJ. Отправной точкой для каждой траектории устанавливается на происхождение (0,0). Обратите внимание, как многие другие клетки мигрируют к центру хемоаттрактанта source.The масс всех клеток при их окончательной позиции (синий крест, все клетки одинаковый вес) также ближе к хемоаттрактанта источник. НКС, клетки нервного гребня; Красной дорожки, клеток, которые мигрировали в сторону водохранилища загружаются с подозрением на хемоаттрактанта, черный треков, клеток, которые мигрировали далеко; (+), более высокие концентрации chemotactant; (-), нижняя chemotactant концентрации.

Рисунок 3. Распределение интенсивности по мосту из камеры Изменения Zigmond в разное время после добавления Alexa Fluor 488 сопряженной IgM. камере был загружен в подобной манере, описанной в протоколе с основными исключениями, которые инкубируют воды (вместо преинкубированы среде) был использован для разбавления антител до 40 мкг / мл, и небольшие воздушные карманы присутствовали на концах моста (от среза, где выше профилей интенсивности, где принимаются). Первоначально, не градиент присутствовал на большей части моста. По состоянию на 1 га градиент был создан и остался настоящим до 26 часов. К 50 ч наличии градиента был непоследователен в разных областях мосту, и когда он присутствует, крутизна градиента значительно уменьшилось. Все профили были получены из идентичных срез через мост (мост из одного резервуара границы до другой) с помощью AxioVision 4,6 программного обеспечения. Отметим, что даже в то время как воздухкарманы присутствовали, градиент не был нарушен. Высокая, высокая интенсивность, низкая, низкая интенсивность; оси х, расстояние по всей ширине моста (2 мм); (+), резервуар загружается с Alexa Fluor 488 IgM сопряжены; (-), водохранилище не загружались с сопряженными.
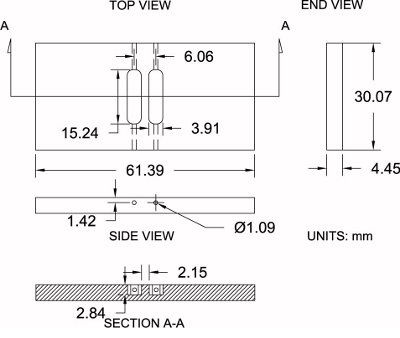
Рисунок 4. Изменение Zigmond камеры спецификаций. Показана схема модифицированного Zigmond камере используется здесь вместе со своим Габаритные размеры (± 0,2 мм). Измерения могут быть умеренно корректируется при заказе в соответствии с индивидуальными предпочтениями.
Дополнительный протокол: Изготовление изменения Zigmond палата
Пожалуйста, обратитесь к рисунку 4 в качестве справочника по протоколу ниже:
- Покупка лист 3/16 "толстый полированный акриловый (4,45 мм фактической толщины).
- Используя таблицу увидел, вырезать заготовки камере негабаритных кгрубые размеры 33,25 х 64,57 мм мм. Это позволяет 3,175 мм дополнительный материал для обработки.
- Установите камеру пустой на тиски. С фрезерный станок и 6,35 мм (1/4 ") немного фрезы, чистовую обработку стороны камеры, чтобы их точные размеры: 30,07 мм х 61,39 мм.
- Установите камеру пустую на фрезерном станке и найдите в центре пустого вдоль обеих осей х и у с краю поиска, а затем нулю центре города.
- Приобретать камеры высоте (оси), касаясь немного концевой фрезы на верхней поверхности и нулевой высоте.
- Использование 3,91 мм (0,154 ") немного фрезы, смещение немного 3,03 мм вдоль оси х (положительное направление) для первого резервуара. Начать обработку в камеру на глубине до 2,84 мм при перемещении вдоль оси у (положительное направление) до 7,62 мм (0,300 "), а затем пройти до 7,62 мм (0,300") в противоположном (отрицательном) направлении до полного резервуара длина 15,24 мм (0,600 "). Смещениенемного до 3,03 мм (0,119 ") вдоль оси х (отрицательное направление) и повторите ту же процедуру для второго резервуара.
- Установите камеру на ее краю и просверлить отверстие с помощью 1,09 мм (0,043 дюйма) сверлом на конце каждого резервуара (4 общего числа), который соединяется конце резервуара в сторону камеры для загрузки среды в процессе экспериментов.
- Замочите камеры и в теплой мыльной воде, чтобы помочь устранить любые химические загрязняющие вещества.
- Замочить и промыть камеру и в дважды дистиллированной воде, чтобы удалить мыло. Камеры готов к работе, как описано выше.
Обсуждение
Проведение исследования хемотаксиса на магистральных НКС оказалось сложным для ряда причин. Магистральные НКС представляют собой гетерогенную популяцию стволовых клеток, что будет отличать, если культурный долгосрочные, поэтому ствол НКС должно быть получено от первичного эксплант...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы даем особую благодарность Lino Ким, Стив Гусман и Ujit Satyarthi для оказания технической помощи в ходе разработки этого метода. Мирон Hawthorne, Ричард Spengel, и Роберто Рохас обрабатывается камеры, используемые здесь, и при условии, столь необходимую техническую помощь. Примечательно, что Роберто Рохас производится Рисунок 4. Мы также благодарны за ценные советы Скотт Фрейзер до развития выше анализ хемотаксиса. Эта работа была частично поддержана NIH-МУРЗ SCORE-5S06GM048680-13, Медб и награды от ХСС, Northridge Graduate Program Support Диссертация на CW.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (по желанию) |
| DMEM | Omega Научные | DM-22 | |
| Пенициллина стрептомицин решение | Omega Научные | PS-20 | Концентрация 100X со |
| L-Глютамин | Omega Научные | GS-60 | Концентрация 100X со |
| Плод бычьего сывороточного | Omega Научные | FB-11 | Лот № 105247 (или другое, что сопоставимо) |
| Измененный Zigmond камеры | Домашняя | N / A | Объем резервуара: ~ 160 мкл шт; дополнительные характеристики, см. рис. 4 и дополнительного протокола изготовления |
| Блюдо клеточной культуры | Denville | T6040 | 40 х 10 мм |
| Фибронектин | BD | 354008 | 10X со нацелен путем разбавления 1 мг FN в 1 мл H 2 O и 9 мл DMEM |
| Покровные | Рыбак | 12-548-B | Предварительно очищенные, 22 х 22 мм |
| L15 среде | Thermo Scientific | SH30525.02 | |
| Вазелин | Утешает | 011110794642 | 100% |
| Центрифуги трубы | Biologix | 10-9152 | 15 мл |
| Диспазы | Сотовые Системы | 4Z0-850 | Концентрация 10X со |
| Шприц | BD | 309602 | 1 мл |
| Игла | BD | 305127 | 25 G х 1,5 дюйма |
| Alexa Fluor 488-IgM | Яnvitrogen | A21042 | Со 2 мг / мл; 7 моль красителя / моль IgM |
| Препаровальный пинцет | FST | Разный | Дюмон № 5 или 55; прямой наконечником, нержавеющей стали или титана |
| Вольфрамовой иглы | N / A | N / A | Домашние; помещается в контактный держатель |
| Blunt щипцы | Tiemann | 160-18 | Используется для передачи эмбрионов Рингера из яичного желтка |
Дополнительный протокол: Изготовление изменения Zigmond палата
Пожалуйста, обратитесь к рисунку 4 в качестве справочника по протоколу ниже:
- Покупка лист 3/16 "толстый полированный акриловый (4,45 мм фактической толщины).
- Используя таблицу увидел, вырезать заготовки камере негабаритных к грубой размеры 33,25 мм х 64,57 мм. Это позволяет 3,175 мм дополнительный материал для обработки.
- Установите камеру пустой на VIЮ-В. С фрезерный станок и 6,35 мм (1/4 ") немного фрезы, чистовую обработку стороны камеры, чтобы их точные размеры: 30,07 мм х 61,39 мм.
- Установите камеру пустую на фрезерном станке и найдите в центре пустого вдоль обеих осей х и у с краю поиска, а затем нулю центре города.
- Приобретать камеры высоте (оси), касаясь немного концевой фрезы на верхней поверхности и нулевой высоте.
- Использование 3,91 мм (0,154 ") немного фрезы, смещение немного 3,03 мм вдоль оси х (положительное направление) для первого резервуара. Начать обработку в камеру на глубину 2,84 мм при перемещении вдоль оси у ( Положительное направление) до 7,62 мм (0,300 "), а затем пройти до 7,62 мм (0,300") в противоположном (отрицательном) направлении до полной длины резервуара 15,24 мм (0,600 "). Смещение немного до 3,03 мм (0,119 ") вдоль оси х (отрицательное направление) и повторите ту же процедуру для второго резервуара.
- Установите камеру на его краюи просверлить отверстие с помощью 1,09 мм (0,043 дюйма) сверлом на конце каждого резервуара (4 общего числа), который соединяется конце резервуара в сторону камеры для загрузки среды в процессе экспериментов.
- Замочите камеры и в теплой мыльной воде, чтобы помочь устранить любые химические загрязняющие вещества.
- Замочить и промыть камеру и в дважды дистиллированной воде, чтобы удалить мыло. Камеры готов к работе, как описано выше.
Ссылки
- Le Douarin, N. M. The avian embryo as a model to study the development of the neural crest: a long and still ongoing story. Mechanisms of Development. 121, 1089-1102 (2004).
- Baker, C. V. . Neural Crest and Cranial Ectodermal Placodes. , (2005).
- Gammill, L. S., Roffers-Agarwal, J. Division of labor during trunk neural crest development. Dev. Biol. 344, 555-565 (2010).
- Kulesa, P. M., Gammill, L. S. Neural crest migration: patterns, phases and signals. Dev. Biol. 344, 566-568 (2010).
- Wang, H. U., Anderson, D. J. Eph family transmembrane ligands can mediate repulsive guidance of trunk neural crest migration and motor axon outgrowth. Neuron. 18, 383-396 (1997).
- Krull, C. E. Interactions of Eph-related receptors and ligands confer rostrocaudal pattern to trunk neural crest migration. Curr. Biol. 7, 571-580 (1997).
- Gammill, L. S., Gonzalez, C., Gu, C., Bronner-Fraser, M. Guidance of trunk neural crest migration requires neuropilin 2/semaphorin 3F signaling. Development, Cambridge, England. , 133-199 (2006).
- De Bellard, M. E., Rao, Y., Bronner-Fraser, M. Dual function of Slit2 in repulsion and enhanced migration of trunk, but not vagal, neural crest cells. The Journal of cell biology. 162, 269-279 (2003).
- Kasemeier-Kulesa, J. C., McLennan, R., Romine, M. H., Kulesa, P. M., Lefcort, F. CXCR4 controls ventral migration of sympathetic precursor cells. J. Neurosci. 30, 13078-13088 (2010).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. The Journal of Cell Biology. 75, 606-616 (1977).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chicken embryo. J. Morph. 88, 49-52 (1951).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Davis, E. M., Trinkaus, J. P. Significance of cell-to cell contacts for the directional movement of neural crest cells within a hydrated collagen lattice. Journal of Embryology and Experimental Morphology. 63, 29-51 (1981).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. Journal of Cell Science. 99, 769-775 (1991).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены