Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Органотипической культур Кусочек Эмбриональные Брюшной мозга: системы по изучению дофаминергической нейронов развития В пробирке
В этой статье
Резюме
Метод для создания органотипической ломтики из мышиных эмбриональных E12.5 мозга описывается. Органотипической культур срез может быть использован для наблюдения поведения дофаминергических нейронов вентральной или других нейронов мозга.
Аннотация
Мышь отличная модель организма для изучения развития млекопитающих мозг из-за обилия молекулярных и генетических данных. Тем не менее, развивается мозг мыши не подходит для легкого манипулирования и обработки изображений в естественных условиях, поскольку мышь эмбрион недоступной и непрозрачной. Органотипической культур кусочек эмбрионального мозга, таким образом, широко используются для изучения мышиной развития мозга в лабораторных условиях. Экс-живом манипуляций или использования трансгенных мышей позволяет изменение экспрессии генов, так что субпопуляции нейронов или глиальных клеток могут быть помечены флуоресцентным белкам. Поведение меченых клеток можно наблюдать использованием замедленной съемки. Покадровый изображений был особенно успешным для изучения ячейки поведения, которые лежат в основе развития коры головного мозга на поздних эмбриональных стадий 1-2. Эмбриональные органотипической срез культуры системами в областях мозга, вне переднего мозга в меньшей степени establisHed. Таким образом, богатство покадровой визуализации данных описывающих миграцию нейронов ячейке ограничен переднего мозга 3,4. До сих пор не известно, будь то принципы открыл для спинного мозга справедливы для вентральной области мозга. В вентральной мозга, нейроны организованы в кластеры нейронов, а не слои и им часто приходится проходить сложные миграционные траектории, чтобы достигнуть их окончательной позиции. Вентрального среднего мозга является не только хорошей модельной системой для вентральной развития мозга, а также содержит нейронные популяции, такие как дофаминергических нейронов, которые имеют отношение в болезненные процессы. Хотя функции и дегенерации дофаминергических нейронов были исследованы очень подробно в взрослых и старение мозга, мало известно о поведении этих нейронов во время их дифференциации и миграции фазы 5. Мы описываем здесь поколения срез культуры от эмбриональных день (E) 12,5 мыши вентрального среднего мозга. Эти ломтик культаUres которые потенциально пригодны для мониторинга развития дофаминергических нейронов в течение нескольких дней в лабораторных условиях. Мы отмечаем важные шаги в формировании мозга срезов на этих ранних стадиях эмбрионального развития и обсудить условия, необходимые для поддержания нормального развития дофаминергических нейронов в пробирке. Мы также представим результаты экспериментов промежуток времени визуализации. В этих экспериментах вентральной прекурсоров мозга (в том числе дофаминергических прекурсоров) и их потомки были названы в мозаике способом, используя Cre / loxP основан индуцибельной судьбу системы картографирования 6.
протокол
Части этого протокола являются модификациями Daza и соавт., 2007 7.
1. Подготовка
- Может быть подготовлен за один день
- Подготовка 1X Кребса буфера (1,5 л): 126 мМ NaCl, 2,5 мМ KCl, 1,2 мМ NaH 2 PO 4: H 2 O, 1,2 мМ MgCl 2, 2,5 мМ CaCl 2, 11 мМ глюкозы, 25 мМ NaHCO 3; регулировать рН до 7,4. Фильтр стерилизуют (0,22 мкм, размер пор) и хранить при температуре 4 ° C.
- Подготовка питательной среды (20 мл): 5 мл HBSS, 9 мл DMEM высокий уровень глюкозы, 850 мкл 30% глюкозы, 5 мл лошадиной сыворотки (25%). Добавить 200 мкл 100X Penicllin / стрептомицин. Хранить при температуре 4 ° С.
- Подготовка перед началом вскрытия
- Подготовка 100 мл 4% низкой температурой плавления агарозы (LMP агарозы) в 1X Кребса буфера: микроволновая раствора до агарозном полностью не растворится, а затем поместить в агарозном 45 ° С водяной бане.
- Заполнение колебанийтом буфера поднос с ледяного буфера 1X Кребса и начать охлаждающий элемент (держать при температуре 4 ° С). Fix лезвие в лезвие перевозчика и настройки vibratome области с помощью скальпеля, тонкой кистью и мини перфорированной ложкой, чтобы забрать ломтиками. Подготовка стерильные чашки Петри (35 х 10 мм) с буфером 1x Кребса для сбора ломтиками. Держите на льду.
- Настройка диссекция области с стерильные чашки Петри (100 х 15 мм) для вскрытия и меньше стерильные чашки Петри (35 х 10 мм) для встраивания, маленькие ножницы, два прекрасных щипцы (Дюмон 5), мини перфорированной ложкой, стекло пипетки Пастера огнем полированные с круглым наконечником и закрыты 1 л буфера 1X Кребса на льду. Протрите все инструменты вскрытия с 70% этанола.
- Добавить питательной среды для скважин шестью лунками (1,5 мл / лунку) и поместить его в 37 ° C инкубатора.
- Подготовка шесть-луночного планшета с 1,5 мл / лунку стерильного 1X Кребса буфера и 15 мкл Penicilin / Стрептомицин (100X) / а. В стерильных условиях, место Миляlicell культуре клеток вставляет в скважинах. Место шестью лунками рядом с vibratome так, что мозг ломтиками могут быть переданы на фильтр мембраны сразу же после перерезки.
2. Разбор и вложение эмбрионального мозга
- Анестезию беременной женщины мыши, используя изофлуран и жертвы мыши цервикальным сдвигом (эмбрионы должны быть на стадии E12.5). Рассеките из матку мышей, потянув вверх матки щипцами. Используйте другие щипцы для разделения mesometrium от матки. Место матки в ледяной буфера 1X Кребса. Использование тонких щипцов для разделения мышечной стенки матки, мембранные Reichert и висцерального желточного мешка из эмбриона. Удалить эмбрионов из матки. Место расчлененный эмбрионов в отдельной чашке Петри стерильной 1X Кребса буфера.
- Рассеките мозга под стереомикроскопа. Чтобы вскрыть мозг, во-первых отрезать голову эмбриона. Fix головы, прокалывая тонкой щипцов через голову (на уровне глаз). Используйте другую пару щипцов осторожно удалите кожу и череп. Используйте пинцет, чтобы осторожно поднимите мозга, и передать его в чашке Петри стерильной 1X Кребса буфера. Очень важно, что целостность весь мозг сохраняется во время вскрытия, так как повреждения мозговой ткани создаст проблемы (например, ткани измельчения) во время секционирования на vibratome.
- Мойте мозги раз в 4% низкой температурой плавления (LMP) агарозы. Добавить 2-3 мозги в то время, в пресной 4% LMP агарозы. Место вложение блюд на льду как можно ровнее. Используйте пипетку Пастера с огневой полировкой круглым наконечником снять мозги, пока в нижней части агарозном затвердевает. Мозг должен располагаться в квартире положение горизонтальное на дно блока агарозы.
- После агарозном полностью затвердевшего (примерно через 3 мин), обрезка агарозном окружающие мозг и клея блок агарозы на образец этапеиз vibratome. При склеивании блоков, убедитесь, что брюшная сторона мозга параллельно платформе, так как мозги должны быть сокращены в горизонтальной плоскости сечения.
3. Vibratome секционирования
- Используйте лезвие для секционирования. Для получения нетронутыми ломтиками очень важно для поддержания температуры на 4 ° С в течение секционирования.
- Раздел 300 мкм горизонтальных срезов на частоте 50 Гц, лезвие амплитуда 1,1 мм и скоростью 25 мм / сек.
- Использование тонкой кистью нажать ломтик в мини перфорированной ложкой собрать мозги ломтиками и передачи их в блюдо с стерильных ледяного буфера 1X Кребса. Выберите часть, которая содержит вентральной ткани среднего мозга (см. Рисунок 1). В E12.5 мозга мыши есть только один 300 мкм горизонтальный срез, который содержит вентральной ткани мозга в том числе дофаминергических нейронов.
4. Фрагмент культуры
Шаги 4.2-4.5 должны осуществляться в стерильных условиях.
- Передача мозга ломтики на культуру Millicell клеточной мембраны вставки в шесть-луночного планшета с 1x Кребса буфере (см. пункт 1.2.5). Чтобы передать часть использовать мини перфорированной ложкой (Fine Инструменты наук) и штраф в кисти. До 3 ломтика могут быть размещены на одной мембраной.
- Передача мембраны с ломтиком к шести-и пластины с питательной среде (см. пункт 1.2.5). В верхней части мембраны не должны покрываться за счет среды. Мозг получает средний срез снизу и воздух сверху.
- Место шестью лунками в инкубаторе с 5% CO 2 при 37 ° C. Это очень важно, чтобы ломтики размещаются в инкубаторе в течение 2 часов после первоначального этапа рассечение. Более протяженных время приготовления может привести к снижению выживания ломтиками.
- Ломтики можно поддерживать в пробирке до 3-х дней. Изменение 50% культуральной среде на 2-й день.
5. Покадровый изображений
- Пусть ломтиками восстановиться в инкубаторе в течение 4-5 часов, прежде чем начать покадровой съемки.
- Для покадровой обработки изображений, сохранить ломтики на мембране вставки и передачи вставить в 35 мм Ibidi μ-блюдо (нижней блюдо состоит из материала с высоким оптическим качеством).
- Добавить 1 мл культуральной среды плюс 1,5 мкл аскорбиновой кислоты (200 мм), чтобы блюдо. Аскорбиновая кислота защищает ломтиками против фототоксичности.
- Инкубируйте ломтики в экологической камере при температуре 37 ° C с 5% СО2 во время замедленной съемки.
6. Представитель Результаты
Рисунок 1 иллюстрирует получение органотипической культур ломтик от E12.5 мозга мыши. На рисунке 2 показан горизонтальной органотипической ломтиками (острый и через несколько дней в культуре), полученные форма E12.5 мозга мыши. Для сравнения, замороженных срезах мозга при эквивалентной стадии развитияпоказаны. Дофаминергических нейронов мозга визуализируются с иммуногистохимии для тирозингидроксилазы (TH). Среднего мозга дофаминергических нейронов проекта целям в переднем мозге. Эти прогнозы начинают формироваться на E12.5 и расширять в направлении переднего мозга в течение последующих дней. Мы рассматриваем развитие переднего мозга прогнозы, как хороший признак для нормального развития дофаминергических нейронов в культуре. В горизонтальных ломтиков мозга дофаминергических нейронов расширить прогнозы по отношению к их надлежащей целевой области переднего мозга. После 3 DIV (дней в пробирке), или когда области переднего мозга целевой повреждены, аберрантных прогнозы распространяются в направлении спинного мозга. Примеры корональных ломтиками E12.5 мозга показаны на Рисунке 3. Дофаминергических нейронов визуализированы с иммуногистохимическое TH расширить аберрантных проекции спинного мозга. Рисунок 4 показывает анализ пролиферирующих, некротических и апоптоза клеток в культурах органотипической срез. BrdU имmunostaining визуализировать пролиферирующих клеток показывает, что клетки размножаются в условиях культивирования после 1 DIV. Распространение уменьшается после 4 DIV. После 3 DIV, многие клетки в брюшной средний мозг подвергается некрозу (пропидий йодида окрашивание) и apotosis (иммуногистохимическое расщепляется каспазы-3). На рисунке 5 показано миграционных путей YFP меченных нейронов контролируется в покадровой визуализации эксперимента в острый срез .
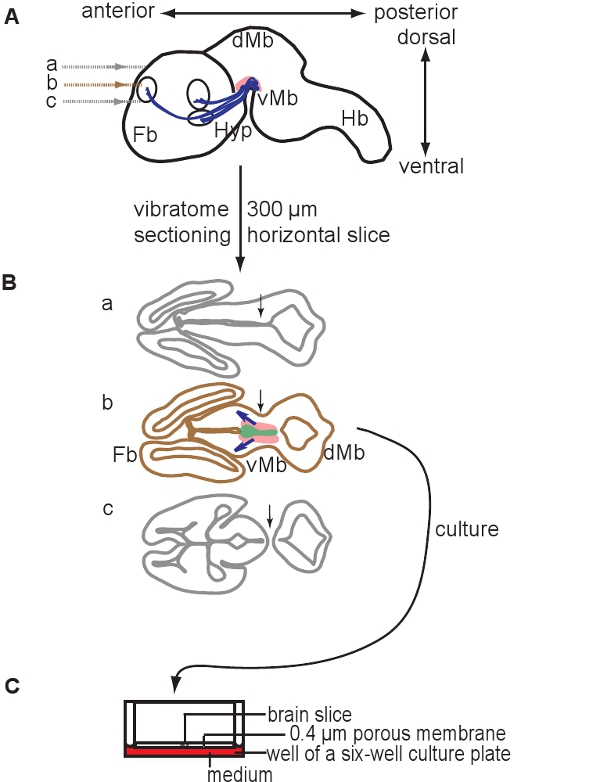
Рисунок 1. Схема иллюстрирующая подготовки органотипической культур срез. 300 мкм горизонтальных срезов мозга готовятся секционирования E12.5 мозга с помощью vibratome. (А) Схема сагиттальной зрения E12.5 мозга мыши. Уровни разделов указаны. Область, содержащую дофаминергических нейронов изображена в розовом, прогнозы, указанные в синий цвет. (B) Схемы из трех ломтиков, которые могут быть получены от спины к брюху и тхат содержать как переднего мозга (Fb) и среднем мозге (Мб). Отметим, что только один ломтик содержит дофаминергических нейронов (часть б). Соответствующий срез может быть идентифицирован на основе положения желудочков и преемственность среднего и переднего мозга ткани (стрелки, сравнить раздел с разделом б и в). Область, содержащую дофаминергических нейронов указывается в розовом, область, содержащую дофаминергических прекурсоров изображен в зеленом, синем стрелки указывают развивающихся прогнозы. (C) ломтик содержащих дофаминергических нейронов выращиваются на мембранных вставками. Сокращения: VMB, вентральный мозга; DMB, спинного мозга; Hyp, гипоталамус, Hb, задний мозг.
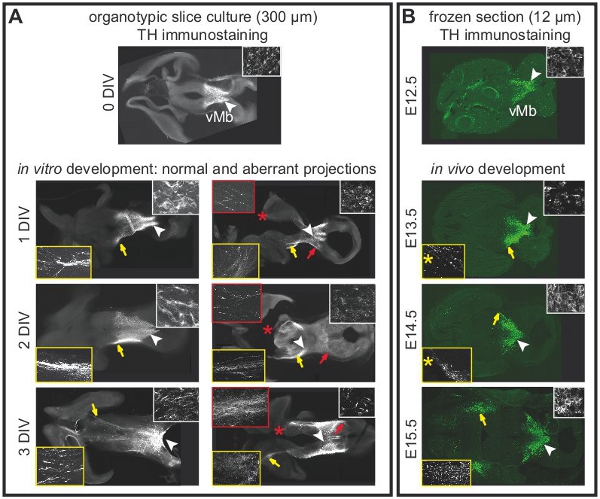
Рисунок 2. Проекции среднего мозга дофаминергических нейронов в культурах органотипической срез, зависит от целостности переднего мозга. Immunohistochemistry для тирозингидроксилазы (TH) для обозначения дофаминергических нейронов. (А) острый срез (0 DIV)показывает нормальное расположение дофаминергических нейронов в вентральной мозга. Белая стрелка указывает на область, которая показана на большем увеличении на вставке. Прогнозы на передний мозг еще не разработали. После 1 DIV, прогнозы для переднего мозга начинают формироваться. Прогнозы простираются в передний мозг на 2-3 DIV. Белые стрелки показывают расположение клеточных тел показано на большем увеличении на вставках (белый кадр). Желтыми стрелками выделить нормальные прогнозы в интактных ломтиками показано на большем увеличении на вставках (желтой рамкой). Aberrant прогнозы развиваться в срезах с повреждением переднего мозга. Красные стрелки указывают аберрантных проекции спинного мозга показано на большем увеличении на вставках (красная рамка). Ущерб обозначается красными звездочками. После 3 DIV, большинство ломтиками (п = 5 / 7) было аберрантных прогнозы на спинном мозге. (B) TH иммуноокрашивания на горизонтальных замороженных срезов мозга на разных стадиях развития, чтобы показать развитиедофаминергических прогнозы в естественных условиях. Белые стрелки показывают расположение клеточных тел показано на большем увеличении на вставках (белый кадр). Желтыми стрелками выделите позицию проекций показана на большем увеличении на вставках (желтой рамкой). Уровне замороженных срезах был выбран, чтобы точно соответствовать уровню органотипической культур срез. Обратите внимание, что одним замороженных срезах (12 мкм) не представляют весь срез органотипической (300 мкм). Таким образом, прогнозы показаны на E13.5 и E14.5 наблюдались на участках 120 мкм больше, чем вентральная раздел, содержащий клеточных тел (желтые звездочки).
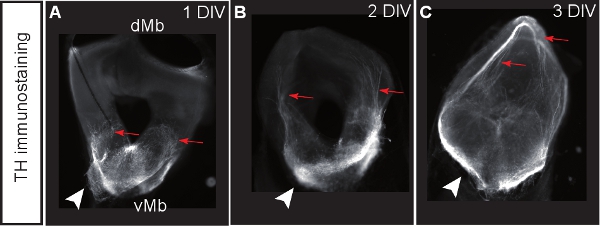
Рисунок 3. Мозга корональных культур срез окрашивали тирозингидроксилазы (TH) в качестве маркера для дофаминергических нейронов. (AC) Ломтики после DIV 1, 2 или 3. Дофаминергических нейронов развивать аберрантных прогнозы на спинном мозге (гред стрелки). Стрелки показывают расположение органов дофаминергических клеток.
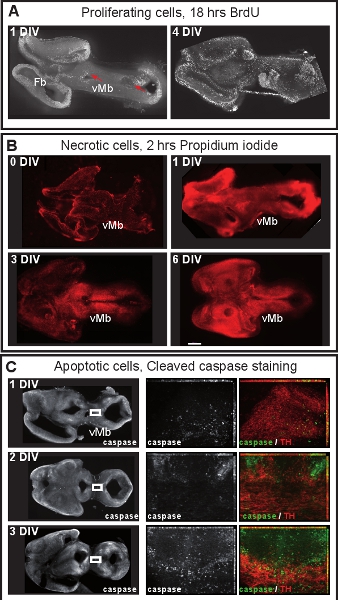
Рисунок 4. Клеточную пролиферацию и жизнеспособность клеток в мозге органотипической культур срез. (А) пролиферирующие клетки были помечены путем добавления BrdU (50 нг / мл, Sigma) в питательной среде в течение 18 ч. Фрагменты были впоследствии immunostained для BrdU. После 1 DIV, BrdU меченые клетки расположены в желудочковой зоны (красные стрелки). После 4 DIV, пролиферирующие клетки более рассеяны и различные зоны желудочков больше не поддерживается. (B) отмершие клетки были помечены добавлением йодида пропидий (1μg/μL, Sigma) в культуральной среде в течение 2 часов и визуализируется флуоресцентной микроскопии. После 1 DIV, вентральный среднего мозга (VMB) не некротических, но многие пропидий йодида меченых клеток можно увидеть в спинном мозге и переднего мозга. После 3 DIV жизнеспособность клеток уменьшается в вентральной midbraдюйм Шкала бар: 500 мкм (C) Immunostaing для расщепляется каспазы-3 для визуализации апоптоза клеток. На 1 или 2 DIV, всего в нескольких дофаминергических нейронов (TH) являются апоптоза. После 3 DIV, дофаминергические нейроны начинают подвергаются апоптозу. Панели в середине и справа выше, увеличением в коробках области, в левой панели. Выше увеличениях изображения максимально прогнозы интенсивности Z-стеки из 14-16 кадров. Изображения были взяты каждые 0,5 мкм с Apotome Zeiss настройки.
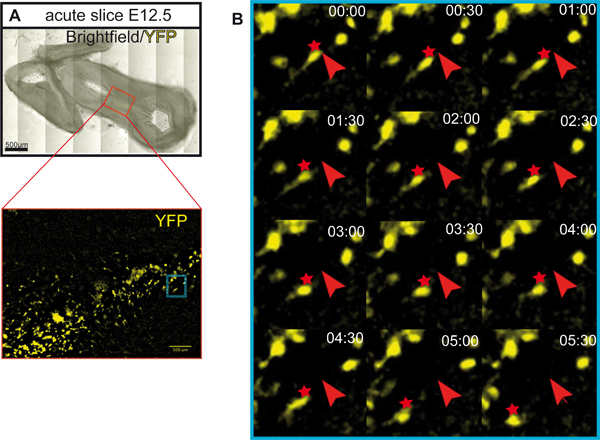
Рисунок 5. Мигрирующих маршрут YFP меченных нейронов в острый срез. () Горизонтальная часть используется для промежуток времени визуализации YFP меченных нейронов. Срез инкубировали в течение 5 часов до съемки. Клетки были помечены использованием индуцибельной Cre / loxP системы 6. Тсс CreER мышей 8 и РОСА loxP-СТОП-loxP-EYFP репортер мышей 9 мыповторно использоваться. Рекомбинации аллелей РОСА репортер (и EYFP выражение) в клетках, которые выражают CreER (Тсс-экспрессирующие клетки), но только при введении Тамоксифен (Sigma). В этом примере, Тамоксифен (3 mg/40 г веса тела) вводили беременным мышам в E8.5. Это экспериментальная установка результатов прежде всего в маркировке прекурсоров дофаминергических нейронов и их потомков в вентральной мозга 10,11. Шкала бар: 500 мкм. (B) Трассировка маршрута миграции YFP меченных нейронов в острой срез. Покадровый образы YFP меченных судьба отображается нейроны были приобретены через каждые 30 мин в течение всего времени 5 часов 30 минут на Zeiss Axio-Observer микроскоп (цель ЕС PlnN 10x / 0,3). Ломтики инкубировали в экологической палаты (инкубатор XLS1 Pecon) при 37 ° C и поставляются с 5% CO 2 во время визуализации. Начальное положение клетки отмечена красными стрелками, миграция позиции отмечены красными звездочками.
Обсуждение
Органотипической метод культуры часть представленных здесь обеспечивает систему для краткосрочных в пробирке анализ развития дофаминергических нейронов и их миграционные маршруты и проекции в эмбриональном вентрального среднего мозга. Мы обнаружили, что Есть ряд важных шагов ...
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Мы благодарим Мартина Emond и Изабель Брахман за помощь в создании системы органотипической культуры нарезать и Вольфганг Хюбнер и Ливиу Габриэль Bodea за критическое прочтение рукописи. Мы хотели бы поблагодарить Фрэнка Costantini для R26 репортер мышей и Клифф Табин для Тсс мышей CreER. Это исследование было профинансировано исследований премию от Министерства науки и исследований земли Северный Рейн-Вестфалия (Программа цур Förderung дер Rückkehr де wissenschaftlichen Spitzennachwuchses AUS DEM Ausland).
Материалы
Таблица специфических реагентов и оборудования
| Название реагента | Компания | Номер по каталогу | Комментарии (необязательно) |
|---|---|---|---|
| DMEM | Sigma-Aldrich | D6429 | |
| Глюкоза 30% | Sigma-Aldrich | G7528-250 | |
| Лошадиная сыворотка | Invitrogen | 26050-088 | |
| DMEM (4,5 г / л Glc., С L-Gln, Na Pyr, NaHCO3) | Sigma-Aldrich | D6429-500 | |
| Пенициллина / стрептомицина 100x | Sigma-Aldrich | P4333-20 | |
| L-аскорбиновая кислота | Sigma-Aldrich | A4403 | подготовить 200 мМ акции и хранить при -20 ° C |
| Сверхчистых LMP агарозном | Invitrogen | 15517-022 | |
| Millicel вставками | Millipore | PICMORG50 | |
| μ-блюдо 35 мм, низкая | Ibidi | 80136 | |
| Vibratome | Microm | HM 650V | |
| Бритва | Плано GmbH | 121-6 | |
| Histoacryl клей | BRAU9381104 | Браун Aesculap | |
| Перфорированные Dia Ложка диаметром 15 мм | Инструменты изобразительных наук | 10370 -18 | |
| Пинцет 5 Dumoxel | Инструменты изобразительных наук | 11252 - 30 |
Антитела используются для immunostainings:
| Название антитела | Компания | Номер по каталогу | Комментарии (необязательно) |
| Кролик против тирозингидроксилазы | Millipore | AB152 | Разведение 1:500 |
| Мышь против тирозингидроксилазы | Millipore | MAB318 | Разведение 1:500 |
| Мышь анти-BrdU | BD Pharmingen | 555627 | Разведение 1:200 |
| Кролик против расщепляется каспазы 3 | Сотовые технологии передачи сигналов | 9661 | Разведение 1:200 |
| Осел анти-IgG кролика-Alexa 488 | Invitrogen | A21206 | Разведение 1:500 |
| Осел анти-мышиных IgG-Cy3 | Джексон ImmunoResearch | 715-165-150 | Разведение 1:200 |
Ссылки
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L., Kriegstein, A. R. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nat. Neurosci. 7 (2), 136-136 (2004).
- Martini, F. J. Biased selection of leading process branches mediates chemotaxis during tangential neuronal migration. Development. 136 (1), 41-41 (2009).
- Marin, O., Valiente, M., Ge, X., Tsai, L. H. Guiding neuronal cell migrations. Cold Spring Harb. Perspect. Biol. 2 (2), a001834-a001834 (2010).
- Ayala, R., Shu, T., Tsai, L. H. Trekking across the brain: the journey of neuronal migration. Cell. 128 (1), 29-29 (2007).
- Smidt, M. P., Burbach, J. P. How to make a mesodiencephalic dopaminergic neuron. Nat. Rev. Neurosci. 8 (1), 21-21 (2007).
- Legue, E., Joyner, A. L. Genetic fate mapping using site-specific recombinases. Methods. Enzymol. 477, 153-153 (2010).
- Daza, R. A., Englund, C., Hevner, R. F. Organotypic slice culture of embryonic brain tissue. CSH Protoc. , (2007).
- Harfe, B. D. Evidence for an expansion-based temporal Shh gradient in specifying vertebrate digit identities. Cell. 118 (4), 517-517 (2004).
- Srinivas, S. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Dev. Biol. 1, 4-4 (2001).
- Joksimovic, M. Spatiotemporally separable Shh domains in the midbrain define distinct dopaminergic progenitor pools. Proc. Natl. Acad. Sci. U. S. A. 106 (45), 19185-19185 (2009).
- Blaess, S. Temporal-spatial changes in Sonic Hedgehog expression and signaling reveal different potentials of ventral mesencephalic progenitors to populate distinct ventral midbrain nuclei. Neural. Dev. 6 (1), 29-29 (2011).
- Hippenmeyer, S. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biol. 3 (5), e159-e159 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены