Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Использование Доступное Светодиодные массивы для фото-стимуляция нейронов
В этой статье
Резюме
Взрослый родившихся нейронов выражения ChR2 можно манипулировать в ломтик электрофизиологических подготовку для того, чтобы изучить их вклад в функцию обонятельных нейронных цепей.
Аннотация
Стандартный электрофизиологии срез позволил исследователям зонда отдельных компонентов нервной системы путем записи электрических ответов одиночных клеток в ответ на электрические или фармакологических 1,2 манипуляций. С изобретением методов оптического контроля генетически целевых нейронов (optogenetics), исследователи теперь имеют беспрецедентный уровень контроля над конкретными группами нейронов в стандартной подготовки срез. В частности, светочувствительной channelrhodopsin-2 (ChR2) позволяет исследователям для активации нейронов с 3,4 свет. Объединив осторожны калибровки светодиодных фотостимуляцией ChR2 со стандартными электрофизиологии ломтик, мы в состоянии зонд с более подробно роль взрослого родился интернейронов в обонятельной луковице, первый центральный реле обонятельной системы. Использование вирусного выражение ChR2-YFP специально у взрослых родившихся нейронов, мы можем выборочно контролировать молодых взрослых родился нейронов в среде старыхг зрелых нейронов. Наши оптические управления использует простые и недорогие светодиодные системы, и мы покажем, как эта система может быть откалиброван, чтобы понять, сколько света необходимо, чтобы вызвать пики активности в отдельных нейронов. Таким образом, короткие вспышки голубого света могут удаленно контролировать стрельбу структуры ChR2-трансдуцированных новорожденных клеток.
протокол
1. Оптический калибровки: измерение LED Power
- Прикрепить светодиодов на радиатор с активным охлаждением с помощью вентилятора и закрепить этот светодиод / радиатор aparatus к коллимирующей линзы.
- Замените лампы, используемые в светлое освещение с LED / радиатор / вентилятор / объектив аппарата. Этот аппарат должен быть тщательно расположены так, чтобы коллимированный светодиодный луч движется по прямой оптический путь к конденсатора линзы. Убедитесь, что радиатор / вентилятор заземлена на массу системы.
- Диск светодиодов с источником питания, который может дать быстрый и прямоугольных импульсов тока. Этот блок питания может управляться 5V TTL импульса, происходящих из генератора импульсов.
- Центр коллимированного пучка вдоль пути света определяются между диафрагмой поля и конденсатор линзы. В идеале, светодиодный луч немного переполнения полностью открыт полевой диафрагмой. Как правило, более плотно коллимированного светодиодных луча заполнить это отверстие меньше, и будет производить морэлектронной власти за счет однородности. В нашей установке мы увеличили свет единообразия, выбрав коллимирующей линзы, что прогнозируемые слегка расширены образ светодиодов на ее сопряженная плоскость в consenser диафрагмы.
- Достижение Колер освещения, сосредоточив внимание конденсатора так, чтобы образ полевой диафрагмы (диафрагма ближе всего к источнику света) ориентирована на срез камеры (рис. 1). Тонкая ткань линзы бумаги могут выступать в качестве проекционного экрана для визуализации сфокусированного изображения полевой диафрагмы на других глубинах.
- Дрель серии отверстий известного диаметра в непрозрачный материал. Разместите один из этих маленьких отверстий по датчик оптической мощности-метра. Место измеритель мощности на сцене и в центре образца измерителя мощности более сфокусированного изображения полевой диафрагмы, просто перемещая измеритель мощности, пока она дает максимальное показание. Прикрепите измеритель мощности в этом положении.
- Полностью открыть все отверстия (диафрагмы и aperatureполевой диафрагмы). Систематически двигаться прилагается часть камеры / измеритель мощности по отношению к оптической оптический путь и рассчитать равномерность оптической мощности в освещенную зону. Сборка единообразия сюжет для вашей системы. Если микроскоп правильность установки с подсветкой Келера с центром в фокусе цель; максимальная мощность должна быть непосредственно под цели и регионов за пределами этого внимание должно теперь получают известное количество энергии в соответствии с однородностью сюжет.
- Для каждого размера отверстия, построить стандартную кривую оптической мощности от области обскуры поверхности. Регулируя входного тока для светодиодов, производство этой кривой при различных уровнях мощности, а с каждой кривой расчета мощности на мм2. Если светодиод массив, который будет использоваться для ямочного ремонта оптики, убедитесь, что введение оптических элементов, необходимых для ямочного ремонта (конденсаторы, проколов и фильтры), чтобы знать, сколько света передается под исправления освещения.
- Подавать измеритель мощности дляЛицо цель, рассчитать интенсивность освещения на 470nm, когда ртутная лампа включена.
- Добавить живой срез на камеру, и восстановить стандартные кривые для определения силы света, прошедшего через ткани мозга рассеяния.
2. Процедура нарезки и электрофизиологии
Часть: Slice подготовка
- Обезболить (60 мг / кг кетамина и 2mg/kg Ксилазин) и обезглавить мыши. Рассеките мозга в искусственной спинномозговой жидкости (ACSF, мм: 124 NaCl, KCl 3, 1,3 4 MgSO, 26 3 NaHCO, 1,25 NaHPO 4, 20 глюкозы, 2 CaCl 2; ~ 310mOsm, рН 7,4, когда пропускают со смесью 95% О2 и 5% CO 2, 5,1), заботясь, чтобы не повредить обонятельные луковицы. Отдельные два полушария и место на агар с вентральной поверхности даже с одним ребром (для горизонтальных участков).
- Клей агар и спинной поверхности каждого полушария коры vibrAtome патрон, и медленно заполнить ванну с ледяной ACSF. Фрагмент из вентральной поверхности в 300 мкм разделы, передавая каждый раздел нагревается (34-36 ° С) и кислородом ACSF, что позволяет им восстановиться в течение 30-45 минут.
Часть B: Свободные Измерение патч для Порог для Спайка
- После чего ломтики до комнатной температуры в течение 30 минут, осторожно положите ломтик в записи камеры микроскопа камере при постоянной перфузии кислородом ACSF.
В группе риска чрезмерно стимулирующее ChR2 инфицированных нейронов, наличие EYFP-ChR2 может быть подтверждено при epifluorescence (рис. 2а) - Потяните стеклянных электродов на пипетку съемник (Sutter P-97). Заполните этот электрод с ACSF. При помещении в ванной ACSF наконечник сопротивление должно быть в пределах 7-10 МОм.
- Под флуоресцентным освещением, найдите в срезе здорового ChR2-EYFP нейрона со зрелыми морфологии. Также найти сома этого нейрона под исправления оптики.
- С легкой положительным давлением пропускается через электрод, нижний электрод патч к определены флуоресцентные нейрона. Когда мембрана контакт установлен, быстро отпустите положительным давлением и нанесите небольшое количество и краткие всасывания через кончик. Гига-ом уплотнение должно быть сделано между плазматической мембраной и стены патч электрода.
- Даже если гига-печать не образуется, если электрод достаточно близко к флуоресцентным нейрона пики активности должны давать измеримые местных потенциальном поле. Активировать ChR2 в этот нейрон миганием различные дозы света. Потому что свет дозой является функцией как индикатор мощности и продолжительности, подсчитать, сколько света необходимо, чтобы вызвать потенциал действия на нескольких держав и длительности (рис. 2б). Также обратите внимание, сколько пики происходит при освещении ртутной лампой.
3. Представитель Результаты:
На нашем микроскоп (Olympus BX51WI), наш индикатор ян линию с 2-мя отверстиями и конденсатор объектив, тем самым сохраняя оригинальный оптический путь от заводской установки дуговой лампы. При закрытии и диафрагмы поля и aperature диафрагмы, мы сможем добиться светлого контраста достаточным для исправления записей зажим (рис. 1б). Со всеми полностью открытой диафрагмы мы выставляем ломтик максимальной мощности света для channelrhodopsin активации (рис. 1а). На нашем микроскоп, это исправление конфигурации производит свет плотности, что составляет примерно три порядка ниже, чем максимально полного поля плотности (4,1 мкВт / мм 2 по сравнению с 6,88 мВт / мм 2).
Мы видим, надежная маркировка взрослых родился обонятельной луковицы и гранулы periglomerular нейронов недели после инфекции лентивирусов мигрирующих нейробластов в ростральной миграционных потоков (рис. 2а) свободную патч записи с одним взрослым родился ChR2-EYFP выразить ЗК указывает, что 5 мс стимуляции максимемкм мощности (6,88 мВт / мм 2) достаточно, чтобы вызвать пики (рис. 2б). Поскольку выражение уровня колеблется в пределах клетки, количество света, проходящего порог шип будет меняться и должно быть описано статистически для каждого типа клеток, представляющих интерес.
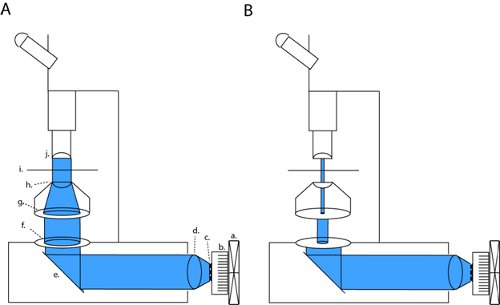
Рисунок 1. Светодиодов установка для всего месторождения фотостимуляции и патч-зажим ломтик электрофизиологии. Для активации channelrhodopsin (ChR2) мы проектируем коллимированного пучка через открытые отверстия назад и конденсатор оптики (). Эта конфигурация может быть изменена в высокую контрастность оптики исправления путем полного закрытия области диафрагмы и модуляции ширина полевой диафрагмы (б). Сокращения: а вентилятор, радиатор б, г. светодиодов, д. коллимирующей линзы, д. зеркало, f. полевой диафрагмой, г. диафрагма, д. конденсатора линзы, И. С.mple этапе j. цели.
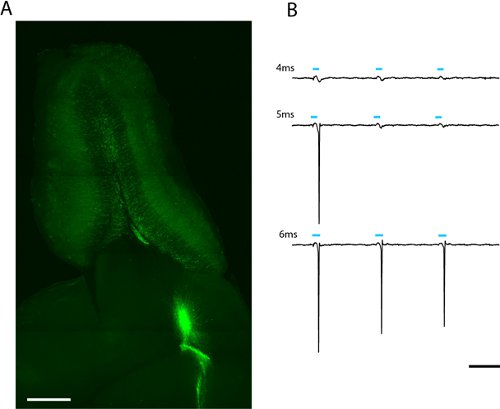
Рисунок 2. Изображение 300μm горизонтальный срез обонятельной луковице для зажима патч и целые поля фотостимуляции (а). Lentivirally инфицированных взрослых родился гранул клеток, экспрессирующих ChR2-EYFP можно увидеть, исходящих из ядра обонятельной луковице. Световых дозы, необходимой, чтобы вызвать пики могут быть найдены за счет увеличения продолжительности светодиодной вспышкой (б). Порог для этой ЗК была 5 мс при полной светодиодной интенсивности (2.43mW/mm 2). Шкала в () = 500 мкм, масштаб в (б) = 50 мс.
Обсуждение
В последние годы наблюдается взрыв популярности инструментов optogenetic в области нейронаук 6. В результате, становится все более важным снизить барьер входа для лабораторий, желающих, чтобы начать использовать эти новые инструменты. Здесь мы опишем, как проводить простую и низкой ст...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана компания по страхованию жизни "AG2R-La-Mondiale», Школе нейронаук Парижской (ЕПС), Национальное агентство по La Recherche "ANR-09-NEUR-004" в рамках "ERA-NET NEURON "7РП программы Европейской комиссии и Пастера Foundation. Себастьян Вагнера была поддержана Letten Foundation.
Материалы
| Name | Company | Catalog Number | Comments |
| Ketamine | Imalgène 1000 | 100 mg/ml | |
| Xylazine | Rompun | 2% | |
| NaCl | Sigma-Aldrich | S5886 | &nbps; |
| KCl | Sigma-Aldrich | P5405 | |
| MgSO4 | Sigma-Aldrich | M1880 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| NaHPO4 | Sigma-Aldrich | S5011 | |
| Glucose | Sigma-Aldrich | G7021 | |
| CaCl2 | Sigma-Aldrich | C7902 | |
| Agarose | Sigma-Aldrich | A9539 | |
| Pipette Puller | Sutter Instrument Co. | P-97 | |
| Glass Capillaries | Harvard Apparatus | GC150T-10 | 1.5 mm O.D./1.17 mm I.D. |
| LED array | Bridgelux | BXRA-C2000 | |
| Collimating lens | Thorlabs Inc. | LEDC1 | 40 mm beam diameter |
| Power supply | A1W Electronik | HKO2800 | 2.8 amp |
| Optical power meter | Thorlabs Inc. | PM 100 | |
| Heatsink | Thermaltake | A1838 | Silent Boost K8 |
| Fan | Thermaltake | A1838 | Silent Boost K8 |
| Vibratome | Leica Microsystems | VT1200S |
Ссылки
- Nissant, A. Adult neurogenesis promotes synaptic plasticity in the olfactory bulb. Nature Neuroscience. 12, 728-730 (2009).
- Apicella, A. Pyramidal Cells in Piriform Cortex Receive Convergent Input from Distinct Olfactory Bulb Glomeruli. Journal of Neuroscience. 30, 14255-14260 (2010).
- Boyden, E. S. genetically targeted optical control of neural activity. Nature. 8, 1263-1263 (2005).
- Bardy, C. where new inhibitory neurons release neurotransmitters in the adult olfactory bulb. The Journal of Neuroscience. 30, 17023-17034 (2010).
- Grubb, M. S. Functional maturation of the first synapse in olfaction: development and adult neurogenesis. The Journal of neuroscience. 28, 2919-2932 (2008).
- Zhang, F. Circuit-breakers: optical technologies for probing neural signals and systems. Nature reviews. Neuroscience. 8, 577-581 (2007).
- Grossman, N. Multi-site optical excitation using ChR2 and micro-LED array. Journal of neural engineering. 7, 16004-16004 (2010).
- Dhawale, A. K. Non-redundant odor coding by sister mitral cells revealed by light addressable glomeruli in the mouse. Nature neuroscience. 13, 1404-1412 (2010).
- Weick, J. P. Functional control of transplantable human ESC-derived neurons via optogenetic targeting. Stem cells. 28, 2008-2016 (2010).
- Toni, N. Neurons born in the adult dentate gyrus form functional synapses with target cells. Nature Neuroscience. 11, 901-907 (2008).
- Grubb, M. S., Burrone, J. Channelrhodopsin-2 Localised to the Axon Initial Segment. PLoS ONE. 5, e13761-e13761 .
- Tye, K. M. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature. 471, 358-362 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены